作者简介: 冯彩平, 女, 1972年生, 吕梁学院生命科学系副教授 e-mail: 627752817@qq.com
运用多重光散射光谱、 多散斑扩散波光谱和动态光散射光谱分析了柠檬酸钠(TSC)对谷氨酰胺转移酶(TG酶)山羊乳凝胶特性的影响。 将浓度分别为0, 20, 40, 60和80 mmol·L-1 的TSC加入到脱脂羊乳中, 经过TG酶处理后进行酸化凝乳。 凝乳形成过程中, 动态光散射光谱显示, 随着TSC浓度的增加, 酪蛋白胶束的直径从(142.0±11.2) nm下降到(24.4±2.1) nm; 在凝胶形成的前5 h内, 在不同TSC浓度条件下, 样品的背散射光强度分别从41.9%±0.3%, 35.8%±0.4%, 25.3%±0.5%, 10.6%±0.3%和5.3%±0.4%, 增加到55.8%±0.6%, 49.5%±0.5%, 41.9%±0.4%, 37.8%±0.4%和30.8%±0.3%, 表明TSC的浓度越高, 凝胶体系中颗粒的尺寸越小, 形成的凝胶构筑单元越小; 同时, 多散斑扩散波光谱的均方位移曲线显示, 凝胶的突变时间分别为31, 74, 98, 151和226 min, 表明TSC的浓度越高, 山羊乳凝胶形成时间越长; 凝胶的持水力与硬度值分析发现, TSC将羊乳酪蛋白胶束分解成更小的颗粒, 在TG酶作用下形成更多的共价键连接位点, 形成的凝胶具有更高的硬度和持水能力。
In this study, the effect of sodium citrate (TSC) on the characteristics of transglutaminase (TGase) goat milk gels was analyzed using multiple light scattering, multiple speckle diffusion wave spectroscopy, and dynamic light scattering spectroscopy. TSC was added to skimmed goat milk to concentrations of 0, 20, 40, 60, and 80 mmol·L-1, and the milk was acidified by gluconolactone (GDL) after TG enzyme treatment. Dynamic light scattering spectra indicated that on increasing the TSC concentrations in the range of 0 to 80 mmol·L-1, the diameter of casein micelles decreased from (142.0±11.2) to (24.4±2.1) nm; The intensity of the backscattered light was increased from 41.9%±0.3%, 35.8%±0.4%, 25.3%±0.5%, 10.6%±0.3%, and 5.3%±0.4% to 55.8%±0.6%, 49.5%±0.5%, 41.9%±0.4%, 37.8%±0.4% and 30.8%±0.3%, respectively, indicating that the higher the concentration of TSC, the smaller the size of the particles in the gel system, and the smaller the gel building units formed; At the same time, the mean square displacement curves of the multi-speckle diffuse wave spectrum showed that the gel mutation time was 31, 74, 98, 151 and 226 min, respectively, indicating that the higher the concentration of TSC, the longer gelation time. The water holding capacity and hardness values of the resulted gels was negatively related to the TSC concentrations.
近年来, 多重光散射技术和多散斑扩散光谱法广泛应用于凝胶形成过程及其特性的分析。 多重光散射技术能在较短时间内检测出凝胶体系聚集、 絮凝及沉淀等现象; 多散斑扩散波光谱学通过研究样品微观结构变化, 实现凝胶化进程的静态、 非接触式监控, 从而评价凝胶的流变特性。 另外, 多重光散射技术和多散斑扩散光谱法无需对样品进行处理, 更能真实地反映乳凝胶的状态。
酸奶以其独特的风味、 细腻的口感和较高的营养价值而深受人们的青睐[1]。 与牛乳酸奶相比, 山羊乳酸奶的致敏性低, 蛋白质、 矿质元素和维生素含量高, 具有广阔的市场前景[2]。 但是, 山羊乳酸奶在贮藏或运输过程中易发生乳清析出和质地易碎等现象, 如何改善山羊乳酸奶的质构特性是行业亟待解决的问题[3]。
酪蛋白胶束是构筑酸奶凝胶的基本单元, 它是由四种酪蛋白单体和磷酸钙相互缠绕在一起形成的复合体。 酪蛋白胶束在酸化的作用下通过非共价键(疏水作用力和氢键等)相互聚集形成凝胶, 凝胶的连接作用力较低[4]。 引入共价键可以增强酸奶凝胶强度, 其中谷氨酰胺转移酶(TG酶)催化蛋白质间(或内)酰基转移反应, 增加了酸奶的凝胶强度和持水性[5]。 然而, 由于羊乳的酪蛋白胶束粒径较大, 比表面积小, TG酶的交联位点有限, 即使经过TG酶处理后的山羊乳凝胶结构仍然不均且很脆弱[6]。 已有研究证实, 柠檬酸钠(TSC)可使酪蛋白胶束解离形成小的亚胶束[7], 可能改变TG酶交联位点的个数, 从而影响凝胶的强度和持水力[8, 9]。 目前尚无TSC辅助TG酶处理对山羊乳凝胶性质影响的研究报道。
本研究综合运用动态光散射、 多重光散射和多散斑扩散波光谱法等技术实时跟踪监测TSC辅助TG酶处理的山羊乳凝胶形成过程中的变化[10, 11], 阐明其促进凝胶特性机制。
多重光散射分析仪, 法国Formulaction公司; 多散斑扩散波光谱分析仪, 法国Formulaction公司; 动态光散射仪, 英国Malvern公司; TMS-Pro型质构仪, 美国FTC公司; 万分之一分析天平, 美国 Denver公司; HW-W2· 600型智能恒温水浴箱, 北京东方精锐科技发展有限公司; 低速台式大容量离心机, 上海安亭科学仪器厂; THZ-22台式恒温振荡器, 北京科尔德科贸有限公司; HJ-6A型数显恒温多头磁力搅拌器, 江苏省金坛市荣华仪器制造有限公司。
新鲜羊乳, 北京中地乳品公司提供; 柠檬酸钠(TSC), 国药集团化学试剂有限公司; 谷氨酰胺转移酶(TG酶), 德国C& P Group GmbH公司, 酶活性为200 U· g-1; 葡萄糖酸-δ -内酯(GDL), 美国Sigma公司; 其他使用的化学试剂均为分析纯。
1.2.1 原料羊乳的处理
对山羊乳离心处理(3 000 g, 25 ℃, 30 min), 去除上层脂肪及其他杂质, 置于4 ℃冷藏条件下备用。
1.2.2 TG酶分散体的制备
将一定量的TG酶分散在超纯水中, 于25 ℃ 600 r· min-1磁力搅拌30 min。 将分散液在25 ℃下以3 000 g进一步离心10 min以除去底部的杂质, 使用前4 ℃冷藏备用。
1.2.3 山羊乳凝胶样品的制备
向山羊乳中缓慢加入TSC(置于磁力搅拌器上连续搅拌), 使其浓度分别为0, 20, 40, 60和80 mmol· L-1。 用0.5 mol· L-1的乳酸调节pH至6.6, 然后加入一定体积的TG酶分散液(使其酶活为10 U· g-1乳蛋白), 在42 ℃的水浴中放置2 h, 然后添加1.5% GDL后进行测试。
1.3.1 多重光散射分析
利用多重光散射技术, 结合分散体系中的背散射光强度变化实时监测酸羊乳中凝胶的形成过程[12]。 其主要原理是: 检测器得到的透射光和背散射光强度直接由羊乳中酪蛋白胶束的浓度(体积百分数)和尺寸决定。 通过测量透射光和背散射强度的变化, 就可以知道样品在某一截面浓度或颗粒粒径的变化, 特点是可以通过背散射光强值的变化直接反映出山羊乳中颗粒的浓度和尺寸的变化, 而无需对山羊乳进行稀释, 避免了由于稀释后导致的无法检测凝胶形成过程的缺陷。
检测时, 将15 mL添加了GDL的山羊乳倒入专用玻璃池内, 放入多重光散射仪中进行检测。 测定参数: 温度42 ℃, 共扫描5 h。
1.3.2 胶凝流变特性分析
利用多散斑扩散波光谱仪测量山羊乳凝胶的流变性能, 通过光学测量得出流变数据, 评价山羊乳凝胶的流变特性。 扩散波光谱法是动态光散射技术(DLS)在高浓度体系中的应用[13]。 其主要原理是: 利用DWS测量背散射光强度随时间的变化, 得到分散在样品中的颗粒的均方位移MSD, MSD曲线弹性平台区部分的高度, 定义为样品的弹性因子(EI), 是计算去相关时间为2.5 ms和1.5 s时间段内, MSD曲线由高度的倒数得到[14]。
将15 mL添加了GDL山羊乳倒入专用玻璃池内, 放入多散斑扩散波光谱分析仪中进行检测。
1.3.3 粒度分析
利用马尔文粒度分析仪分析不同浓度TSC山羊乳凝胶的粒径。 马尔文粒度分析仪是使用动态光散射技术测量样品中粒子的布朗运动, 然后使用已建立的理论拟合实验原始数据从而得到粒子的粒径和分布[15]。 检测时取20 μ L于10 mL离心管中, 加6 mL水稀释200倍, 放入样品池中检测, 每个样品测5次, 取平均值。
1.3.4 持水力检测
取山羊乳凝胶样品7 mL于10 mL离心管中, 置于42 ℃水浴中凝乳12 h, 取出后置离心机中于3 000 rad离心25 min, 称量弃去乳清液后的样品, 计算其持水力。
1.3.5 质构检测
取山羊乳凝胶样品25 mL于质构仪专用样品杯中, 置于水浴锅中42 ℃水浴15 h后取出, 恢复室温后置于质构仪上测其硬度, 平行做6个样品。 测定参数: 最大量程100 N, 触发力0.05 N, 检测速度30 mm· min-1, 穿刺距离10 mm, 回程速度60 mm· min-1, 回程距离10 mm。
含有不同浓度TSC的羊乳在酸化过程中的背散射光强度随时间的变化见图1。 在凝胶形成初期, 分别添加了0, 20, 40, 60和80 mmol· L-1 TSC浓度的分散体系的背散射光强值分别为41.9%± 0.3%, 35.8%± 0.4%, 25.3%± 0.5%, 10.6%± 0.3%和5.3%± 0.4%; 形成凝胶后, 对应的背散射光强值分别为55.8%± 0.6%, 49.5%± 0.5%, 41.9%± 0.4%, 37.8%± 0.4%和30.8%± 0.3%。 由此可见, TSC浓度越高, 背散射光强变化值越大。 体系的背散射光强取决于体系中蛋白的浓度颗粒和大小, 蛋白浓度越高, 颗粒越大, 体系的背散射光强值越高[16]。 在本研究中, 所有样品中山羊乳的组成均一致, 所以蛋白浓度是一致的, 其背散射光强值的变化是由颗粒的大小引起的。 由此可见, TSC的浓度越高, 在凝胶开始的阶段, 酪蛋白胶束的解离程度越大, 体系中颗粒的尺寸越小, 因此背散射光强值越高; 随着时间的延长, 颗粒之间相互结合形成的凝胶结构越致密, 孔隙越小, 因此背散射光强值越低。
TSC对山羊乳凝胶酪蛋白胶束的扩散波光谱学特征的影响见图2。 酸羊乳体系中的颗粒均方位移(MSD)是表征其扩散光谱学特征的主要指标。 通过MSD曲线可以有效地反映出样品的粘弹性特征。 对于牛顿流体而言, 样品的MSD曲线随着时间的变化呈直线变化趋势; 对粘弹性体系而言, 体系的MSD值将受到限制, 颗粒被三维网络结构包裹, 因此, MSD曲线随时间的变化曲线中将出现明显的平台区。 从MSD曲线图可以看出, 图中所指分界线曲线由直线突变为S型曲线, 0~80 mmol· L-1 TSC浓度的蛋白胶束曲线突变时间分别为31, 74, 98, 151和226 min, 表明随着TSC浓度的增加, 山羊乳开始形成凝胶的时间呈明显的增加趋势。 柠檬酸的pK1=3.13, pK2=4.76和pK3=6.40。 山羊乳酸化过程中的pH值是6.6~4.2, 因此在酸化过程中柠檬酸表现出较强的缓冲性能, 直接导致山羊乳凝胶形成时间的延长。
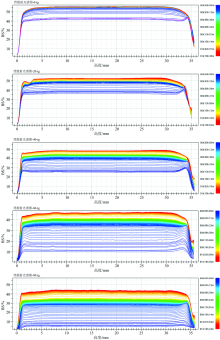 | 图1 0~80 mmol· L-1柠檬酸钠的山羊乳酸化过程中的背散射光强度变化曲线Fig.1 The curve of the intensity of backscattered light during the acidification of goat’ s milk with 0~80 mmol· L-1 sodium citrate |
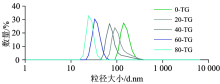
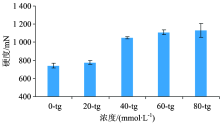
TSC对TG酶处理的山羊乳酪蛋白胶束尺寸的影响见图3。 随着TSC浓度的增加, 颗粒的平均直径呈现明显的下降趋势, 从(142.0± 11.2) nm下降到(24.4± 2.1) nm。 这表明凝乳分散体中的酪蛋白胶束的尺寸随着TSC浓度的增加而降低。 有研究已证明, 钙离子螯合剂可以通过从胶束中去除钙来破坏胶束框架, 导致酪蛋白胶束的解离[15]。 因此柠檬酸根离子会降低酪蛋白胶束的尺寸。 尺寸越小的酪蛋白颗粒, 其比表面积越大, TG酶对其交联的效率越高, 因此形成的凝胶强度越大。
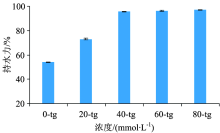
TSC对酸诱导的山羊乳凝胶的持水力的影响见图4。 当TSC浓度达到40 mmol· L-1, 持水能力高于95 %, 显著高于0 mmol· L-1(空白组, 持水力54.0%± 0.3%); 当达80 mmol· L-1时, 持水力接近100%。 这表明, TSC的存在, 能够提高山羊乳凝胶的持水力, 并且随着TSC浓度增加, 凝胶显示出更高的保水性。 这与凝胶的坚硬程度有关, 因为弱凝胶倾向于流动, 导致易收缩和乳清排出。
综合运用多重光散射光谱、 多散斑扩散波光谱和动态光散射光谱技术分析了柠檬酸钠(TSC)辅助谷氨酰胺转移酶(TG酶)处理对山羊乳凝胶性质影响。 动态光散射结果显示在0~80 mmol· L-1 范围内, 随着TSC浓度的增加, 酪蛋白胶束的直径呈降低趋势; 在山羊乳酸化的前5 h内, 多重光散射光谱结果显示TSC浓度越高, 体系中颗粒的尺寸越小, 形成的凝胶的构筑单元越小; 多散斑扩散波光谱的均方位移曲线显示TSC浓度越高, 山羊乳凝胶形成时间越长; 持水力和硬度均呈增加趋势。 由此说明, TSC将羊乳酪蛋白胶束分解成更小的颗粒, 在TG酶存在下形成酸诱导的凝胶, 其具有更高的硬度, 更好的持水能力, 更多的互连网络和比天然酪蛋白胶束更小的孔, 并且TSC浓度越大, 形成的凝胶粒越强, 持水能力越好。 因此, TSC辅助TG酶处理改善了山羊乳酸奶的质构特性, 能够使山羊乳酸奶产品的质量更加符合消费者的需求。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|