作者简介: 王晓霞, 女, 1984年生, 内蒙古科技大学化学与化工学院讲师 e-mail: wxx572369@163.com
盐酸四环素属于抗生素类, 目前有关盐酸四环素和牛血清白蛋白二级结构的影响及作用机理报道较少。 在模拟生理条件下, 采用荧光光谱法、 三维荧光光谱法、 紫外-可见光谱法、 圆二色谱法和傅里叶红外光谱法以及分子对接模拟法, 研究了盐酸四环素与牛血清白蛋白(BSA)之间的相互作用。 荧光光谱表明, 盐酸四环素能有效猝灭BSA的内源荧光, 猝灭机制属静态猝灭, 通过Stern-Volmer方程计算结合常数Ka为2.813×105 L·mol-1(298 K)。 根据Vant’s Hoff方程确定结合过程中的热力学参数Δ S=-151.1 J·mol-1·K-1、 Δ H=-76.09 kJ·mol-1两者之间作用为氢键和范德华力。 同步荧光光谱、 紫外光谱、 三维荧光光谱、 红外光谱、 圆二色谱结果证明盐酸四环素能够改变BSA的二级结构和微环境。 根据Föster’s非辐射能量转移理论, 盐酸四环素与BSA结合距离为0.49 nm。 希尔系数( nH)值小于1, 表明盐酸四环素与BSA结合后存在药物间协同作用。 圆二色谱(CD)定量测定了盐酸四环素与BSA作用前后的二级结构含量: α-螺旋含量增加了9.16%(1:1)。 分子对接模拟表明盐酸四环素通过氢键、 疏水作用和范德华力等多种作用力结合在BSA的site Ⅰ(亚域ⅡA)。 本研究有助于了解盐酸四环素与BSA的作用机制, 也有助于理解盐酸四环素对蛋白质在储运过程中功能的影响。
Tetracycline HCl is a new member of the class of antibiotics. Therefore, its effects on the secondary structural of Bovine Serum Albumin, and the mechanism of action are poorly understood. The interaction between Tetracycline HCL and BSA were investigated with fluorescence spectroscopy, three-dimensional fluorescence spectroscopy, ultraviolet spectroscopy, circular dichroism (CD), infrared spectroscopy and molecular docking under imitated physiological conditions. The analysis of fluorescence spectra showed that Tetracycline HCl could strongly quenching the fluorescence of BSA and the quenching process is a static process. The effective binding constants (Ka) were calculated to be 2.813×105 L·mol-1(298 K) by stern-volmer equation. According to the Vant’s Hoff equation, the thermodynamic parameters were calculated to be Δ S=-151.1 J·mol-1·K-1 , Δ H=-76.09 kJ·mol-1, indicating that the predominant forces in the complex were hydrogen bonding and Van der Waals forces. The results of synchronous fluorescence, UV spectrum , FT-IR , CD spectrum and three dimensional fluorescence spectrum, futher demonstrated that the secondary conformation and micro-environment of BSA has been changed after interaction with Tetracycline HCL. Based on the Föster’s theory of non-radiation energy transfer, and the specific binding distance between Tetracycline HCL-BSA system was 0.49 nm. Hill’s coefficients ( nH<1) proved that a negative cooperativity was found when Tetracycline HCLbound to BSA. The alteration of the protein secondary structure were quantitatively calculated from circular dichrosim (CD) spectroscopy with increase of α-helix content about 9.16%(1:1). The result of molecular docking simulation revealed that Tetracycline HCL was located in sudlow’s site I corresponding to subdomain IIA through multiple interactions-hydrogen bond, hydrophobic and vander waals, etc. This research will provide valuable information for understanding the action mechanism of Tetracycline HCl with BSA, and is helpful for understanding its effect on protein function during the storage and transport process.
盐酸四环素(tetracycycine hydrochloride), 分子式为C22H24N2O8· HCl, 抗生素类, 属广谱抗生素[1]。 抗生素类药物普遍用于细菌感染, 在临床医学中得到了大量的应用。
血清白蛋白是血浆中主要成分, 由585个氨基酸残基组成, 能够携带许多药物活性分子[2]。 因为血液中含有大量易于被提纯的血清白蛋白, 所以科学家把研究血清白蛋白作为切入点来研究其他蛋白质。
现阶段国内外对药物与蛋白质的结合作用的研究已经很多, Otavio Augusto Chaves[3]利用荧光光谱法研究人类血清白蛋白和脱镁叶绿素的相互作用; Md.Abdus Salam[4]等通过荧光光谱法研究西地那非柠檬酸盐与牛血清白蛋白的体外相互作用。 而关于用荧光光谱法、 紫外分光法、 傅里叶红外光谱法和圆二色谱法等方法研究盐酸四环素与牛血清白蛋白相互作用的文章还未见报道。
实验应用荧光光谱法、 圆二色谱法、 傅里叶红外光谱法和分子对接法, 同时模拟生理条件, 探讨了盐酸四环素与牛血清白蛋白的光谱特征变化规律和分子对接情况, 分析并总结图谱信息和分子对接结果。 通过计算结合常数、 结合距离、 热力学参数、 Hill系数等再次证明并补充已得结论。 通过多光谱法和分子对接的研究, 可以在分子水平上了解盐酸四环素分子在体内的传输和分布, 为以后盐酸四环素的广泛应用提供了数据参考。
荧光分光光度计(LS-55, 美国PerkinElmer公司); 紫外分光光度计(SPECORD50, 德国耶拿分析仪器股份公司); 数显恒温振荡器(SHA-B, 金坛市医疗仪器厂); 智能超声波清洗器(DL-121, 上海之信仪器有限公司); 实验室pH计(EL20, 上海梅特勒-托利多公司); 电子天平(TP-114, 北京丹佛仪器有限公司); 傅里叶近红外光谱仪(MPA, 德国布鲁克公司); 圆二色谱仪(Jasco-715, 北京国嘉恒业科学仪器有限公司)。
盐酸四环素(tetracycycine hydrochloride)质量分数97.5%, 中国药品生物制品检定所; 牛血清白蛋白(bovine serum albumin, BSA)质量分数98%, 上海金橞生物科技有限公司; 三(羟甲基)氨基甲烷(Tris), 纯度99.5%, 天津市东华试剂厂; HCl, 北京化工厂; NaCl, 纯度99.7%, 天津市光复科技发展有限公司。 实验所用试剂均为分析纯, 实验用水均为二次蒸馏水。
准确称取0.004 8 g的盐酸四环素药品, 用二次蒸馏水溶解, 配制1× 10-4 mol· L-1的盐酸四环素溶液; 准确称取2.922 g NaCl, 用二次蒸馏水溶解, 配制0.5 mol· L-1的NaCl溶液; 准确称取1.211 4 g Tris, 用二次蒸馏水溶解, 配制0.1 mol· L-1的Tris溶液; 取适当0.1 mol· L-1的Tris溶液, 滴加HCl, 用pH计测量其pH值, 配制pH 7.40的Tris-HCl溶液; 准确称取0.335 0 g BSA, 用二次蒸馏水溶解, 配制5× 10-5 mol· L-1的BSA溶液。
1.3.1 荧光光谱、 同步光谱的测定
准确移取浓度为1× 10-4 mol· L-1的盐酸四环素溶液0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0和4.5 mL于10 mL比色管中, 并用移液管向每个比色管中移入1 mL的5.0× 10-4 mol· L-1的BSA溶液, 用蒸馏水定容, 放入的恒温振荡器中振荡30 min后取出, 用荧光分光光度计测量。
在荧光光谱扫描中, 参数设置为: 发射波长(Em)范围为290~550 nm, 荧光激发波长(Ex)设定为280 nm, 狭缝宽度为9.0 nm, 扫描速度为1 500 nm· min-1, 测量并记录相应的荧光值。 在同步荧光光谱的扫描中, Δ λ =15 nm和Δ λ =60 nm。 记录发射波长为265和310 nm处的荧光值进行计算。
1.3.2 紫外光谱的测定
用上述方法配置盐酸四环素浓度为0, 0.5× 10-5, 1.0× 10-5, 1.5× 10-5, 2.0× 10-5, 2.5× 10-5, 3.0× 10-5, 3.5× 10-5, 4.0× 10-5, 4.5× 10-5 mol· L-1, BSA的浓度为5.0× 10-6的混合溶液于10 mL比色管中。 放入298, 303和308 K的恒温振荡器中振荡30 min后取出, 用紫外分光光度计测量。 测量波长为190~400 nm, 用二次蒸馏水做参比。
1.3.3 三维荧光光谱测定
向两只10 mL比色管中移取0.2 mL浓度为0.5× 10-5 mol· L-1的BSA溶液, 移取1 mL浓度为1× 10-4 mol· L-1的盐酸四环素溶液于比色管中, 用二次蒸馏水定容, 摇匀。
在常温下用荧光分光光度计测量三维荧光光谱图, 参数设置为发射波长: 200~500 nm, 激发波长200 nm, 狭缝宽度为7.5 nm, 扫描速度1 500 nm· min-1, 组分数为30组, 激发波长间隔为5 nm。
1.3.4 结合距离的测定
在三支比色管中分别配制成BSA浓度6.0× 10-7 mol· L-1; 盐酸四环素浓度为6.0× 10-7 mol· L-1以及BSA和盐酸四环素浓度均为6.0× 10-7 mol· L-1的溶液。 放入298 K温度下的恒温振荡器中振荡30 min。
对盐酸四环素溶液进行紫外光谱测定, 对BSA溶液和BSA-盐酸四环素混合液进行荧光光谱测定。 荧光光谱仪的参数为发射波长设定为290~550 nm, 激发波长设定为280 nm。 狭缝宽度9.0 nm。 扫描速度1 500 nm· min-1。 紫外的吸收波长为190~400 nm。
1.3.5 红外光谱的测定
在两支比色管中, BSA的浓度为1.0× 10-5 mol· L-1, 盐酸四环素的浓度为0, 1.0× 10-5 mol· L-1。 红外实验以二次蒸馏水做参比, 所有药品溶液在4 cm-1分辨率下扫描2 000次收集水汽光谱, 使用OMNIC5.2数据处理软件自动进行水汽校正; 室温敞开状态下收集背景, 然后将样品均匀地铺满ATR的ZeFe晶片, 在4 cm-1分辨率下扫描512次样品光谱。
1.3.6 圆二色谱的测定
在两支比色管中, BSA样品浓度为1.0× 10-6 mol· L-1, 盐酸四环素样品浓度为1.0× 10-6, 5.0× 10-6 mol· L-1。 以Tris-HCl为参比, 圆二色谱的扫描范围为190~260 nm, 激发和发射狭缝均为1 nm, 扫描速度为3.3 nm· s-1, 光谱矫正设为开启消除光栅和检测器相应的波长。
1.3.7 分子对接模拟技术
BSA的晶体结构取自蛋白质数据库RCS Protein Data Bank(蛋白质编码: 4f5s, http://www.rcsb.org/pdb/pdb/home/home.do)。 由Chem3D Pro 14.0软件画出盐酸四环素的分子结构式, 保存为pdb格式文件, 利用网页(http: //zdock.umassmed.edu/)程序Z-Dock进行结合位点的选择和绑定点残留的选择, 然后进行分子对接模拟, 得出相应数据与分子对接结构图进行分析。
BSA中含有色氨酸残基(Trp)、 酪氨酸残基(Tyr)和苯丙氨酸残基(Phe), 这些残基的存在使得BSA具有比较强的内源荧光[2], BSA荧光强度下降的现象就成为荧光猝灭现象, 荧光猝灭有两种猝灭类型: 静态猝灭和动态猝灭。
静态猝灭是指荧光生物大分子与荧光猝灭剂分子借助分子间作用力, 结合成具有一定特殊结构的大分子化合物, 从而使大分子物质在生物体内内源荧光强度减弱。 因为形成了大分子化合物, 所以稳定性起主导作用, 温度越高, 猝灭常数越小, 其作用机理可以用Lineweaver-Burk双倒数方程[5]式(1)描述
在动态猝灭体系中: 升高温度, 会增大体系中离子有效碰撞数目, 加速游离电子转移的速率和频率, 所以随着温度的升高动态猝灭常数会不断增加。 其作用机理可以用Stern-Volmer方程[6]描述
在式(1)和式(2)中: F0和F分别表示未加盐酸四环素和加入盐酸四环素后的荧光猝灭强度; KLB为静态猝灭常数; KSV为Stern-Volmer荧光猝灭常数; Kq为动态猝灭速率常数; [Q]为实验测量时盐酸四环素溶液浓度; τ 0为不存在猝灭剂情况下大分子物质生物体内的内源荧光寿命(τ 0≈ 10-8 s)[6]。
由图1可以看出, BSA在激发波长280 nm的激发下, 在346 nm处产生最大荧光发射峰。 在不同温度下, 增大盐酸四环素浓度, BSA在346 nm处的荧光值逐渐下降, 荧光峰的位置基本不变。
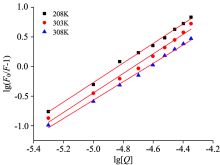
假设盐酸四环素对BSA的荧光猝灭为动态猝灭, 以荧光强度F/F0比值对相应的盐酸四环素浓度[Q]作图, 分别绘制298, 303和308 K下盐酸四环素对BSA荧光猝灭影响的Sterm-Volmer曲线, 如图2所示。 然后对实验测量数据结果进行线性拟合运算, 得线性方程、 荧光系数等数值如表1所示。
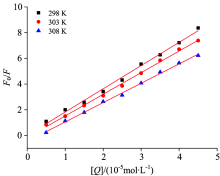 | 图2 不同温度下的盐酸四环素对BSA荧光猝灭的Stern-Volmer方程曲线图Fig.2 Stern-Volmer equation curve for the quenching of BSA by tetracycline hydrochloride at different temperatures |
| 表1 Stern-Volmer线性方程和相关系数 Table 1 Stern-Volmer linear equations and correlation coefficients |
能发生荧光猝灭效应的小分子物质对生物大分子蛋白质物质的最大扩散速率常数Kq一般为2.0× 1010 L· mol-1· s-1[7]。 由表1可知, 在298, 303和308 K温度下, Kq的值均远远大于最大扩散碰撞常数2.0× 1010 L· mol-1· s-1, 证明盐酸四环素对BSA的荧光猝灭作用是静态猝灭。 由实验结果计算所得的动态猝灭常数KSV随着温度的升高而减小, 进一步证明了盐酸四环素-BSA大分子结构复杂化合物的静态猝灭作用。
通过计算可知静态荧光猝灭作用是导致盐酸四环素与BSA荧光猝灭最主要的原因, 对于静态猝灭过程, 假设蛋白质上存在n个等同的独立结合位点, 利用静态猝灭双对数式
(3)计算[8]
作不同温度下lg[(F0-F)/F]-lg[Q]双对数曲线坐标图(见图3), 根据图3的斜率和截距计算得出不同温度下的结合常数KA及结合位点数n的数值。
| 表2 不同温度下表观结合常数KA和结合为点数n Table 2 Apparent bonding constant KA at different temperatures and bindings as points n |
如图3所示, 根据曲线斜率及截距计算求得不同温度T下的表观结合常数KA和结合位点数n的数值, 计算结果如表2所示。 从表2中可以看出盐酸四环素与BSA表观结合常数KA较大, 可达103数量级。 并且随着温度的升高, KA不断减小; 二者的结合位点数在各个温度下也都约为1, 进一步说明盐酸四环素与BSA之间存在结合作用力, 结合紧密, 盐酸四环素能够被BSA分子运输和储备。
根据Ross等[9]归纳出的判断有机小分子与生物大分子物质结合作用力性质的热力学相关规律: 当Δ H> 0, Δ S> 0时, 其作用力为疏水作用力; 当Δ H< 0, Δ S> 0时, 其作用力为静电引力; 当Δ H< 0, Δ S< 0时, 其作用力为氢键和范德华力。 依据热力学公式(4)— 式(6)
分别计算求得298, 303和308 K下Δ G, Δ H和Δ S等热力学函数值, 计算所得结果如表3所示。 从表中数据可以看出: Δ H< 0, Δ S< 0, 表明盐酸四环素与BSA之间的结合作用力主要为氢键和范德华力, Δ G< 0可知该结合是自发进行的。
| 表3 不同温度下的盐酸四环素-BSA相互作用的结合常数和热力学参数 Table 3 Binding constants and thermodynamic parameters of tetracycline-BSA interaction at different temperatures |
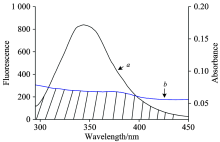
根据Fö rster非辐射能量转移理论, 当两种化合物分子满足供能体发出荧光、 供能体的荧光发射与受体的吸收光谱有足够重叠或者供能体与受能体足够接近, 最大距离不超过7nm时, 将会发生非辐射能量转移[10]。
转移效率(E)、 结合距离(r)、 临界能量转移距离(R0)及光谱的重叠积分(J)之间的关系可用式(7)— 式(9)表示
式中F, F0为盐酸四环素存在与不存在时BSA的荧光强度; K2为空间取向因子, 平均值为 2/3; n为溶剂的折射率, 取水和有机物的平均值1.336; φ 表示无受体存在时能量给体的荧光量子产率(BSA的色氨酸残基的量子产率0.118); J为供能体的荧光发射光谱和受能体的紫外吸收光谱之间的重叠积分; FD为给体在该波长处的荧光强度; 受体在该波长处的摩尔吸光系数单位为L· mol-1· cm-1; 波长单位为nm。 r越小, 蛋白质对药物分子存储与转运就越容易, 就越能发挥药物的药理作用。
由图4所示, 盐酸四环素的紫外-可见光谱曲线与BSA的荧光光谱曲线存在重叠, 这说明盐酸四环素与BSA之间存在非辐射能量转移的可能性。 由矩阵分割积分法求出盐酸四环素和BSA浓度1:1时两者光谱重叠部分积分值J=2.403× 10-20 cm3· mol· L-1。 R0=0.28 nm, r=0.49 nm。 结果表明, 盐酸四环素与BSA反应的结合距离r< 7 nm, 说明盐酸四环素与BSA之间存在非辐射能量转移, 导致BSA荧光猝灭。
协同作用, 是指具有多重配体结合部位的大分子与配体结合时, 各结合部位之间可能会对彼此的结合能力产生影响的现象, 这种影响可以利用Hill[11]方程式计算
式(10)和式(11)中, Y是结合饱和分数, K是结合常数, Q为(F0-F)/F0, Qm为以1/Q对1/D作图的截距的倒数, 之后以lg[Y/(1-Y)]对lgD作图, 得到Hill系数nH, nH=1表示零协同作用; nH> 1表示正协同作用; nH< 1负协同作用。 Hill系数nH计算结果列于表4。
| 表4 Hill系数其线性方程数据表 Table 4 Hill coefficient its linear equation data sheet |
由表4可以看出在不同温度下盐酸四环素-BSA体系的Hill系数都约为1, 表明盐酸四环素与BSA的结合对其他的配体再与BSA结合不会产生影响, 表现为零协同作用。
分子对接技术是快速将药物小分子与蛋白质分子对接的技术。 通过分子对接可以更好的了解蛋白质的二级结构对接形态, 可以直观的了解盐酸四环素与BSA的结合位点和作用力类型。
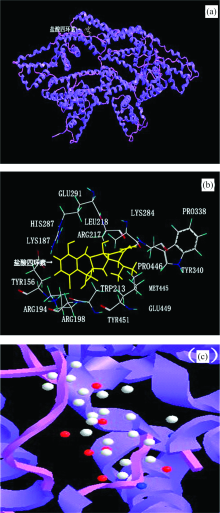
从图5(a)可以看出BSA的立体结构呈心形, 盐酸四环素已经对接到BSA中。 BSA共有583个氨基酸残基, 分为三个结构域, 每个结构域又含有A和B两个亚结构域。 研究表明, 大多数药物分子与BSA的作用位置位于由亚结构域Ⅱ A和Ⅲ A形成的疏水性腔中, 即位点siteⅠ 和site Ⅱ 。 盐酸四环素与BSA的对接更倾向于siteⅠ 点, 即华法林位点[12]。
由图5(b)可见, 盐酸四环素分子周围0.6 nm内共有16个氨基酸残基: TYR156, LYS187, ARG194, ARG198, TRP213, ARG217, LEU218, LYS284, HIS287, GLU291, PRO338, TYR340, MET445, PRO446, GLU449和TYR451, 这些氨基酸残基形成对接口袋, 将盐酸四环素包围住。 由图5(c)可见, 为盐酸四环素与BSA飘带状对接模拟图。 由图5可见, 盐酸四环素与Trp-213氨基酸残基的作用距离更近, 进一步说明盐酸四环素能猝灭BSA的内源荧光。 同时可以观察到盐酸四环素整个分子嵌在BSA对接口袋中的近端结合位点, 说明了盐酸四环素与BSA结合作用力为疏水作用力。
2.7.1 盐酸四环素与BSA相互作用的同步荧光光谱分析
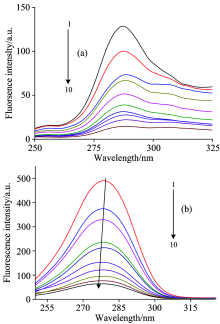
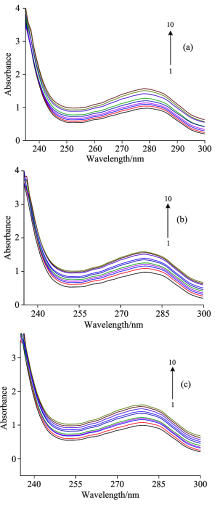
BSA中含有的色氨酸残基(Trp)、 酪氨酸残基(Tyr)及苯丙氨酸残基(Phe)三种有荧光特性的芳香族氨基酸残基。 其发射峰在一定条件下有重叠现象, 普通荧光光谱扫描难以区分特征荧光光谱, 因此需要采用同步荧光光谱法, 以特定荧光发射波长扫描荧光光谱判断蛋白质构象变化情况。 通常情况下, Δ λ =15 nm时, 所得同步荧光光谱显示的是BSA中酪氨酸残基(Tyr)的特征荧光光谱, 而Δ λ =60 nm时则显示的是BSA中色氨酸残基(Trp)的特征荧光光谱[12]。
从图6(a)和(b)可知, BSA在280 nm附近有很强的荧光峰, 并且随着盐酸四环素药物浓度的增加, BSA荧光峰的峰值有下降的趋势。 图6(a)中的发射峰的峰形基本保持不变, 发射峰的峰位基本不变, 说明酪氨酸的荧光猝灭效果不明显; 图6(b)中发射峰的峰形呈规律性变化, 荧光猝灭效果明显, 发射峰的峰位由279.5 nm改变至276.5 nm, 蓝移3 nm。 从而可以判断出盐酸四环素分子通过与色氨酸残基作用使BSA的二级结构发生改变。
2.7.2 盐酸四环素与BSA构象变化影响的三维荧光光谱分析
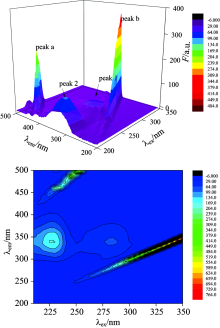
三维激发-发射荧光光谱立体图能非常全面详细地展现被测样品的荧光信息, 为综合考察样品组分分布及结构性变化提供更好的佐证[13]。 按照实验方法, 做BSA和盐酸四环素-BSA体系的三维立体荧光光谱图及三维荧光等高线图, 如图7和图8所示。
三维荧光光谱图有两种类型的峰, 一种为瑞利散射峰: peak a (λ ex=λ em)和peak b (2λ ex=λ em), 另一种是典型的荧光峰: peak1 (Trp残基)和peak2 (Tyr残基)。 从图中可以看出, 当BSA的浓度为1× 10-4 mol· L-1时, 两个荧光峰的峰顶坐标为peak1(λ ex=λ em, F)为(280/340, 67.31), peak2(λ ex=λ em, F)为(230/340, 168.7)。 当加入一定量的盐酸四环素后两个荧光峰的峰顶坐标为peak 1 (λ ex=λ em, F)为(280/337, 42.39), peak 2(λ ex=λ em, F)为(230/336, 109.4)。
从峰的位置分析: 加入盐酸四环素, BSA的瑞利散射峰及荧光峰的位置都没有明显的变化。 从峰的强度分析: 加入盐酸四环素, 瑞利散射峰和荧光峰的强度降低。 说明盐酸四环素在BSA表面结合后, 破坏了BSA表面的保护水层, 使原来较为分散的蛋白质更加分散, 引起蛋白质粒径减小, 荧光强度减弱。
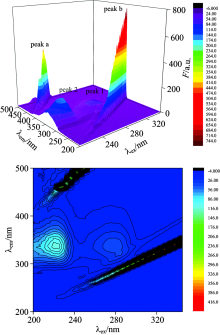 | 图7 BSA溶液的三位荧光光谱及其等高线图cBSA=1× 10-7 mol· L-1Fig.7 Three-dimensional fluorescence spectra of BSA solution and its contourscBSA=1× 10-7 mol· L-1 |
| 表5 三维激发发射荧光光谱特征参数 Table 5 Characteristic parameters of three-dimensional excitation emission fluorescence spectra |
从表5中可以看出峰1的最大发射波长蓝移3 nm, 说明盐酸四环素的加入引起BSA的Trp和Tyr残基周围微环境的变化, 使极性减小, 疏水性增加, 同时峰2的荧光强度降低, 且最大发射波长蓝移4 nm, 说明BSA的肽链结构发生了改变。 由以上的现象和分析结果知, 盐酸四环素与BSA发生相互作用, 并诱导BSA的微环境和BSA的构象均发生变化。
2.7.3 盐酸四环素与BSA体系的傅里叶红外光谱分析
BSA红外光谱的酰胺Ⅰ 带(1 700~1 600 cm-1)主要是其氨基酸残基的C=O伸缩振动吸收。 酰胺Ⅱ 带(1 600~1 500 cm-1)则包括了C— N的伸缩振动和N— H的变形振动[14]。 通过对酰胺Ⅰ 带与Ⅱ 带的观察可以很好地分析出盐酸四环素与BSA的作用情况。
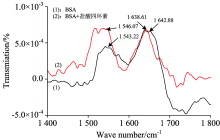 | 图9 BSA, BSA与盐酸四环素红外光谱图c(BSA)=1× 10-5 mol· L-1; c(盐酸四环素)=1× 10-5 mol· L-1Fig.9 Infrared spectra of BSA, BSA and tetracycline hydrochloride |
从图9可以看出, 在加入了盐酸四环素的BSA中, BSA酰胺Ⅰ 带的最大吸收峰从1 642.88 cm-1移动到了1 638.61 cm-1, 蓝移了4.27 nm。 BSA酰胺Ⅱ 带峰位置也发生了明显变化, 最大峰从1 543.22 cm-1移动到了1 546.07 cm-1, 红移了2.85 nm, 峰强度有升高。 红外光谱图的变化可以总结出盐酸四环素使BSA的C=O, C— N键伸缩振动改变, 引起N— H键的变形振动, 造成酰胺峰发生改变, 进一步说明BSA的二级结构发生了改变。
2.7.4 盐酸四环素与BSA体系圆二色谱分析
圆二色谱是研究大分子变化的工具。 通过对圆二色谱数据的分析, 可以计算出蛋白质分子中的α -螺旋结构的含量, 通过其含量的变化可以得知大分子物质的二级结构的变化。
通过圆二色谱对药物小分子与蛋白质分子混合物的测量, 可以灵敏地检测到小分子物质与蛋白质分子结合引起的蛋白质二级结构的变化, 图10为BSA与盐酸四环素按浓度比为1:1, 1:5混合后的CD谱图。
从图10可知, 曲线在208 nm(π -π * 跃迁)和222 nm(跃迁)处出现两个负的特征峰谱带[15]。 这是BSA中α -螺旋结构的特征峰。 随着盐酸四环素的浓度增加, BSA负的特征峰峰值在208和222 nm处强度均有升高, 而峰位基本不变, 可以证明盐酸四环素会使BSA的二级结构发生变化。 圆二色谱仪测试的结果为平均残基椭圆率(mean residue ellipticity, MRE), 单位是deg· cm2· dmol-1 , 并由式(12)和式(13)计算[15]。
式(12)和式(13)中[θ ]为208 nm波长处的椭圆度, 单位为mdeg; N为BSA中氨基酸残基个数, 数值为583; L为所用样品池的光程1 mm; cp为蛋白质的摩尔浓度, 单位为mmol· L-1; MRE208是208 nm的平均摩尔椭圆率; 4 000是β -折叠和无规卷曲构象在201 nm的MRE; 33 000为单纯的α -螺旋结构在208 nm处的MRE值。
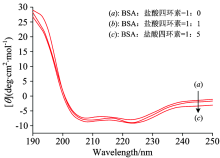 | 图10 BSA与盐酸四环素按1:0, 1:1, 1:5混合后的CD光谱图c(BSA)=1× 10-5 mol· L-1; c(盐酸四环素)(1~3)=(0, 1, 5)× 10-5 mol· L-1Fig.10 CD spectra of BSA mixed with tetracycline hydrochloride at 1:0, 1:1, 1:5 |
由计算结果可知逐渐增加盐酸四环素后BSA的α -螺旋结构含量也随之逐渐增加, 依次为24.65%, 33.81%和38.81%。 表明盐酸四环素与BSA的结合使BSA的二级结构发生改变, 并且以α -螺旋结构的含量为主。 盐酸四环素与蛋白质主要多肽链的氨基酸残基结合, 破坏蛋白质的氢键结构, 蛋白质则采取更松散的构象状态, 导致疏水性增加.该分析结果与同步光谱得出的结论一致。
2.7.5 盐酸四环素与BSA体系紫外光谱分析
紫外分光光谱法是检测化合物与BSA是否形成复合物的有效方法, 可用来研究药物小分子对蛋白质二级结构的影响。 吸收波长在190~400 nm的紫外光谱可以反映蛋白质的主链信息, 在280 nm的紫外吸收光谱可反映芳香族氨基酸残基的信息[16]。
从图11可以看出, 在不同温度下, 盐酸四环素-BSA体系在280 nm处有明显的吸收峰, 且随着盐酸四环素浓度的增大, 280 nm处的吸收峰峰值明显增大, 并可以观察到明显的红移现象。 红移的原因是嵌入药物小分子和蛋白质大分子的碱基对π 电子结合, 作用药物的π * 空轨道与碱基对的π 轨道偶合, 使能量降低, 导致π → π * 跃迁能量降低, 证明盐酸四环素与BSA之间存在着相互作用, 对BSA的二级结构产生了影响。
利用荧光光谱法、 紫外-可见光谱法、 傅里叶红外光谱法、 圆二色谱法、 分子对接法研究了盐酸四环素与BSA之间的相互作用。 通过荧光光谱图和动态猝灭公式Stern-Volmer方程计算发现盐酸四环素对BSA有荧光猝灭作用, 属于静态猝灭; 通过对结合常数KA及结合位点n的计算证明了盐酸四环素与BSA之间结合作用力较强, 结合紧密; 通过对热力学参数与作用力类型的计算得出Δ H< 0, Δ S< 0, Δ G< 0, 确定盐酸四环素与BSA之间是一个熵增加和吉布斯自由能减小的可以自发进行的过程, 且作用类型为氢键和范德华力; 盐酸四环素与BSA反应的结合距离r< 7 nm, 说明盐酸四环素素与BSA之间存在非辐射能量转移, 导致BSA荧光猝灭; 通过对Hill系数的计算发现, nH值约为1, 盐酸四环素与BSA之间存在零协同作用, 说明盐酸四环素与BSA结合后不会对BSA与其他物质的结合产生影响; 通过分子对接结果表明: 盐酸四环素能猝灭BSA的内源荧光, 盐酸四环素整个分子嵌在BSA对接口袋中的近端结合位点, 作用力为疏水作用力; 盐酸四环素和BSA的同步荧光光谱和三维荧光光谱的结果表明: 盐酸四环素与BSA之间的结合会使BSA的构象发生改变; 通过傅里叶红外光谱法的研究发现盐酸四环素对BSA的酰胺峰带有影响; 通过圆二色谱的分析可以知道盐酸四环素对BSA的α -螺旋结构有影响, 随着药物浓度的增大, 会使α -螺旋结构含量减小; 通过对紫外-可见光谱法的研究发现随着盐酸四环素浓度增加, 280 nm处的吸收峰明显增大, 并且伴随着红移现象, 证明了盐酸四环素改变了BSA的二级结构。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|