作者简介: 孙传强, 1988年生, 天津大学精密仪器与光电子工程学院博士研究生 e-mail: suncq@tju.edu.cn
纳米技术的不断发展需要更强大的纳米粒子表征技术。 单颗粒电感耦合等离子体质谱(SP-ICP-MS)是近年来发展起来的纳米粒子检测新技术, 能够快速的向研究人员提供关于纳米粒子尺寸、 尺寸分布、 粒子数目浓度和元素组成等信息, 而且对样品干扰小。 本工作探讨了SP-ICP-MS检测技术中影响金纳米粒子(Gold nanoparticles, AuNPs)测定的因素: 包括仪器参数的优化, 如驻留时间(Dwell time); 样品基质的影响, 包括含盐、 含碳基质; 以及溶液中溶解的被分析元素等。 测得仪器对金纳米粒子的检测限是23 nm。 通过加标回收的方式, 测定了实际水样太湖水、 东丽湖水中金纳米粒子, 加标回收率分别为97.7%和84.4%。 最后, 对SP-ICP-MS纳米粒子检测的现存问题进行了几点思考。
The continuous development of nanotechnology requires more powerful nanoparticle characterization techniques. Single particle inductively coupled plasma mass spectrometry (SP-ICP-MS) is a new technique for nanoparticle detection in recent years. It can quickly provide researchers with information on nanoparticle size, size distribution, particle number concentration and element composition, with small interference for samples. In this paper, the factors influencing the detection of gold nanoparticles (AuNPs)by SP-ICP-MS were discussed, which include the setting of parameters of the instrument, such as dwell time, the influence of sample matrix, including salt-containing and carbon-containingmatrix, and the dissolved analytical elements. The detection limit of gold nanoparticles was 23 nm. The recoveries of AuNPs were measured by spiked recovery. The recoveries were 97.7% and 84.4% for Taihu Lake and Dongli Lake, respectively. Finally, some existing problems were discussed in nanoparticle detection by SP-ICP-MS.
纳米粒子也叫超微颗粒, 通常被定义为至少有一维尺寸小于100 nm的粒子。 纳米粒子处于宏观物体和原子簇交界的过渡区, 这样的系统既非典型的微观系统亦非典型的宏观系统, 是一种介观系统, 因此具有许多传统固体材料所不具有的特性。 纳米粒子被发现存在于大量的消费者产品中[1, 2, 3, 4, 5, 6], 在2013年, 据估计, 有超过1300种不同功能的消费者产品纳米粒子。 纳米科技的发展引发了人们对纳米粒子环境健康和安全的担忧, 由于纳米粒子的理化性质较为新颖, 它们的许多环境归宿和毒理学性质仍然不为人知。 因此, 一种能够快速、 准确、 灵敏地完成各种类型样品中纳米粒子寻找表征与定量技术的需求日益增长[7, 8]。
单颗粒电感耦合等离子体质谱(single particle inductively coupled plasma mass spectrometry, SP-ICP-MS)是近年来发展起来的纳米粒子检测新技术, 与传统的纳米粒子表征技术相比, SP-ICP-MS灵敏度高, 不需要复杂的制样过程, 更适合对环境中金属纳米粒子进行检测。 SP-ICP-MS法通过在时间分辨分析模式(time resolved analysis, TRA)模式下采集数据, 可以对溶液中纳米粒子的粒度分布及纳米颗粒数量浓度进行分析。 Degueldre等[9]提出用单颗粒电感耦合等离子体质谱(SP-ICP-MS)来表征溶液中纳米粒子的理论, 在其后来的一系列文章中, 报道了用这种技术检测不同种类的纳米粒子, 并建立了SP-ICP-MS检测技术的基本理论和方法[10, 11, 12, 13]。 Laborda课题组[14, 15, 16, 17]的工作进一步表明SP-ICP-MS是表征纳米粒子的一种强有力的工具。 金属基纳米颗粒进入ICP-MS等离子体后, 单颗粒金属纳米颗粒在极短的时间内(一般是几百微秒), 产生强脉冲强度信号。 纳米颗粒产生的脉冲信号数量与样品中纳米颗粒数量浓度成比例, 纳米颗粒产生脉冲强度与纳米颗粒质量/粒度成比例[16]。 因此SP-ICP-MS可以提供粒子浓度(particles· mL-1)、 尺寸大小和尺寸分布等信息。 目前文献对SP-ICP-MS纳米粒子检测理论[15, 17, 18, 19]、 应用[20, 21, 22, 23, 24, 25, 26, 27, 28]等方面做了诸多报道, 但尚未见对影响纳米粒子检测的因素进行系统考察。 本工作对SP-ICP-MS法影响纳米粒子检测的仪器参数和实验条件进行了探讨, 并检测了实际水样太湖水和东丽湖水中金纳米粒子。
Nexion 300D电感耦合等离子体质谱仪: 美国铂金埃尔默(Perkin Elmer)公司产品, 配备纳米颗粒应用模块。 接口锥系统包括镍制的采样锥和截取锥, 以及铝制的超截取锥。 分析采用TRA模式, 最小驻留时间为10 μ s, 且测定无需稳定时间。 每次在进样分析前, 都要对仪器进行常规调谐校准。 调谐方式如下: 用PE公司提供的浓度为1 μ g· L-1的调谐液对仪器进行调谐, 当信号强度Be> 2 000 counts· s-1, In> 40 000 counts· s-1, U> 30 000 counts· s-1, Bkgd 220≤ 1, 氧化物产率CeO/Ce≤ 2.5%, 双电荷产率Ce++/Ce≤ 3%, 则认为仪器调谐通过, 仪器可以正常工作。 仪器的固定工作参数设置如表1所示。
| 表1 PE 300 D ICP-MS仪器工作参数 Table 1 Instrument settings for PE 300 D ICP-MS |
超纯水(电阻率18.2 MΩ )是由Milli-Q Advanced A 10系统(Millipore, 美国)制备得到; 使用的AuNPs标准物质为标称粒径为60 nm[质量浓度为(51.86± 0.64) μ g· g-1]的NIST 8013和标称粒径为30 nm[质量浓度为(48.17± 0.33) μ g· g-1]的NIST 8012; Au+标准溶液(1 000 μ g· mL-1, 1.5 mol· L-1 HCl介质, 国家有色金属及电子材料分析测试中心); 调谐液(Be, Ce, Fe, In, Li, Mg, Pb和U, 美国铂金埃尔默(Perkin Elmer)公司, 1%HNO3介质, 1 μ g· L-1)。 使用0.5% HCl配制Au+标准溶液, 高纯水配制AuNPs标准溶液。
标准溶液的配制采用称重的方法, 为保证单颗粒检测方式, 分析溶液中纳米粒子浓度控制在104~105 particles· mL-1。 纳米粒子溶液进样前要保证有足够的超声时间(一般在5 min以上), 以使其分散均匀, 溶液需当天配制、 当天测定。
图1(a)— (c)表示TRA模式下高纯水、 0.048 μ g· L-1 30 nm AuNPs溶液和0.052 μ g· L-1 60 nm AuNPs溶液的时间信号扫描图。 高纯水中脉冲信号基本稳定在较低的值, 计数值分布在0和1附近。 相对而言, 纳米粒子(30和60 nm AuNPs)溶液出现大量的脉冲信号, 信号强度大。 在TRA模式下, 对于稀AuNPs溶液, 只有极少数气溶胶液滴含有纳米粒子。 当单个AuNPs进入等离子体后, AuNPs发生电离, 形成一团离子簇, 进入质谱后产生单个纳米粒子脉冲信号。 图1(d)和(e)表示0.048 μ g· L-1 30 nm AuNPs溶液和0.052 μ g· L-1 60 nm AuNPs溶液的粒径分布图。
基于单颗粒纳米粒子检测的基本假设: (1)纳米粒子的密度是一个常数, 等于块状固体材料的密度; (2)纳米粒子是球形的。 因此, 纳米粒子的体积可以用下述公式来计算:
其中, MNP(μ g)是单个纳米粒子的质量, INP(cps)是相应纳米粒子的强度, R(cps· μ g-1)是检测器对于分析元素的灵敏度, fa是纳米粒子中分析元素的质量分数, K(cps· μ g-1)是溶解分析元素离子的校准曲线, η (%)是传输效率, ρ 和D分别表示纳米粒子的密度和直径。 式中, R=
我们采用与Lee等[18]类似的方法, 将背景噪声的3ρ 定义为最小粒子信号强度, 背景噪声的3ρ 通常是通过实验的方法测定空白得到, 比较保守估计纳米粒子检测限的方法是将去离子水(DI)作为空白。 因此纳米粒子的检测限公式可表示为
式中, Dmin是纳米粒子成分的函数, 不同的元素对应于不同的背景噪声。 通过理论计算, 得到实验中所用SP-ICP-MS对AuNPs的检测限是23 nm。
目前传输效率(transmission efficiency, TE)的计算方法主要有三种[29]: 废液收集法(waste collection method), 粒径法(particle size method), 粒子浓度法(particle number method)。 其中废液收集法检测误差最大, 而粒径法和粒子浓度法是目前测定传输效率最常用的方法。 传输效率大小又受许多因素的影响, 本工作考查了进样速度、 含盐基质、 含碳基质对AuNPs传输效率的影响。
2.3.1 进样速度对传输效率的影响
首先, 考察了进样速度对AuNPs传输效率的影响, 结果如图2所示。 在雾化气流速(1.10 L· min-1)不变的条件下, 进样速度从0.1 mL· min-1增加到0.6 mL· min-1, 纳米粒子传输效率呈现出逐渐减小的趋势。 这可能是因为较大的进样速度降低了纳米粒子悬浮液的雾化效率, 进而使传输效率减小。
2.3.2 含盐基质对传输效率的影响
含盐基质是ICP-MS元素检测中考察较多的一个因素, 而在SP-ICP-MS检测方法中, 其对纳米粒子传输效率影响的考察尚未见报道。 NaCl是实际样品中比较常见的含盐基体, 因此考察了不同浓度的NaCl对AuNPs传输效率的影响。 从图3中可以看出, 溶液中不含有NaCl时, 传输效率为8.6%, 随着NaCl浓度的增加, 样品传输效率逐渐下降, 但当NaCl浓度达到2%时, 样品传输效率会有小幅度提升。 这是因为传输效率受溶剂蒸发和库伦裂变两种机理的共同作用。 在NaCl浓度较低时, 库伦裂变机理可以忽略。 样品溶液中离子的存在降低了气溶胶液滴的蒸气压, 从而抑制了溶剂的蒸发, 导致液滴尺寸的增大, 只有较少部分纳米粒子被传送到等离子体中, 这种作用随着NaCl浓度的增加而增大。 当NaCl浓度达到2%时, 此时液滴表面电荷量较大, 产生库伦裂变, 并改变气溶胶的尺寸分布, 达到瑞利极限的液滴破碎成尺寸更小的液滴, 从而传输效率略微上升[30]。
2.3.3 含碳基质对传输效率的影响
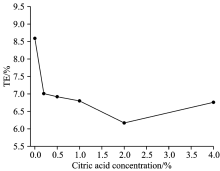
在元素检测中, 含碳基质通常有两种作用[31]: 一是增敏效应, 二是冷却效应。 本工作选择柠檬酸作为碳源来考察含碳基质对AuNPs传输效率的影响, 这是因为柠檬酸既是碳源, 又是常见的AuNPs的稳定剂。 从图4中可以看出, 随着柠檬酸浓度的增加, 传输效率呈现出降低的趋势, 说明冷却效应在AuNPs的检测中起主要作用。 当柠檬酸浓度达到4%时, 传输效率略有上升, 可能是因为柠檬酸浓度的增加使液滴表面电荷量增大, 从而改变了气溶胶液滴的尺寸分布所导致的。
驻留时间指的是单次数据读取时间, 为了保证一次检测只通过一个纳米颗粒, 要求仪器有较短的驻留时间(Dwell time)[32]。 因此一方面要求样品必须足够稀释, 达到颗粒之间分辨出的目的, 另一方面, 质谱仪必须能够有较快的测量速度, 即“ 瞬时数据采集速度” 。 本工作考察了Dwell time对纳米粒子峰个数、 平均峰强度和粒径大小检测的影响。
2.4.1 Dwell time对纳米粒子峰个数和平均峰强度的影响
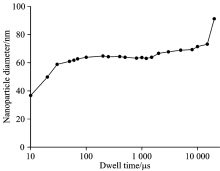
Dwell time是对纳米粒子检测影响较大的因素, 一个纳米粒子通过时间窗口的时间一般小于0.5 ms。 如果Dwell time太短, 会造成纳米粒子的错误计数; 如果Dwell time太长, 会导致一个Dwell time同时检测到两个及以上纳米粒子的信号信息。 实验中, Dwell time通常设置为50~100 μ s。 使用NIST 8013 60 nm金纳米粒子标准溶液作为纳米粒子分析溶液, 考察了10 μ s~20 ms范围内Dwell time对纳米粒子峰个数和平均峰强度的影响, 结果如图5所示。 在较短的Dwell time变化范围内(< 50 μ s), 纳米粒子峰个数随着Dwell time的增大而减小, 而平均峰强度随着Dwell time的增大而增大。 继续增大Dwell time, 两者出现比较平缓的趋势, 说明在这个范围内, Dwell time对纳米粒子检测影响不大。 当Dwell time> 2 ms时, 检测的AuNPs峰个数明显减小, 而平均峰强度明显增大, 这是因为Dwell time太大, 一个Dwell time时间内检测到两个及以上纳米粒子的概率增加, Aaron Hineman等[32]在工作中也得到了相同的结论。
 | 图5 Dwell time对纳米粒子峰个数(a)和平均峰强度(b)的影响, 进样速度为20 r· min-12.4.2 Dwell time对纳米粒子粒径检测的影响Fig.5 Effect of Dwell time on number of peaks (a) and mean intensity (b), and the sample uptake rate is 20 r· min-1 |
为了评价Dwell time对纳米粒子粒径检测的影响, 使用NIST 8013 60 nm金纳米粒子标准溶液作为纳米粒子分析溶液。 图6展示了Dwell time对纳米粒子粒径检测的影响。 当Dwell time< 50 μ s时, 检测到的纳米粒子粒径比标准值偏小。 Dwell time在50 μ s~1.5 ms, 纳米粒子粒径检测误差小于6%, 而当Dwell time≥ 2 ms, 纳米粒子粒径检测误差> 10%, 这是因为Dwell time太大, 一个Dwell time时间内检测到两个及以上纳米粒子信号的概率增加。
SP-ICP-MS检测的一个难点是溶液中大量溶解的分析元素会对纳米粒子检测造成干扰。 图7显示了加入不同浓度的Au+溶液对AuNPs粒径和粒子浓度检测的影响。 当溶液中溶解的Au+浓度较低时, 对AuNPs粒径和粒子浓度检测的影响可以忽略。 当溶解的Au+浓度超过一定临界值, 继续增加Au+浓度, 检测到的纳米粒子粒径逐渐增大, 粒子数浓度逐渐减小。 从图中可以得到, 对于30 nm AuNPs悬浮液, 溶解的Au+浓度的临界值范围是0.1~0.5 μ g· L-1; 对于60 nm AuNPs悬浮液, 溶解的Au+浓度的临界值范围是1~10 μ g· L-1。 所以, 要想准确检测AuNPs的相关信息, 需保证溶液中溶解的Au+浓度足够低。
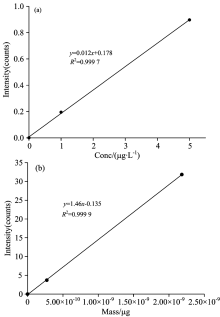
采用纳米粒子粒径法(particle size method)来计算样品传输效率, 配制的溶解Au+标准曲线(0, 1和5 μ g· L-1)和AuNPs标准曲线(0, 30和60 nm)如图8所示, 线性相关系数分别为0.999 7和0.999 9, 具有很好的线性相关性, 可以满足定量检测的需求, 并用该曲线作为样品的定量校准曲线。
采集太湖水和东丽湖水, 经0.45 μ m滤膜过滤。 由于环境水中AuNPs浓度较低, 因此无需稀释, 可直接进入SP-ICP-MS检测。 纳米粒子粒度分布情况如图9所示。 环境中含有的AuNPs主要是由于人为因素引入, 太湖水和东丽湖水中含有一定浓度的平均粒径分别为36.3和38.5 nm的AuNPs, 而溶解的Au+含量较低, 都在检测限以下, 这可能跟金纳米粒子性质比较稳定有关。 分别向太湖水和东丽湖水中加入一定浓度的NIST 8013 60 nm AuNPs标准溶液, 以高纯水中加入相同浓度的纳米粒子的检测浓度作为标准, 测得的加标回收率分别为97.7%和84.4%, 检测结果如表2所示。 太湖水的加标回收率可以达到97.7%, 而东丽湖水的加标回收率较低, 为84.4%, 这可能跟不同地域的湖水水质有关。 采集的太湖水呈澄清透明状, 而东丽湖水有些浑浊, 尽管经过了滤膜过滤, 但是并不能完全消除基质的干扰, 会对加标回收率的检测造成一定的干扰, 这也是东丽湖水加标回收率较低的原因。
| 表2 SP-ICP-MS法对水样中金纳米粒子加标回收率测定 Table 2 Determination of Recovery of Au NPs in water samples by SP-ICP-MS |
与其他纳米粒子表征技术相比, SP-ICP-MS是一种有效的纳米粒子检测手段, 可以同时给出纳米粒子尺寸、 尺寸分布、 粒子数目浓度和元素组成等信息。 SP-ICP-MS灵敏度高, 对样品干扰小, 更适合环境中纳米粒子的检测。 但是SP-ICP-MS检测仍需要在以下方面开展深入研究: (1)含碳含盐等复杂基质会通过影响传输效率, 进而对纳米粒子准确检测造成干扰, 因此要从样品前处理和仪器校正等方面研究纳米粒子检测中的基体效应; (2)在数据处理上, 需要进一步优化算法以便于更好的区分纳米粒子信号和溶解离子信号; (3)如何保持纳米粒子在原生态环境下的检测, 真实反映纳米粒子在样品中的浓度和粒径分布信息, 也是SP-ICP-MS需要考虑的问题。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|