作者简介: 穆思图, 女, 1993年生, 河北科技大学硕士研究生 e-mail: musitu93@163.com
吸附树脂层析法是表征环境水样有机物亲疏水组分分布的常用方法。 作为柱层析的基本参数, 临界保留因子对亲疏水物质的吸附及分离效果具有潜在影响。 以河北某水库的水样为例, 将有机物分为亲水物(HIS)、 疏水酸(HOB)、 疏水碱(HOA)和疏水中性物(HON), 考察了在不同临界保留因子分离条件下( k'cr=5, 10, 25, 50, 100)亲疏水组分有机物含量分布, 并着重考察了其光谱学特性。 研究发现, 亲疏水组分的浓度分布取决于 k'cr值的设置, 疏水组分的比例和疏水程度随 k'cr的增大而增大。 在250~280 nm波长范围内, 亲水组分HIS的紫外吸光度随 k'cr的增高而增高, 而疏水组分HOA和HOB则呈现相反趋势, 亲水与疏水组分之间的紫外光谱差异性随 k'cr增大而增大。 此外, 疏水组分单位质量浓度的吸光度对 k'cr的取值敏感, 推测 k'cr可能影响所得组分的芳香族官能团性质。 进一步考察了各组分的三维荧光光谱, 并采用荧光区域积分和荧光指数对图谱进行解析。 结果表明, 亲疏水组分的荧光峰形态、 荧光区域分布和荧光团密度与 k'cr值有关, 荧光指数BIX, HIXem和Peak T/C对 k'cr的取值敏感, 说明 k'cr可能对所得组分的具体化学组成乃至迁移转化行为产生影响。 因此在分离并表征环境水样的亲疏水组分分布时, 应特别注意临界保留因子的设置并明确标明其取值。
Adsorption resin chromatography obtains wide application in characterizing the distribution of hydrophilic/hydrophobic fractions in natural organic matters. As a basic parameter of chromatography, the critical retention factor has a potential impact on results of adsorption and separation. In this study, water samples from a reservoir were fractionated into hydrophilic substances (HIS), hydrophobic acids (HOA), hydrophobic bases (HOB) and hydrophobic neutrals (HON) under the conditions of various critical retention factors ( k'cr=5, 10, 25, 50, 100). The distribution of the hydrophilic/hydrophobic fractions were systematically characterized, with special attention placed to their spectroscopic properties. The results showed that the relative proportions of hydrophilic/hydrophobic fractions depended on the value of k'cr, and the proportion of hydrophobic components and the degree of hydrophobicity increased with the increase of k'cr value. In wavelength range of 250~280 nm, the UV absorbance of HIS increased with increasing k'cr, while the absorbance of hydrophobic fractions performed in the reserved trend. The difference in UV spectra between the hydrophilic and hydrophobic fractions was enlarged with increasing k'cr value. The specific UV absorbance (i. e. UV absorbance per unit concentration) of the hydrophobic fractions was found to be sensitive to the value of k'cr, indicating that the critical retention factor may affect the properties of aromatic functional groups in the obtained fractions. Three dimensional excitation-emission matrix fluorescence spectroscopy was further conducted to characterize the hydrophilic/hydrophobic fractions, with the spectral data analyzed using fluorescence regional integration and fluorescence index techniques. The results revealed that the fluorescence peak appearance (peak location and intensity), fluorescence regional distribution and fluorophore density were related to the value of k'cr, meanwhile the fluorescence indices of BIX, HIXem and Peak T/C were sensitive to the value of k'cr. It is speculated that the critical retention factor may have profound impact on the chemical compositions and transformation behaviors of the resultant hydrophilic/hydrophobic fractions. Therefore, it is suggested that particular attention should be paid to the setting of the critical retention factor and indicating its value clearly when conducting separating and characterizing of the distribution of hydrophilic/hydrophobic fractions.
亲疏水性是环境水样中有机物的基本属性之一[1]。 亲疏水性的强弱决定了物质之间亲疏水作用的大小, 关系到物质的吸附和相分配等基本界面行为, 对污染物在环境水体和污水处理系统中的迁移转化过程产生重要影响[2]。 因此, 水样中有机物亲疏水组分分布的表征, 对污染物迁移转化过程的深入理解和针对性调控(例如吸附、 膜分离等技术)具有重要意义[3]。
吸附树脂层析法是文献中普遍采用的分离和表征水样亲疏水组分分布的方法之一。 水样流过由疏水树脂(例如DAX大孔树脂)填充而成的层析柱, 在有机物酸碱基团非电离的状态下, 易被树脂吸附的为疏水组分, 难被吸附的为亲水组分, 由此可得到有机物的亲/疏水酸/碱/中性组分分布。 该方法被广泛地应用于地表水、 海水、 污水、 污泥及土壤提取物的分离表征中[4, 5, 6]。
临界保留因子(容量因子)是决定层析柱分离效果的潜在关键因素。 临界保留因子(k'cr)与水样体积和柱体积的比值有关, 定义为: k'cr=(0.5V-V0)/V0, 其中V0为层析柱死体积, V为过柱水样体积。 在指定的临界保留因子下, 在使分子酸碱基团中性化的pH条件下, 疏水吸附层析柱截留率50%以上的为疏水物, 50%以下的为亲水物。 这是早期文献对层析法分离得到的亲疏水组分的经典定义。 但是在后续的应用研究中, 很多文献只关注了物质亲疏水分离的最终结果, 忽略了对临界保留因子的报道, 从而导致不同结果之间的横向可比性较差, 在对比亲/疏水组分的行为时甚至得出相反的结论[7, 8]。
以河北某水库的水样为例, 详细探讨了在不同临界保留因子下分离出来的亲疏水组分的差异性。 从物质分布角度(以总有机碳表征)的同时着重考察了光谱学特性(以紫外和荧光光谱表征), 研究临界保留因子对亲疏水组分理化性质的影响, 从而为今后关于水样亲疏水分离的研究和报道提供建议。
试验中所用水样取自河北某水库, 硫酸酸化后运至实验室, 用NaOH调回中性并搅拌均匀, 经0.7 μ m玻璃纤维滤膜(GF/F, Whatman, 英国)过滤去除颗粒物后, 保存于4 ℃冰箱中待分析。 所有亲疏水分离及水质分析实验均在一周内完成。
试验水样的亲水疏水酸碱组分的分离采用吸附树脂层析法。 吸附树脂采用DAX-8疏水大孔树脂(Supelite, 美国), 主要参数为: 聚二甲基丙烯酸甲酯材质, 40~60目, 平均孔径22.5 μ m, 比表面积160 m2· g-1, 孔体积0.79 cm3· g-1。 层析柱为有机玻璃材质, 层析柱尺寸为ϕ 1.0 cm× 20 cm, 死体积为10 mL。 试验中临界保留因子分别采用5, 10, 25, 50和100。 亲疏水组分的分离流程如图1所示: (1)pH为中性的水样流经层析柱后, 得到的滤出液备用; (2)用2倍柱体积的0.1 mol· L-1的HCl和4倍柱体积的0.01 mol· L-1的HCl反洗层析柱, 得到疏水碱性组分(HOB); (3)将步骤(1)中得到的滤出液调至pH为2, 再次流经层析柱, 滤出液即为亲水组分(HIS); (4)用2倍柱体积的0.1 mol· L-1的NaOH和4倍柱体积的超纯水反洗层析柱, 得到疏水酸性组分(HOA); (5)将树脂从层析柱取出, 空气干燥15 h后, 用5倍柱体积的甲醇索提9 h, 得到疏水中性组分(HON)。 将HIS, HOA和HOB再次稀释至原水体积, 调节pH为8, 电导率为5 mS· cm-1, 保存于4 ℃冰箱中用于后续测试。 HON由于含有甲醇, 对后续测试有干扰作用, 本研究不再考察其有机碳和光谱学特性。
不同临界保留因子下分离出来的各亲疏水酸碱组分的有机物含量用总有机碳(TOC)表征, 采用TOC分析仪(TOC-VCPH, 岛津, 日本)测量。
不同临界保留因子下, 各亲疏水酸碱样品的光谱学性质通过紫外光谱和三维荧光光谱(EEM)表征。 紫外光谱采用紫外分光光度计(UV-2700, 岛津, 日本)获取, 扫描230~300 nm波长下的紫外吸光度。 EEM通过荧光分光光度计(Model F-7000, 日立, 日本)扫描得到, 激发和发射光的狭缝宽度为5 nm, 激发波长范围是200~400 nm, 发射波长范围是250~500 nm, 扫描步长为5 nm, 扫描速度为2 400 nm· min-1, 光电倍增管电压为700 V。 所有样品的EEM数据经过如下处理[9]: (1)扣除超纯水背景; (2)插值法消除Rayleigh和Raman的一阶和二阶散射; (3)采用紫外吸光度校正荧光内滤效应; (4)采用纯水的Raman峰积分对荧光强度进行量纲标准化, 得到的荧光强度单位为Raman单位(R.U.)。
采用SPSS软件分析各亲疏水组分的荧光指标和临界保留因子之间的相关性。
不同临界保留因子下分离水样得到的亲疏水酸碱组分的分布如图2所示。 在所有临界保留因子下, 各组分中HIS对总有机碳的贡献最大, HOA次之, HOB最小。 HIS的主要成分是多糖类物质, HOA的典型成分为天然有机物中的腐殖质类物质, 同时也是水样色度的主要来源[10]。 在pH为2的条件下(图1中的步骤3), 腐殖质中的酸根离子被中和, 带电性减弱而疏水性增强, 从而易被疏水树脂吸附保留。 HIS则可能由于含有相对亲水的多糖类等物质而不易被吸附保留。
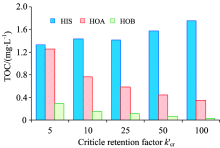 | 图2 不同临界保留因子下各亲疏水组分的TOC分布Fig.2 Distribution of the hydrophilic/hydrophobic fractions with different critical retention factors |
在低临界保留因子(k'cr=5)的情况下, 分离得到的HOA和HIS含量相当, 疏水组分的总量高于亲水组分。 随着临界保留因子的升高, 疏水组分的比例逐渐下降, 亲水组分的比例逐渐增高。 当临界保留因子增加到k'cr=100时, HOA的含量已降至HIS的1/5左右, 疏水组分的总量远低于亲水组分。 对比高、 低临界保留因子的结果可见, 亲水组分和疏水组分的相对比例取决于临界保留因子的设置。
临界保留因子不仅影响亲疏水组分的含量, 而且影响所得组分亲疏水性的强弱。 临界保留因子越大, 则单位容积的树脂所服务的水样体积越多, 物质由于吸附平衡而穿透层析柱的可能性就越大; 在此情况下仍能通过吸附作用保留在层析柱内的物质, 说明其疏水性越强。 临界保留因子取值越大, 对疏水组分的界定标准就越严格。 在图2中, 随着k'cr的增高, HOA和HOB的表观产量降低, 但疏水性增强; 一些在低k'cr下被归为“ 疏水物” 的物质在高k'cr下则被归为“ 亲水物” , 导致HIS表观浓度的升高。
不同临界保留因子下的亲疏水酸碱组分的紫外吸收光谱如图3所示。 在230~300 nm波长范围内, HIS的吸光度总体最高, HOA次之, HOB最低。 亲水组分HIS的吸光度随k'cr的增高而增高, 疏水组分HOA和HOB的吸光度则随k'cr的增高而降低。 这与图2中各组分有机物含量的变化趋势一致。 在低临界保留因子下(k'cr=5), HIS和HOA的吸光度曲线接近重合; 而在较高的临界保留因子下, 亲、 疏水组分之间吸光度的差距明显。 这说明亲疏水组分的界定标准越严格, 分离所得的亲疏水组分之间区分度越大。
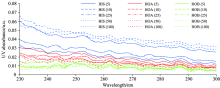 | 图3 不同临界保留因子下各亲疏水组分的紫外吸收光谱Fig.3 UV spectrum of the hydrophilic/hydrophobic fractions at different critical retention factors |
紫外吸光度同时受到物质浓度和官能团性质的影响。 采用单位质量浓度的吸光度(比吸光度SUVA, 类似于吸光系数)来表征物质官能团的紫外吸光特性, 结果如表1所示。 由于250~280 nm是有机大分子中芳香族基团的主要特征吸光区域, 采用该区域的平均SUVA可近似反映芳香度, 单位取为A.U.· (mgTOC· L-1)-1。 随临界保留因子的增大, HIS的SUVA无明显变化规律, 整体处于0.02~0.03的水平, 而HOA的SUVA从与HIS相当的水平递增至0.04, HOB的SUVA更是从0.05猛增至0.37, 说明疏水组分的SUVA对临界保留因子的取值敏感。
| 表1 不同临界保留因子下各亲疏水组分的紫外吸光度 Table 1 UV absorbance index of the hydrophilic/hydrophobic fractions at different critical retention factors |
三维荧光光谱(EEM)在一定程度上可反映溶液中物质的化学组成和官能团情况。 有机物的荧光发色团通常具有π 电子共轭体系, 共轭体系的化学结构、 空间构型或所处的化学环境不同, 将会导致三维荧光指纹信号的不同。 不同临界保留因子下各亲疏水酸碱组分的EEM图谱如图4所示。 随着k'cr值的升高, 亲水组分HIS的整体荧光强度逐步增强, 荧光峰信号逐渐丰富, 开始出现某些低k'cr时疏水组分的特征(例如激发光波长区间Ex< 250 nm的荧光信号); 相反地, 疏水组分(HOA和HOB)的荧光峰则呈现逐步纯化的趋势, 在高k'cr值下仍残留的荧光峰则对应强疏水成分的特征峰, 如HOA的激发/发射波长为Ex/Em=225 nm/350 nm附近的荧光峰和HOB的Ex/Em=240/280 nm附近的荧光峰。 由此可见, 高临界保留因子(k'cr=100)有利于提取较为纯粹的疏水组分(具有强疏水性), 低临界保留因子(k'cr=5)有利于提取较为纯粹的亲水组分(具有弱疏水性), 而在其余情况下所得的亲、 疏水组分之间则出现不同程度的交叉。
 | 图4 不同临界保留因子下各亲疏水组分的三维荧光光谱图Fig.4 EEM of the hydrophilic/hydrophobic fractions at different critical retention factors |
各亲疏水组分的单位TOC平均荧光强度随临界保留因子的变化趋势如图5所示。 单位TOC平均荧光强度是Ex=200~400 nm和Em=250~500 nm波长范围内的平均荧光强度与TOC浓度的比值, 可在一定程度上反映分子结构中荧光团的密度[9]。 疏水组分HOA和HOB的单位TOC平均荧光强度普遍高于亲水组分HIS, 其中HOB的值最大。 对比各亲疏水组分的单位TOC平均荧光密度随临界保留因子的变化趋势可见, HIS的升高幅度较小, HOA的升高趋势明显, 而HOB则呈现迅速上升趋势。 前文已论述, 临界保留因子越大, 所得组分的真实疏水性越强。 这说明水样中疏水性越强的成分, 其荧光团密度也越高。 荧光团密度作为反映物质官能团特性的一个方面, 其变化规律表明: 临界保留因子的设置对所得组分的官能团特性的影响不可忽视。
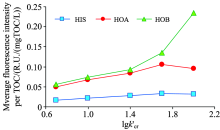 | 图5 不同临界保留因子下各亲疏水组分的荧光密度Fig.5 Fluorescence densities of the hydrophilic/hydrophobic fractions at different critical retention factors |
采用荧光区域积分法(FRI)探讨临界保留因子对各亲疏水组分的具体化学成分的影响[11]。 将EEM图谱的波长区间分为5个区域, 近似代表几种化学成分类型: 区域Ⅰ 和Ⅱ 代表蛋白质类物质, 区域Ⅲ 代表富里酸类物质, 区域Ⅳ 代表微生物代谢产物类物质, 区域Ⅴ 代表腐殖酸类物质。 不同区域的荧光贡献率与logk'cr之间的Pearson相关分析结果列于表2中。 HIS中富里酸类和微生物代谢产物类物质对临界保留因子的变化显著相关; HOA中为蛋白质类显著相关; 而HOB中为蛋白质类、 富里酸类和微生物代谢产物显著相关。 由此可见, 临界保留因子的选择对所得组分的具体化学成分具有不可忽略的影响。
| 表2 各亲疏水组分FRI贡献率与logk'cr之间的Pearson相关性 Table 2 The Pearson correlation between the contribution rate of FRI and the logk'cr of the hydrophilic/hydrophobic fractions |
进一步探讨各亲疏水酸碱组分的几种典型荧光指数随临界保留因子的变化关系。 荧光指数可在一定程度上侧面反映物质的功能性或迁移转化行为[12]: HIXsyn和HIXem反映有机物的腐殖化程度, 与N/C比或C/H比也可能有关联性; FI和BIX反映物质产生于生物源的可能性和新鲜度; Peak T/C(T峰和C峰的荧光强度比值)则反映物质的可生化性。 各荧光指数与logk'cr之间的相关分析结果如表3所示。 不同亲疏水组分中对临界保留因子敏感的荧光参数各不相同: HIS的BIX指数、 HOA的HIXem和Peak T/C指数以及HOB的Peak T/C指数与logk'cr之间呈现显著相关性。 由此可见, 临界保留因子的取值对所得亲疏水组分的归趋行为也具有不可忽略的潜在影响。
| 表3 各亲疏水组分荧光指数与logk'cr之间的Pearson相关性 Table 3 The Pearson correlation between the fluorescence index and the logk'cr of the hydrophilic/hydrophobic fractions |
在水样有机物亲疏水组分的分离表征中, 临界保留因子的选取具有以下方面的潜在应用意义。 在污染物的去除手段预判方面: 在几种物化处理手段中, 混凝和离子交换对亲水污染物的处理效果较好, 活性炭吸附和光催化更适用于对疏水污染物的去除; 在消毒过程中, 疏水物更可能产生消毒副产物; 本研究发现, 不同k'cr值所得亲疏水组分的可生化性相关指标(Peak T/C)不同。 k'cr值影响亲疏水组分分布的表征结果, 从而影响对污染物处理策略的预判。
在水处理过程的优化控制方面: 以膜分离过程为例, 亲、 疏水物对膜堵塞效应的贡献率大小仍存在争议[7], 而不同k'cr对亲疏水程度的界定不同是引起争议的重要因素之一。 选取合适的k'cr, 建立亲疏水组分与膜堵塞效应之间的可靠关系, 有利于根据水质亲疏水组分对膜分离过程进行定向调控。
在污染物迁移转化的机理研究方面: 以微量有机污染物在天然水体和水处理系统中的归趋为例, 微量有机物与水中的亲、 疏水大分子之间的作用强弱不同; 各组分亲疏水性的强弱程度与k'cr的取值有关, 因而影响迁移转化机理的解析和关键归趋途径的判断。 在有机组分的提取制备方面: 以天然水体成分的分离提取为例, 腐殖酸和富里酸的产品提取自HOA, k'cr的取值影响所得HOA的浓度和性质, 因而影响产品的产量和品质。
考察了临界保留因子对所得亲疏水组分的浓度分布和理化性质的影响, 得到如下结论:
(1)临界保留因子显著影响亲疏水组分的浓度分布, 在高、 低临界保留因子下可得出相反的亲疏水组分比例的结论。
(2)临界保留因子显著影响亲疏水组分的紫外光谱性质, 包括250~280 nm特征波长范围的吸光度和单位TOC浓度的吸光度。
(3)临界保留因子显著影响亲疏水组分的荧光光谱性质, 包括EEM形态和荧光区域分布。 荧光指数BIX, HIXem和PeakT/C对临界保留因子的取值敏感, 呈现显著相关性。
亲疏水组分是水样的表观分类, 亲疏水组分的区分和具体理化性质受制于临界保留因子的取值, 因此本研究建议:
(1)在分离水样的亲疏水组分时, 应根据需要选择合适的临界保留因子。
(2)在给出亲疏水分布的表征结果时, 应特别注明所采取的临界保留因子。
(3)在横向比较亲疏水分布的表征结果时, 应注意临界保留因子是否存在较大差异。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|