作者简介: 孙延文, 1989年生, 吉林大学第二医院硕士研究生 e-mail: goodlucksunyw@163.com
稀土螯合物的制备是均相时间分辨荧光免疫分析中的关键部分, 为了合成理想的稀土螯合物, 以2,6-二(溴甲基)吡啶-3,5-二甲酸二乙酯为原料, 首先优化合成了Li+⊂2,6-{N,N’,N,N’-[二(2,2’-联吡啶-6,6’-二甲基)]二(氨甲基)}-吡啶-二羧酸乙酯, 使其产率明显提高。 进一步选择乙腈和甲醇两种反应体系合成铕螯合物, 并比较了不同反应体系下合成的铕螯合物的光谱性质。 研究表明, 乙腈和甲醇两种反应体系所得铕螯合物的激发光谱(最大激发波长为310 nm)、 发射光谱(最大发射波长为616 nm)、 量子产率基本相同, 荧光强度在10-8~10-5 mol·L-1范围内与Eu3+浓度均成线性, 相关系数分别为0.993 73和0.986 65, 两种铕螯合物( c=2.5×10-5 mol·L-1)的荧光强度略有差异, 荧光寿命分别为825和830 μs。 因此, 两种反应体系所得铕螯合物具有斯托克斯位移大、 荧光强度强以及荧光寿命长等优点, 并且此种穴状螯合剂结构中的吡啶-2,2-联吡啶可保护铕离子免受其他物质的干扰, 是理想的稀土螯合物, 可用于蛋白质、 核酸等生物分子的标记。 本研究不仅拓展了合成新型稀土螯合物的方法, 而且为进一步建立均相时间分辨荧光免疫分析奠定了基础。
Synthesis of rare-earth chelate is a key part of homogeneous time-resolved fluorescence immunoassay. To synthesize optimal rare-earth chelate, we select diethyl 2,6-dibromomethyl-3,5-pyridinecarboxylate as raw material and optimally synthesize Li+⊂2,6-{N,N’,N,N’-[bis(2,2’-bipyridine-6,6’-dimethyl)] bis(aminomethyl)}-pyridine-3,5-diethyl diester, and then the spectral difference of europium cryptate synthesized by the different reactive systems of acetonitrile and methyl alcohol are discussed. Studies show the excitation spectra(the maximum excitation wavelength is 310 nm), emission spectra(the maximum emission wavelength is 616 nm) and quantum yield of europium cryptate synthesized by the different reactive systems are consistent. Fluorescence intensity are linear with the concentration of europium in the range of 10-8~10-5 mol·L-1 ( R2=0.993 73, 0.986 65), respectively. But the fluorescence intensity between them ( c=2.5×10-5 mol·L-1) are slightly different. Their fluorescence lifetime are 825 and 830 μs, respectively. Therefore, europium cryptate synthesized has big Stoke’s shift, high fluorescence intensity, long fluorescence lifetime and so on. Pyridine-2,2-bipyridine in europium cryptate can protect europium from interference. It is an ideal europium cryptate used for the labeling of biomolecules such as protein, nucleic acid. This study not only expands the synthesis of new rare earth chelate, but also lays the foundation for the establishment of homogeneous time-resolved fluorescence immunoassay.
均相时间分辨荧光免疫分析(homogeneous time-resolved fluorescence, HTRF)[1, 2]结合了时间分辨荧光免疫技术(time-resolved fluorescence immunoassay, TRFIA)和能量共振转移理论(fluorescence resonance energy transfer, FRET), 所以, 也被称为TR-FRET技术。 时间分辨荧光技术利用了稀土离子具有激发谱带宽、 发射谱带窄而尖锐、 斯托克斯位移大等优势[3], 有效地避免了背景荧光的干扰[1]。 能量共振转移理论指受激发的供体基团将能量传递给受体基团的过程[4]。 受激发的供体发射光谱与受体激发光谱部分重叠, 使得受体基团可被激发而发出其特征峰, 依据所测得受体发射光的强度来定量测定目标分子的浓度、 分析分子间的相互作用等。 因此, HTRF技术既克服了混合物自发荧光和固体沉淀物光散射的干扰[1], 有效地提高了检测的灵敏度[5], 又避免了检测过程中未结合物分离的繁琐步骤, 实现了简便快速易于自动化的检测[6]。 均相时间分辨荧光免疫分析已成为超灵敏分析领域的重要技术, 其广泛应用于药物研发[7]、 分子间相互作用[8]、 蛋白质和激素检测[9, 10, 11]、 病原微生物检测[12]、 聚合酶链式反应[13]等方面。
本研究以2, 6-二(溴甲基)吡啶-3, 5-二甲酸二乙酯为原料, 首先合成了Li+⊂2, 6-{N, N’ , N, N’ -[二(2, 2’ -联吡啶-6, 6’ -二甲基)]二(氨甲基)}-吡啶-二羧酸乙酯, 进一步选择乙腈和甲醇两种反应体系进行Eu3+配位反应[1], 获得目标产物Eu3+⊂2, 6-{N, N’ , N, N’ -[二(2, 2’ -联吡啶-6, 6’ -二甲基)]二(氨甲基)}-吡啶-二羧酸乙酯, 并对目标产物的激发光谱、 发射光谱、 荧光强度、 量子产率和荧光寿命进行分析比较。
Unity-400M型核磁共振仪(美国Varian公司); 7.0 T型超导磁体型傅里叶变换离子回旋共振质谱仪(美国IonSpec公司); F-7000型荧光光谱仪(日本Hitachi公司); 稳态/瞬态荧光光谱仪(英国爱丁堡公司); FLPS-920科研级荧光光谱仪(英国爱丁堡公司); 绝对量子效率测试仪C10027(日本Hamamatsu公司); DZF-6050型真空干燥箱(上海恒昌科技有限公司)、 101-1型电热鼓风恒温干燥箱(上海米克朗仪器装备有限公司); DT-100分析天平(北京光学仪器厂)。
乙腈、 二氯甲烷、 甲醇、 乙醚和碳酸锂均为分析纯试剂; 柱层析硅胶(国药集团化学有限公司); 2, 6-二(溴甲基)吡啶-3, 5-二甲酸二乙酯(自制)、 N, N’ , N, N’ -[二(2, 2’ -联吡啶-6, 6’ -二甲基)]二胺(自制)、 氯化铕(自制); 实验室用水为二次蒸馏水。
称取N, N’ , N, N’ -[二(2, 2’ -联吡啶-6, 6’ -二甲基)]二胺(0.165 8 g, 4.21× 10-4 mol), Li2CO3(0.311 5 g, 4.21× 10-3 mol)于反应瓶中, 加入210 mL乙腈溶液, N2保护下搅拌、 升温、 回流反应40 min后, 开始滴加140 mL 2, 6-二(溴甲基)吡啶-3, 5-二甲酸二乙酯(0.136 9 g, 3.36× 10-4 mol)乙腈溶液, 2 h滴完, 回流反应40 h。 降温、 抽滤、 旋蒸得粗产物, 经色谱柱分离得目标产物, 产率51%。
1.3.1 乙腈反应体系
称取Li+⊂2, 6-{N, N’ , N, N’ -[ 二(2, 2’ -联吡啶-6, 6’ -二甲基)]二(氨甲基)}-吡啶-二羧酸乙酯(0.025 g, 3.84× 10-5 mol)、 EuCl3(0.020 g, 5.4× 10-5 mol)于反应瓶中, 加入15 mL乙腈, N2保护下搅拌、 升温、 回流反应48 h。 降温、 抽滤、 旋蒸得终产物, 产率62%。
1.3.2 甲醇反应体系
称取Li+⊂2, 6-{N, N’ , N, N’ -[ 二(2, 2’ -联吡啶-6, 6’ -二甲基)]二(氨甲基)}-吡啶-二羧酸乙酯(0.037 g, 5.68× 10-5 mol)、 EuCl3(0.042 g, 11.4× 10-5 mol)于反应瓶中, 加入15 mL甲醇, N2保护下搅拌、 升温、 回流反应48 h。 然后加入15 mL乙醚, 室温冷却静置, 收集析出白色固体, 产率58%。
1.4.1 配制溶液
分别称取两种反应体系所得铕(Eu3+)螯合物0.800 mg, 置于10 mL容量瓶中, 加水定容至10 mL, 得Eu3+浓度为1.0× 10-4 mol· L-1。 对溶液进行梯度稀释得Eu3+浓度分别为2.5× 10-5, 5.0× 10-6, 1.0× 10-6, 2.0× 10-7和4.0× 10-8 mol· L-1。
1.4.2 光谱检测
使用F-7000型荧光光谱仪, 室温下分别固定发射波长616 nm和激发波长310 nm, 测定Eu3+螯合物溶液(c=2.5× 10-5 mol· L-1)的激发光谱和发射光谱。
使用稳态/瞬态荧光光谱仪在330 nm氙灯激发下, 测定Eu3+螯合物溶液的发射光谱和荧光强度。
1.4.3 量子产率检测
使用绝对量子效率测试仪在310 nm氙灯激发下, 测定Eu3+螯合物溶液(c=2.5× 10-5 mol· L-1)的量子产率。
1.4.4 荧光寿命检测
使用FLPS-920研究级荧光光谱仪在310 nm氙灯激发下, 测定Eu3+螯合物溶液(c=2.5× 10-5 mol· L-1)的荧光寿命。
研究合成的Li+⊂2, 6-{N, N’ , N, N’ -[二(2, 2’ -联吡啶-6, 6’ -二甲基)]二(氨甲基)}-吡啶-二羧酸乙酯采用了吡啶-2, 2-联吡啶组成的穴状结构, 联吡啶作为核心配体能够较好吸收能量, 与铕离子形成最佳的匹配能级, 实现分子结构内的能量转移[3, 14], 使得铕离子发出强荧光。 吡啶-2, 2-联吡啶与铕离子形成稳定的螯合物, 能够更好地保护铕离子, 使其不易被水及蛋白质溶液所猝灭[15]。 该穴状螯合剂与其他螯合剂[16]相比, 具有极强抗干扰性, 可耐受低pH、 金属离子、 DMSO、 EDTA等, 同时该螯合剂没有光漂白性, 多次读数后荧光信号没有损失, 荧光可再现, 可以进行动力学检测。 该铕螯合剂结构中的两个酯基基团可以进一步用于蛋白质、 酶、 核酸[17, 18]等标记中。 因此, 该铕螯合物不仅具有了稀土离子的光谱特性, 还具有了标记的功能, 其在标记技术领域具有广泛的应用前景。
通过改变投料比、 反应时间等优化反应条件获得目标产物。 经核磁共振仪、 傅里叶变换离子回旋共振质谱仪等技术手段进行表征, 确证了该化合物的结构, 目标产物的产率提高至51%, 具有产业化应用的前景。
2.3.1 激发光谱与发射光谱
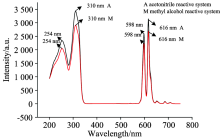
两种反应体系中制备的Eu3+螯合物溶液(c=2.5× 10-5 mol· L-1)的激发光谱和发射光谱, 如图1所示。 激发光谱范围均为200~332 nm, 其中310 nm处为最大吸收峰。 选择310 nm作为激发波长, Eu3+螯合物在598和616 nm处显现了相同的Eu3+特征峰, 分别归属电偶极跃迁5D0→ 7F1、 磁偶极跃迁5D0→ 7F2。 在598和616 nm处, 乙腈反应体系所得Eu3+螯合物强度分别为2 594和3 147, 跃迁强度比值为1.2; 甲醇反应体系所得Eu3+螯合物强度分别为2 237和2 692, 跃迁强度比值为1.2, 表明了该螯合物结构对称性较好, Eu3+大致处于反演中心。 Eu3+螯合物的荧光强度略有不同: 乙腈反应体系所得Eu3+螯合物的荧光强度稍高于甲醇反应体系。
2.3.2 铕螯合物溶液的荧光强度与Eu3+浓度的关系
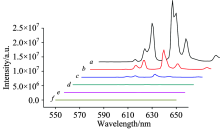
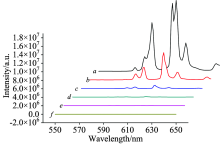
两种反应体系所得梯度稀释的Eu3+螯合物溶液的发射光谱, 如图2和图3所示。 在激发波长为330 nm时, 选取发射峰611 nm处的荧光强度进行分析比较, 如表1所示, 应用双对数函数模型和线性拟合进行分析比较, 如图4— 图6所示。 从图中可知, 两种反应体系中Eu3+螯合物溶液的荧光强度与Eu3+浓度在10-8~10-5范围内呈线性变化, 相关系数分别为0.993 73和0.986 65。 在相同浓度下, 乙腈反应体系所得Eu3+螯合物的荧光强度稍高于甲醇反应体系。
 | 图4 Eu3+螯合物溶液荧光强度与Eu3+浓度的关系(λ 发射=611 nm)Fig.4 The relationship of between the fluorescence intensity and the concentration of europium (λ emission=611 nm) |
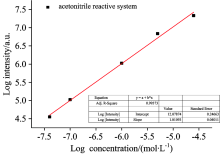 | 图5 Eu3+螯合物溶液荧光强度与Eu3+浓度的关系(乙腈反应体系, λ 发射=611 nm)Fig.5 The relationship of between the fluorescence intensity and the concentration of europium (acetonitrile reactive system, λ emission=611 nm) |
 | 图6 Eu3+螯合物溶液荧光强度与Eu3+浓度的关系(甲醇反应体系, λ 发射=611 nm)Fig.6 The relationship of between the fluorescence intensity and the concentration of europium (methyl alcohol reactive system, λ emission=611 nm) |
| 表1 不同浓度Eu3+螯合物的荧光强度 Table 1 The fluorescence intensity of europium cryptate of different concentration |
2.3.3 量子产率
两种反应体系所得Eu3+螯合物溶液(c=2.5× 10-5 mol· L-1)的量子产率, 如表2所示。 其量子产率基本相等, 分别为12.7%和12.8%。 一般情况下, 量子产率介于0.1~1之间的物质在荧光研究方面具有一定的意义。 因此, 乙腈和甲醇两种反应体系均可获得荧光强度较好的Eu3+螯合物。
| 表2 Eu3+螯合物的量子产率 Table 2 Quantum yield of europium cryptate |
2.3.4 荧光寿命
乙腈和甲醇反应体系所得Eu3+螯合物(c=2.5× 10-5 mol· L-1)的荧光寿命分别为825和830 μ s, 如图7和图8所示。 对Eu3+螯合物的荧光寿命与Eu3+浓度的关系进行了探究, 如表3、 图9所示。 数据表明, 在10-6~10-8 mol· L-1浓度范围内, Eu3+螯合物的荧光寿命受Eu3+浓度的影响, 随着Eu3+浓度的减小, Eu3+螯合物的荧光寿命逐渐缩短。 因此, 在均相时间分辨荧光免疫分析过程中, 要结合Eu3+浓度来设定相对应的延迟时间, 从而避免背景荧光的干扰而又不影响目标物质荧光强度的检测。
 | 图7 Eu3+螯合物荧光寿命 (乙腈反应体系, c=2.5× 10-5 mol· L-1)Fig.7 The fluorescence lifetime of europium cryptate (acetonitrile reactive system, c=2.5× 10-5 mol· L-1) |
 | 图8 Eu3+螯合物荧光寿命 (甲醇反应体系, c=2.5× 10-5 mol· L-1)Fig.8 The fluorescent lifetime of europium cryptate (methyl alcohol reactive system, c=2.5× 10-5 mol· L-1) |
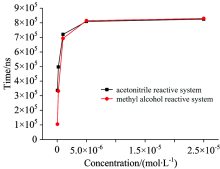 | 图9 Eu3+螯合物荧光寿命与Eu3+浓度的关系Fig.9 The relationship of between the fluorescence lifetime of europium cryptate and the concentration of europium |
| 表3 不同浓度Eu3+螯合物的荧光寿命 Table 3 The fluorescence lifetime of europium cryptate of different concentration |
通过改变投料比、 反应时间等条件优化合成Li+⊂2, 6-{N, N’ , N, N’ -[二(2, 2’ -联吡啶-6, 6’ -二甲基)]二(氨甲基)}-吡啶-二羧酸乙酯, 产率明显提高。
两种反应体系合成的Eu3+螯合物的光谱性质: 激发光谱范围均为200~332 nm, 发射特征峰均在598和616 nm处; Eu3+螯合物溶液的荧光强度与Eu3+浓度在10-8~10-5 mol· L-1范围内均成线性, 相关系数分别为0.993 73和0.986 65; 荧光强度略有不同: 乙腈反应体系所得Eu3+螯合物的荧光强度高于甲醇反应体系。
乙腈和甲醇反应体系所得Eu3+螯合物的灵敏度高、 荧光强度强、 稳定性好, 量子产率分别为12.7%和12.8%; 荧光寿命分别为825和830 μ s, Eu3+螯合物的荧光寿命受Eu3+浓度的影响, 对均相时间分辨荧光免疫分析过程中延迟时间的设定提供了参考价值。
两种合成路线均可获得理想的铕螯合物, 拓展了稀土螯合物的合成方法, 为进一步建立均相时间分辨荧光免疫分析奠定了基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|