作者简介: 陈 胜, 1992年生, 北京林业大学材料科学与技术学院硕士研究生 e-mail: shengchen@bjfu.edu.cn
稀酸预处理可打破木质纤维原料天然抗降解屏障, 提高后续酶解和发酵效率, 从而使其更高效地转化为生物燃料, 然而在亚细胞水平上纤维细胞壁的解构机理仍有待深入研究。 采用共聚焦显微拉曼光谱技术与主成分聚类分析法结合, 研究了稀酸预处理前后马尾松细胞壁区域化学变化特点。 结果表明, 累计贡献率高达94.61%的第一与第二主成分空间中光谱样本散点呈现规律性分布; 聚类分析可准确提取细胞壁不同形态区域平均拉曼光谱。 结合拉曼成像分析发现, 细胞角隅木质化程度高, 含有较多木质素, 次生壁木质化程度低, 含有较多碳水化合物。 稀酸预处理导致马尾松细胞壁发生了不均一解构, 其致密空间结构被破坏, 次生壁中碳水化合物典型特征峰2 890 cm-1处信号强度降低了26.9%, 表明碳水化合物从该区域大量脱除; 碳水化合物在复合胞间层少量脱除, 而细胞角隅则出现了其轻微富集。 木素在稀酸预处理后发生了重新分布, 细胞角隅区拉曼信号显著增强。 碳水化合物(主要为半纤维素)的溶出及木质素的重新分布削弱了生物质原料的抗降解性, 有利于后续酶解糖化。 该研究不仅提供了一种快速、 高效的纤维细胞壁区域化学分析方法, 还为林木生物质高值转化的研究奠定了重要的理论基础。
Dilute acid pretreatment (DAP) is an attractive method to overcome the natural recalcitrance of lignocellulosic materials, the enzymatic conversion of which can be improved significantly. Therefore, lignocellulosic biomass can be converted to biofuels with a higher efficiency. However, the mechanism of cell wall deconstruction during DAP on sub-cell level is still unclear. In this study, the topochemical changes of Pinus massonianafiber cell walls after DAP was investigated using confocal Raman microscopy combined with principal component analysis and cluster analysis. The samples were presented with specific distribution in the first and second principal component space, which were with cumulative contribution of 94.61%. The accurate average Raman spectra from different lamellas of cell walls were obtained by cluster analysis. With Raman imaging combined, it was observed that the high-lignified cell corner (CC) was with a high concentration of lignin and the low-lignified secondary wall (SW) was with a high concentration of carbohydrates. The heterogeneity of cell wall deconstruction in Pinus Massoniana during DAP was alsovisualized; the compact structure of raw materials was disrupted. The Raman intensity of typical carbohydrates bans at 2890 cm-1 in the SW decreased 26.9% when compared with that for untreated samples, which indicated thatvast carbohydrates were removed from the SW. A certain amount of carbohydrates was also removed from the compound middle lamella (CML), but slight carbohydrates enrichment was observed in the cell corner. Lignin redistributed during DAP and therefore the Raman intensity of lignin in cell corner was enhanced. The removal of carbohydrates (mainly hemicelluloses) and the lignin redistribution can improve the enzymatic hydrolysis by increasing the cellulose accessibility. The present study not only provides a convenient and efficient method for investigating topochemistry of fiber cell walls, but also brings new insights into studying the high-value conversion of lignocellulosic biomass.
利用持续、 可再生的木质纤维生物质生产液体燃料、 生物基材料被认为是缓解当今能源、 环境危机的有效途径, 然而较高的转化成本制约了其进一步的发展。 阻碍生物质原料高效、 低成本转化的主要因素是其细胞壁天然抗降解屏障。 研究表明, 木质纤维生物质主要化学组分为纤维素、 半纤维素和木素, 三者通过化学键和其他形式紧密连接形成复杂且致密的网络结构, 其中作为骨架的纤维素被半纤维素和木素紧密包裹, 很难被转化为目标产物[1]。 更重要的是, 细胞壁中三大组分在不同形态学区域中分布规律差异显著, 这种不均一性进一步阻碍了生物质的高效利用。 因此, 对木质纤维原料进行预处理是实现生物质高效转化的必要前提, 可以破坏植物细胞壁的原本结构, 改变原料化学组分含量及空间分布等, 提高物料传质系数和底物的可及性, 从而提高综合转化效率。
生物质预处理方法包括化学法、 物理法、 生物法等, 其中稀酸预处理(dilute acid pretreatment, DAP)作为热化学法中的一种, 被广泛应用。 稀酸预处理可以溶解半纤维素、 脱除少部分木素、 改变纤维素的结晶度, 从而有效提高后续酶解转化效率[2]。 然而, 稀酸预处理过程中细胞壁化学组分的溶出机理目前尚不完全明确, 尤其是在亚细胞水平, 稀酸对细胞壁的不均一解构有待进一步研究。
研究细胞壁不同形态区域的化学组分分布及其在稀酸预处理过程中的变化, 需要借助于显微光谱技术, 比如紫外显微光谱、 红外显微光谱和拉曼显微光谱等。 本研究采用的共聚焦显微拉曼光谱技术是拉曼光谱与高倍光学显微镜的有机结合, 具有快速、 无损、 原位、 空间分辨率高等优点, 可以提供细胞壁在稀酸预处理前后的区域化学信息, 包括细胞壁不同壁层的化学成分浓度、 组分空间分布、 三大素化学结构等, 并可进一步通过图像的方式表示出来, 使其更加直观和可视化[3]。 然而, 拉曼光谱数据量巨大, 增加了后续处理和分析的难度, 快速、 自动且准确抽取出不同细胞壁层的拉曼光谱一直是实验过程中的难点。 主成分分析和聚类分析这两种化学计量学方法可以达到压缩数据、 分类光谱的目的, 并能够揭示细胞壁超微结构和化学组分之间的内在联系, 为细胞壁区域化学的研究开辟了新的思路。
本文采用共聚焦显微拉曼光谱技术与主成分聚类分析结合, 基于大量光谱数据, 研究了马尾松细胞壁在稀酸处理过程中的不均一解构机理, 准确提取了不同壁层的拉曼光谱, 并通过化学成像技术分析了组分空间分布的变化规律, 以帮助人们更好地从亚细胞水平阐明稀酸预处理提高生物质后续酶解效率的机理, 同时提出了一种显微拉曼光谱结合化学计量学研究植物细胞壁区域化学的新方法。
马尾松(Pinus massoniana)取自北京林业大学校园苗圃。 选取高于地面约1.5 m处的主干圆盘, 将次生木质部区域切割成15 mm× 5 mm× 10 mm的小木块。 经排气、 软化处理后, 利用平推滑走切片机(Leica SM2010R, Germany)制备厚度为10 μ m的横切片, 用于后续的化学处理和检测。
将一定质量的马尾松切片放入0.1% (W/W)的稀硫酸溶液, 保持固液比为2%(w/v)并置于玻璃反应器中, 在油浴锅中升温至170 ℃, 保温30 min, 待冷却后取出试样, 用去离子水反复冲洗至中性。 获得的样品用于拉曼光谱的检测。
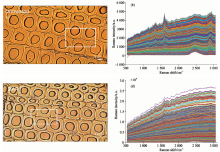
将预处理前后的马尾松横切片置于载玻片上, 用D2O和0.17 mm的盖玻片进行压片、 封片处理。 采用LabRam XploRA全自动激光共聚焦拉曼光谱仪(Horiba JobinYvon公司)对细胞壁选定区域进行逐点扫描, 得到大量拉曼光谱数据(图1)。 光谱仪配备奥林巴斯油镜(MPlan 60倍油镜, 数值孔径NA=1.35)和三维机动化平台。 采用532 nm激光激发波长, 激光强度8 mW, 扫描步距0.6 μ m, 单光谱扫描时间2 s, 针孔孔径300 μ m, 狭缝宽度100 μ m, 光栅1 200 mm-1进行扫描。
利用Matlab软件(Mathworks公司)对拉曼光谱进行数据预处理和主成分聚类分析、 各壁层平均光谱计算及拉曼成像数据获取。 拉曼二维图像和一维线图像的生成采用Origin Pro软件(OriginLab公司)。
数据采集时由于噪音与荧光背景干扰, 使马尾松预处理前后细胞壁拉曼光谱均出现了严重的波动与基线漂移, 如图1(b)和(d)所示。 这将导致后续主成分聚类分析及半定量研究结果不准确, 因此需要进行平滑处理和基线校正。 对未处理马尾松细胞壁的5 916条拉曼光谱[图1(b)]进行算术平均, 获得其平均拉曼光谱, 如图2中蓝色线所示, 可观察到噪音导致的锯齿状波动和荧光背景带来的基线漂移。 针对这些问题, 采用窗口移动多项式最小二乘平滑法(Savitzky-Gola)进行光谱平滑处理, 同时采用自适应迭代重加权惩罚最小二乘法(airPLS)消除荧光干扰[4]。 多项式次数和窗口点数的选择影响着平滑效果, 为去除绝大部分噪声并防止过度平滑导致的信息丢失, 这里选择3次多项式3点平滑处理。 拟合得到的平均拉曼光谱基线如图2黄色线。 经平滑与基线校正后, 平均拉曼光谱如图2红色线, 相比原始光谱, 处理后的光谱更加平滑, 信噪比更高, 荧光背景基本被消除, 基线漂移问题得到解决。
图2用黑色箭头标注了重水特征峰(2 476 cm-1)及马尾松细胞壁主要组分的11个特征峰, 并将后者从低波数到高波数依次编号, 其归属见表1[5]。 纤维素的两个典型特征峰出现在1 097和2 890 cm-1, 分别来自糖苷键C— O— C的非对称伸缩振动和纤维素中CH和CH2的伸缩振动。 由于半纤维素化学结构与纤维素相似, 其拉曼谱图与纤维素谱图容易发生重叠, 故下文中将两者统称为碳水化合物进行讨论。 木素的特征峰主要出现在1 597和1 653 cm-1, 分别来自苯环的对称伸缩振动和松柏醇中与苯环共轭的C=C伸缩振动。
| 表1 拉曼特征峰及其归属 Table 1 Raman bands and their assignments to lignin (L), cellulose (C), and hemicelluloses (Hem) |
共聚焦激光显微拉曼光谱数据集庞大, 加之每条光谱特征峰众多, 导致准确提取、 分析不同形态区域的光谱信息十分困难。 主成分分析可以在尽可能保留原有信息的基础上将高维空间中的样本映射到低维的主成分空间中, 使数据矩阵简化, 降低维数, 达到压缩数据的目的[3]。 主成分为原始变量信息的线性或非线性组合, 是揭示主要矛盾的综合性指标。 为了揭示马尾松细胞壁稀酸预处理前后其主要组分浓度等化学信息变化, 本文对拉曼光谱进行了主成分分析。 主成分载荷因子用于表示主成分分量与原始拉曼光谱变量的关系, 载荷因子图中峰的权重系数越大, 其对该主成分分量的影响程度越深, 即两者的联系越密切[6]。 如图3所示, 前三个主成分的主要影响因子分别为波数1 597, 2 890和2 476 cm-1对应峰, 其分别是木素、 碳水化合物和重水的典型特征峰, 表明主成分分析可以很好地揭示影响拉曼光谱信号响应的关键因素。 蓝色线和红色线分别所示的第一主成分(PC1)和第二主成分(PC2)载荷图包含11个特征峰, 经计算, 前两个主成分的累积贡献率高达94.61%, 原始光谱数据的绝大部分信息已包含在内, 因此后续选用前两个主成分进行分析。
聚类分析可将研究对象按照诸多特性的相似程度进行逐渐聚合, 其中相似度最大的优先聚合在一起, 最终按照类别的综合性质进行分类, 从而完成聚类分析的过程。 采用K-均值法(快速聚类法)对选定的前两个主成分进行聚类分析。 如图4(a), (d)所示, 稀酸预处理前后的马尾松细胞壁拉曼光谱主成分得分图具有相似的形状和散点分布规律, 图中每一个散点对应于一个样本数据, 即细胞壁横切面上的一个扫描位点, 散点之间的距离意味着样本之间特征差异的大小。 在聚类过程中, 分类数k值设置为4, 将处理前后的细胞壁显微拉曼光谱分成了四类[图4(b), (e)], 从第一类到第四类依次对应于细胞壁的不同形态区域, 分别为: 次生壁(SW)、 细胞腔(CL)、 细胞角隅(CC)和复合胞间层(CML)。 这四类分别包含数量不等的拉曼光谱, 经算术平均后得到如图4(c), (f)所示的平均拉曼光谱。 至此, 相比传统的手动选定细胞区域以获得少量光谱平均数据的方法, 我们得到了基于大数据量的细胞壁不同形态区域平均拉曼光谱, 其更加准确与可信。 综上表明, 主成分聚类分析可以准确提取出不同形态区域的平均拉曼光谱, 为进一步揭示不同细胞壁层之间的化学差异奠定了基础。
2.3.1 拉曼光谱分析
不同细胞壁层的拉曼光谱荧光背景强度不同, 其导致的基线漂移程度也有很大差异, 如图4(c)和(f)所示, 细胞角隅基线漂移最为严重, 原因是其木素浓度最高, 故荧光干扰最强, 细胞腔几乎没有荧光干扰, 复合胞间层与次生壁的基线漂移幅度介于两者之间。 基线校正方法, 消除了荧光背景干扰, 得到校正后的马尾松细胞壁预处理前后拉曼平均光谱, 如图5所示。 由于光谱在波数1 750~2 750 cm-1之间并没有出现任何与化学组分相关的特征峰, 故此光谱波段没有展示[7], 波数1 000 cm-1以下的特征峰信号强度较低, 本文亦不做讨论。 与未处理的马尾松细胞壁拉曼光谱相比, 稀酸预处理后各特征峰强度发生了明显的变化, 表明细胞壁化学组分浓度发生了相应的改变, 其致密的抗降解结构受到一定程度的破坏。 对于同一形态区域内的拉曼光谱, 处理前后各特征峰变化程度不同, 说明在预处理过程中化学组分发生了不同程度的降解; 对于不同细胞壁层, 同一特征峰峰强变化亦有较大差异, 表明稀酸预处理导致的化学变化在亚细胞水平上存在不均一性。
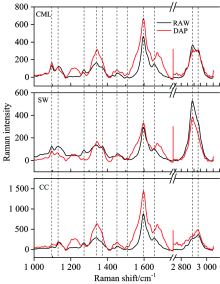 | 图5 稀酸预处理前后各细胞壁层处理后的平均拉曼光谱Fig.5 Preprocessed average Raman spectra of different cell wall layers before and after dilute acid pretreatment |
为了观察稀酸处理前后马尾松各壁层拉曼光谱信号变化, 11个主要特征峰的强度值绘制于柱状图, 如图6。 次生壁1 097, 1 129, 1 375和2 890 cm-1处四个碳水化合物特征峰预处理后拉曼信号强度明显减弱, 其中典型特征峰2 890 cm-1处的信号强度相比未处理样品降低了26.9%, 表明在预处理过程中, 马尾松细胞壁的次生壁脱除了一定量的碳水化合物。 前人研究指出, 稀酸释放的氢离子与水结合形成水和氢离子(H3O+), 导致半纤维素中的糖苷键发生水解, 使其降解为低聚木糖或单糖, 从而增加纤维素的裸露面积, 提高酶的可及度, 有效地增进酶解效率, 而纤维素的降解极其轻微[8], 故本研究中碳水化合物拉曼光谱信号的改变主要由半纤维素浓度变化所致; 复合胞间层2 890 cm-1处的信号强度发生了轻微减弱, 强度值由364.7下降到314.7, 表明该区域有少量碳水化合物被脱除; 然而在细胞角隅区域该信号强度轻微升高, 这可能是由于碳水化合物(半纤维素)在稀酸预处理过程中发生了重新分布, 在其完全从细胞壁溶出前会在角隅等区域轻微富集, 该现象会在下述拉曼成像结果中更直观地观察到。 对于木素, 其主要特征峰(1 597 cm-1)信号强度在预处理后却出现了一定程度的增强, 该现象在复合胞间层和细胞角隅尤为明显, 信号强度在这两个区域分布上升了43.8%和63.9%, 其可能的原因是: 稀酸预处理过程中, 生成的假木素(Pseudo Lignin)包含羰基、 羧基、 芳香环等结构, 会增强木素特征峰的拉曼信号[9]; 木素发生了重分布, 在该区域进行了富集。 Zhou等[10]研究了稀酸预处理白皮松应压木的区域化学变化, 指出在预处理过程中, 木素发生了重新分布, 且木质化程度高的区域木素浓度升高, 木质化程度低的区域木素浓度降低。
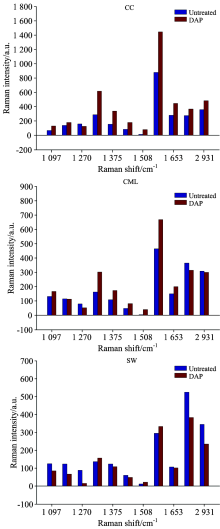 | 图6 稀酸预处理前后不同细胞壁层11个主要拉曼特征峰的拉曼强度2.3.2 拉曼成像分析Fig.6 Raman intensity of 11 prominent Raman bands for different cell wall layers before and after dilute acid pretreatment |
马尾松细胞壁稀酸预处理后, 碳水化合物和木素在不同形态区域里的变化存在着差异, 为了更直观和深入地探究其在较大范围里的变化规律, 本文对碳水化合物和木素进行了化学成像[11], 同时通过一维拉曼线成像研究了稀酸处理前后化学组分的空间分布规律。
图7(a)表示未处理马尾松细胞壁木素浓度分布情况。 通过二维拉曼图像和一维拉曼线成像图可以看出, 从细胞腔依次到次生壁、 复合胞间层, 木素浓度呈逐渐升高趋势, 在复合胞间层木素浓度急剧上升; 细胞角隅区木素浓度最高。 综上, 马尾松细胞角隅和复合胞间层木质化程度高, 而次生壁木素浓度低。 如图7(c)中二维拉曼图像所示, 稀酸预处理后, 细胞壁各形态区木素拉曼信号强度均升高, 但升高幅度存在差异, 结合一维拉曼线成像图可以看出, 复合胞间层和细胞角隅处的木素拉曼信号明显增强, 而次生壁区域木素拉曼信号强度只发生了轻微升高。
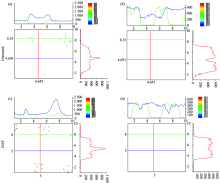 | 图7 未处理和预处理后细胞壁二维和一维化学成像 (a, c): 木素成像; (b, d): 碳水化合物成像Fig.7 Chemical images (2D and 1D-line) of untreated and pretreated cell wall (a, c): Lignin maps; (b, d): Carbohydrate maps |
马尾松细胞壁稀酸预处理前后碳水化合物的空间分布特点如图7(b), (d)所示。 预处理前, 亚细胞水平上各壁层的碳水化合物浓度差异明显, 从细胞腔到次生壁碳水化合物浓度逐渐升高, 再到复合胞间层逐渐下降; 细胞角隅和复合胞间层的碳水化合物浓度相差不大, 但在同一壁层内, 碳水化合物分布不均一。 稀酸预处理后, 次生壁拉曼光谱强度显著下降, 表明该区域碳水化合物浓度严重降低, 复合胞间层光谱强度轻微减弱, 说明该层碳水化合物浓度发生了小幅的降低, 而细胞角隅光谱强度的增大, 表明该区域出现了碳水化合物的轻微富集。 稀酸预处理后, 马尾松细胞壁各层碳水化合物的浓度差异减小, 化学组分空间分布趋于均一。 该结果与平均光谱分析得到的结果相一致。
共聚焦显微拉曼光谱技术与主成分聚类分析方法相结合, 可以准确提取出细胞壁不同形态区域的平均拉曼光谱, 与传统方法相比, 可对大量光谱数据进行压缩处理, 快速获得更准确、 可靠的研究结果。 采用该方法研究了稀酸预处理马尾松细胞壁的区域化学变化, 结果表明, 未处理马尾松细胞壁化学组分空间分布存在不均一性, 细胞角隅及复合胞间层木质化程度高, 但碳水化合物含量低于次生壁; 稀酸预处理后次生壁区域脱除较多半纤维素, 木素发生重新分布并轻微富集于细胞角隅区域; 拉曼光谱成像进一步证实了稀酸预处理马尾松细胞壁各形态区域解构的差异性。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|