作者简介: 王 帅, 1982年生, 吉林农业科技学院农学院副教授 e-mail: wangshuai419@126.com
铁铝锰氧化物催化木质素形成腐殖质具有重要作用。 为阐明微生物-木质素-铁铝锰氧化物三者间的关系, 揭示矿物-菌体残留物的结构特征, 采用液体摇瓶培养法, 以木质素为碳源, 通过添加针铁矿、 三羟铝石及δ-MnO2粉末, 在接种复合菌剂后启动110 d液体培养, 期间动态收集矿物-菌体残留物, 利用FTIR及SEM技术对其特性进行研究。 结果表明: 针铁矿呈松针状结构, 参与微生物利用木质素形成矿物-菌体残留物后表面附着了条状的暗色物质, 表观结构不规则, 但晶体结构并未改变。 菌体中多糖类物质与针铁矿游离羟基的阴离子发生交换作用, 芳香碳结构比例增加, 菌体在针铁矿表面堆积掩蔽了Fe—OH键以及(001)面的γ-OH键, Fe—OH发生质子化使Fe—O键振动频率增强; 三羟铝石表面结构疏松、 呈绒球状物质, 参与形成矿物-菌体残留物后, 缩聚作用明显、 疏松程度降低、 表面微孔结构减少。 氢键作用使矿物-菌体残留物的铝羟基振动频率下降, 即与≡A1—OH相结合的O—H键极性减弱; 木质素引入使芳香碳结构比例增加, 随着培养进行, 其含量先下降, 而后再历经缩合; δ-MnO2表面颗粒粗糙, 以絮状或颗粒状团聚, 参与形成矿物-菌体残留物后, 颗粒团聚趋势明显、 堆积更加紧密、 表面结构更加光滑。 60 d培养期间, δ-MnO2结晶度受到菌体堆积以及氢键作用使O—H键的极性减弱, 而后层间水分子—OH含量增加对其产生了叠加效应, 使3 404~3 435 cm-1处吸收峰强度增加。 菌体中多糖类物质的羟基通过氢键、 化学力与δ-MnO2表面发生缔合, 所形成的矿物-菌体残留物芳香碳结构比例增加, 但Mn—O基团受到掩蔽; δ-MnO2的参与能够使矿物-菌体残留物产生更大数量的芳香碳结构, 为腐殖质形成提供更多的稳定性碳, 其次是针铁矿, 而三羟铝石则在培养30~60 d更有利于木质素的微生物降解。
The Fe, Al, Mn oxides play an important role in the catalytic action of lignin being transformed into HS. In order to elucidate the relationship among the microorganism-lignin-Fe, Al, Mn oxides effectively and reveal the structural characteristics of mineral-microbial residues, the culture method of liquid shake flask was adopted in this article, the lignin serving as the C source, through the addition of goethite, bayerite and δ-MnO2 powder to start the liquid culture of 110 days after inoculating the multiple strains, and then the mineral-microbial residues were dynamically collected and their characteristics were studied by FT-IR and SEM techniques. The results were as follows: goethite had some pine needle structures, and the strips of dark materials were formed and attached to its surface after its participation into the formation of mineral-microbial residues from the microbial utilization of lignin. The apparent structures of goethite were irregular, but its crystal structure had not been changed. The polysaccharides from the multiple strains could exchange with the anions of free hydroxyl groups of goethite, and the proportion of aromatic C structures could be increased. The Fe—OH bond and γ-OH bond of (001) surface were masked due to the microbial thallus covered on the surface of goethite, and the vibration frequency of Fe—O bond was enhanced by the protonation of Fe—OH; The surface structure of bayerite was loose and resembled with the fluff sphere-like substances. After the participation of bayerite in the formation of mineral-microbial residues, its polycondensation effect was obvious, the loose degree was decreased, and the microcellular structure from its surface was reduced. The aluminum hydroxyl vibration frequency of mineral-microbial residues was decreased due to the hydrogen bonding effect, namely the polarity of O—H bond combined with≡A1—OH was weakened. The introduction of lignin could enhance the proportion of aromatic C structure of mineral-microbial residues, but with the culture, its content was decreased first, and then was through the condensation; The surface of δ-MnO2 particles were rough, which could be aggregated in the flocculent or granular form. After the participation in the formation of mineral-microbial residues, the aggregation trend of particles was obvious, the stacking was more compact and its surface structure was more smooth. During the period of 60 days, the crystallinity from δ-MnO2 was affected by the superposition from the microbial thallus and hydrogen bonding, which could reduce the polarity of O—H bond. The increase of —OH content of H2O molecule in the interlayer could produce a superposition effect on the O—H bond, which could enhance the absorption peak intensity of 3 404~3 435 cm-1. The proportion of aromatic C structure of mineral-microbial residues was caused by the association of the hydroxyl groups from the polysaccharides of microbial thallus with the δ-MnO2 through the hydrogen bond and chemical force, but in the process the Mn—O group was masked. The participation of δ-MnO2 could make the mineral-microbial residues produce much more aromatic C structures and provide much more stable C contents for the formation of HS, followed by goethite, while the bayerite was beneficial to the microbial degradation of lignin during the culture of 30~60 d.
作为自然界中丰度仅次于纤维素、 较难降解的芳香碳化合物, 木质素是一个三维的高分子聚合物。 在植物细胞壁中, 纤维素和半纤维素大多受到木质素保护, 因此在植物残体分解过程, 木质素生物降解的快慢就成为矿化进程的限速环节。 木质素可为腐殖质(HS)形成提供基础物质, 木质素降解与HS形成关系密切[1]。 Smidt等[2]认为, 木质素添加将有助于HS核心组分— — 胡敏酸(HA)的形成。 Š najdr等[3]采用13C标记法研究了H. fasciculare和G. erythropus对森林凋落物中木质素的转化作用, 多数木质素会在两类菌株释放漆酶和锰过氧化物酶作用下转化为HS。 然而, 远古时期HS的形成必然无法摆脱矿物的参与[4], 矿物中铁铝锰氧化物、 微生物与木质素间的相互作用是塑造岩石圈、 形成土壤的关键因素之一。
Liang等[5]认为, 微生物死亡残体对于有机碳量的贡献率可达80%, 而活体微生物对有机碳量的贡献率仅为2%。 Miltner等[6]利用SEM技术对培养所得13C细菌的细胞残体进行检测, 发现该细胞中约有50%的13C被矿化, 10%存在于活的细胞中, 其余40%的13C均存在于死亡残体中, 可见, 微生物死亡残体对于有机质的固持和积累有着重要作用, 其自身的碳分配过程与HS的形成关系密切。 Liang等[5]指出, 微生物细胞壁的残留物主要有几丁质、 肽聚糖和其他细胞壁组分, 该残留物能够持续贡献土壤有机质, 是土壤有机质长期稳定的重要因素。 Schmidt等[7]报道, 土壤中有机质的稳定性并非与其复杂的分子结构有关, 更多是因为矿物的参与使微生物难以结合含碳物质所致。 铁铝锰氧化物是土壤中广泛存在的活性氧化物, 其在催化HS形成方面具有如下规律: Mn(Ⅳ )-氧化物> Fe(Ⅲ )-氧化物> Al-氧化物> Si-氧化物[8], 而在促进总腐殖质聚合物形成方面[9, 10], Fe(Ⅲ )-氧化物> Mn(Ⅳ )-氧化物> Al-氧化物> Si-氧化物> > 无催化剂。
上述报道均围绕木质素降解与HS形成的关系、 微生物残体特性以及铁铝锰氧化物参与腐殖化进程的差异, 而对于氧化物、 木质素及微生物三者间相互作用的探讨尚未见系统报道, 对于铁铝锰氧化物参与微生物利用木质素所形成的矿物-菌体残留物, 是否与HS形成有关均不得而知。 鉴于此, 本研究拟采用液体摇瓶培养法, 以木质素为碳源基质, 通过添加针铁矿、 三羟铝石及δ -MnO2粉末, 在接种复合菌剂后启动110 d的液体培养, 期间动态收集矿物-菌体残留物, 利用FTIR及SEM技术对其特性进行研究, 旨在揭示铁铝锰氧化物在木质素的微生物转化过程对HS形成的差异贡献提供依据。
木质素(CAS No. [9005-53-2])购于东京化成工业株式会社。 针铁矿(α -FeOOH)、 δ -MnO2及三羟铝石(β -Al(OH)3)的制备方法如下[11], α -FeOOH: 称取Fe(NO3)3· 9H2O 50 g于广口塑料瓶中, 加入825 mL蒸馏水使之溶解, 在不断搅拌下缓慢滴加2.5 mol· L-1 NaOH溶液至悬液pH 11.9, 60 ℃陈化48 h; 三羟铝石: 将0.18 mol· L-1的KOH溶液以3 mL· min-1的速度滴加到0.06 mol· L-1的Al(NO3)3溶液中, 并不断搅拌, 直到悬液pH 9.0, 室温下老化30 d; δ -MnO2: 取180 g MnSO4· H2O溶解到1 500 mL浓度为29 mmol· L-1的H2SO4溶液中, 另取120 g KMnO4溶于1 500 mL蒸馏水中, 在搅拌下将该溶液缓慢加入到MnSO4溶液中。 上述经合成的铁铝锰氧化物均采用蒸馏水反复淋洗至中性、 渗析后于60 ℃下烘干并磨细过0.25 mm筛, 备用。
复合菌株由细菌、 放线菌和真菌三大类群构成, 供试9种菌株均为白浆土的优势菌, 经筛选、 分离的菌株种类如下: 枯草芽孢杆菌(Bacillus subtilis)、 巨大芽孢杆菌(Bacillus megaterium)、 短小芽孢杆菌(Bacillus pumilus)和地衣芽孢杆菌(Bacillus licheniformis)属细菌, 采用稀释平板法分离、 划线法纯化、 牛肉膏蛋白胨培养基扩培; 灰色链霉菌(Streptomyces griseus)和细黄链霉菌(Streptomyces microflavus)属放线菌, 采用稀释平板法分离、 划线法纯化、 高氏一号培养基扩培; 绿色木霉(Tichoderma viride)、 黑曲霉(Aspergillus niger)和桔青霉(Penicillium citrinum)属真菌, 分离采用稀释平板法、 纯化采用单孢子分离法、 计数采用血球计数板、 扩培采用马铃薯葡萄糖琼脂培养基进行。 复合菌株悬液的制备方法如下: 用少量无菌生理盐水将扩培好的单一菌株(或孢子)洗下, 倒入装有一定体积无菌生理盐水的三角瓶中, 30 ℃条件下振荡30 min制成单一菌株悬液, 随后将所制备的九种单一菌株悬液等量混匀, 制得复合菌株悬液, 悬液中枯草芽孢杆菌、 巨大芽孢杆菌、 短小芽孢杆菌和地衣芽孢杆菌菌落数分别为9.8× 106, 5.9× 106, 6.3× 106和3.2× 106 cfu· mL-1, 灰色链霉菌和细黄链霉菌的菌落数分别为6.0× 109和5.1× 109 cfu· mL-1, 绿色木霉、 黑曲霉和桔青霉的孢子数量分别为68, 152和121 cfu· mL-1。
采用液体摇瓶培养法进行, 培养液配方参照察氏培养基进行, 以木质素为碳源, 配方如下: NaNO3 2.0 g, K2HPO4 1.0 g, KCl 0.5 g, MgSO4 0.5 g, FeSO4 0.01 g、 木质素1.0 g、 水1 000 mL, 无需调节pH值。 称取300 mL培养液装入500 mL锥形瓶中, 结合试验设计添加1.0 g氧化物, 塞好自制棉塞, 用报纸包扎好后进行高压蒸汽灭菌, 121 ℃下进行20 min灭菌彻底后, 在无菌条件下自然冷却, 随后接种复合菌株悬液。
结合实验目标, 设计如下三个处理: 针铁矿(Goethite)用G表示; δ -MnO2(δ -Manganese dioxide)用Md表示; 三羟铝石(Bayerite)用B表示, 另设两个对照组: -CK1, 无微生物, 以等体积无菌水替代复合菌株悬液, 向混有氧化物的木质素培养液中接种; -CK2, 无木质素, 在仅有氧化物、 缺失木质素的培养液中接种复合菌株悬液。 G、 Md和B处理, 复合菌株悬液的接种体积均为20 mL/300 mL培养液, 接种后, 塞好棉塞, 用报纸包扎好, 在28 ℃恒温条件下摇瓶(180~200 r· min-1)培养110 d, 分别在10, 30, 60和110 d动态取样, 取样后立即高速离心(12 000 r· min-1, 10 min), 沉淀物质回收, 即为矿物-菌体残留物, 在60 ℃鼓风干燥48 h后、 磨细过0.25 mm筛。
矿物-菌体残留物样品与光谱纯KBr 1:100混合、 研磨、 压片, 利用FTIR-850傅里叶变换红外光谱仪(天津港东科技发展股份有限公司)进行FTIR测试: 扫描次数32, 分辨率4 cm-1, Y轴格式: 透过率, 切趾方式: Triangle, 每次采集样品前采集背景并扣除。
采用SS550型扫描电子显微镜(日本岛津仪器公司)对样品进行表面形貌观察, 测试条件为15.00 kV, 分辨率为6 nm。
针铁矿是土壤中较为稳定且普遍存在的无机矿物, 尽管仅占土壤组成的1%~5%, 但其比表面积可达土壤总比表面积的50%~70%[12], 且表面羟基活性高于粘土矿物。 图1是针铁矿及参与形成矿物-菌体残留物的SEM图像, 由该图可知, 针铁矿呈松针状结构, 聚集在一起类似一个绒球, 表面结构粗糙, 与尹永远等[13]制备的针铁矿微观结构一致。 在参与微生物降解木质素后, 针铁矿表面附着了条状的暗色物质, 表面结构变得不规则。 尽管如此, 针铁矿的晶体结构并未发生改变, 这与张晶等[14]研究针铁矿与腐殖酸复合的结论一致, 同时表明, 针铁矿与木质素、 微生物间的结合方式也可能是化学成键, 最终由针铁矿单矿物多聚合成放射状集合体。
图2是三羟铝石及参与形成矿物-菌体残留物的SEM图像, 由该图可知, 三羟铝石表面结构疏松、 呈绒球状物质, 边缘模糊不清、 表面凹凸不平。 在参与微生物利用木质素形成矿物-菌体残留物后, 缩聚作用明显, 带有负电荷的木质素以及菌体残留物能够起到静电引力作用, 团聚更多携带正电荷三羟铝石的细小微粒。 菌体分泌的粘液能够把微生物以及三羟铝石粉末包裹在一起, 进矿液中的菌体很难再从矿粉中分离出去。 从SEM图像来看, 由三羟铝石参与形成的矿物-菌体残留物团聚结构疏松程度降低, 表面微孔结构减少, 反射光泽更为明显。
 | 图2 三羟铝石及参与形成矿物-菌体残留物的SEM图像Fig.2 SEM photographs of bayerite and its formed mineral-microbial residue |
图3展示了δ -MnO2及参与形成矿物-菌体残留物的SEM图像, 由该图可见, δ -MnO2表面颗粒粗糙, 由众多小球簇集构成的类似蜂窝状或隧道结构, 有明显的堆积孔, 呈无定形态, 以絮状或颗粒状团聚在一起, 外部形态与李秀娟等[15]描述一致。 而在参与微生物利用木质素形成矿物-菌体残留物后, 样品颗粒团聚趋势明显, 堆积更加紧密, 大量孔道消失, 致使比表面积下降, 同时, 残留物表面结构亦可出现明显的晶体状结构, 粗糙的表面因吸附更多的木质素及菌体物质而使δ -MnO2表面更加致密光滑。
2.2.1 针铁矿参与形成矿物-菌体残留物的FTIR测试结果
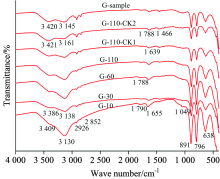
图4展示了针铁矿及其参与形成矿物-菌体残留物的FTIR, G-10, G-30, G-60和G-110分别代表针铁矿参与液体摇瓶培养10, 30, 60和110 d所形成矿物-菌体残留物的FTIR; G-110-CK1, G-110-CK2和G-sample分别表示针铁矿参与CK1和CK2对照试验所形成残留物以及针铁矿原样品的FTIR。3 386~3 421 cm-1是针铁矿吸附水的吸收峰, 即水合羟基峰, 3 130~3 161 cm-1是O— H键的强吸收峰, 即游离羟基峰[16], 2 926 cm-1代表不对称脂肪族C— H的伸缩振动, 2 852 cm-1是对称脂肪族C— H的伸缩振动, 1 786~1 790 cm-1处弱峰是分子内形成氢键— C— H的伸缩振动, 1 639~1 655 cm-1代表针铁矿表面吸附水的弯曲振动频率[17]或芳香环骨架C=O的伸缩振动, 1 454~1 466 cm-1为脂族结构中甲基和亚甲基的变形振动[18], 1 043~1 049 cm-1处吸收峰强度较弱, 是针铁矿表面Fe— OH的弯曲振动, 891~893 cm-1是针铁矿内部— OH的伸缩振动, 为针铁矿(001)面δ -OH向里的弯曲振动, 795~797 cm-1是表面— OH的伸缩振动, 为针铁矿(001)面γ -OH向外的弯曲振动, 638 cm-1代表Fe— O的弯曲振动[19]。
可以用比值R=I1 639/I2 926+I2 852来描述样品中芳香族和脂肪族化合物的比例。 I1 639为芳香环骨架C=O的峰强; I2 926为不对称脂肪族的峰强; I2 852为对称脂肪族的峰强。 比值越大, 表明芳香族结构越多。 由表1所示, 与G-sample相比, G-110-CK1和G-110-CK2在1 454~1 466和638 cm-1两处吸收峰强度均有所增强、 比值R有所增加, 相反, 在1 043~1 049和795~797 cm-1处的吸收峰强度有所减弱。 针铁矿参与形成的矿物-菌体残留物, 在3 130~3 161 cm-1处吸收峰强度有着不同程度增强, 比值R可获较大程度提高, 1 043~1 049和795~797 cm-1两处吸收峰强度均有所减弱, 10和30 d培养所得的矿物-菌体残留物在3 404~3 421 cm-1处的吸收峰强度低于G-sample, 而60和110 d培养所得残留物在该处振动峰频率较弱。 在G-10的矿物-菌体残留物在1 454~1 466和638 cm-1处的吸收峰强度均低于G-sample, 而G-30, G-60和G-110在上述两处吸收峰强度均有所增高。 可判断, 针铁矿通过表面游离羟基O— H键的作用与菌体残留物缔结, 菌体中的含氧阴离子与针铁矿表面的活性基团发生了相互作用, 芳香碳结构比例有所增加, 菌体残留物的堆积掩蔽了针铁矿表面Fe— OH键以及(001)面的γ -OH键, 两处吸收峰强度有所降低。 复合菌株及所分泌的的多糖类物质能够在1 043~1 049 cm-1处吸收峰基础上进行叠加, 随培养进行, 菌体中多糖类物质与针铁矿游离羟基的阴离子发生交换作用[17]、 微生物繁衍致使菌体堆积在针铁矿表面的Fe— OH键, 可使该处吸收峰强度不断削弱。 与针铁矿相比, 在30 d培养期间, 矿物-菌体残留物中的水合羟基含量降低, 而在60 d培养后水合羟基含量再次得到提升, 同理, 培养10 d可使矿物-菌体残留物中脂族C— H及Fe— O的弯曲振动频率降低, 而后Fe— OH发生质子化, H+进入溶液, 使Fe— O键逐渐增强。
| 表1 针铁矿参与形成矿物-菌体残留物FTIR主要吸收峰相对强度的变化 Table 1 The change of FTIR main absorption peaks’ relative intensity of mineral-microbial residue formed by goethite |
2.2.2 三羟铝石参与形成矿物-菌体残留物的FTIR测试结果
如图5所示三羟铝石及其参与形成矿物-菌体残留物的FTIR, B-10, B-30, B-60和B-110分别代表三羟铝石参与液体摇瓶培养10, 30, 60和110 d所形成矿物-菌体残留物的FTIR; B-110-CK1, B-110-CK2和B-sample分别表示三羟铝石参与CK1和CK2对照试验所形成残留物以及三羟铝石原样品的FTIR。 3 656 cm-1处吸收峰归属外表面铝羟基(≡ A1— OH)的伸缩振动[16], 3 550 cm-1附近的吸收峰表现为羟基(— OH)的振动峰, 在3 435~3 463 cm-1范围出现的系列吸收峰代表层间水分子— OH的伸缩振动[13], 为铝(氢)氧化物的游离羟基, 2 922和2 852 cm-1分别代表不对称脂肪族C— H的伸缩振动以及对称脂肪族C— H的伸缩振动, 表面吸附水的弯曲振动频率位于1 630 cm-1, 该处吸收峰亦可归属芳香环骨架C=O的伸缩振动, 1 464 cm-1处吸收峰归属脂族结构中甲基和亚甲基的变形振动, 1 383 cm-1波数处出现的吸收峰归属酚羟基O— H的面内变形振动[19], 1 028和978 cm-1分别归属O— H的伸缩振动和≡ A1— OH的弯曲振动, 图谱中两处吸收峰相互叠加, 因此在后续半定量分析过程进行了合并计算, 781和536 cm-1两处尖锐峰与Al— OH的弯曲振动有关。
由表2可知, 与B-sample相比, 其他样品在3 463~3 656 cm-1处的吸收峰强度均有不同程度增加, 其中B-110-CK1的增加幅度较大, 1 464~1 468 cm-1处吸收峰从无到有, 而1 383~1 385, 779~781和536 cm-1三处吸收峰强度均有不同程度削弱。 在三羟铝石参与下, 由微生物转化木质素所形成的矿物-菌体残留物在1 028~978 cm-1处的吸收峰强度有所降低, 培养10 d所得矿物-菌体残留物的R比值高于B-sample, 而随培养进行, 该比值先降低而后增高, 60 d培养后的结果最低, 而在110 d培养后, 该比值亦大于B-sample。 在仅有复合菌株悬液或木质素其一参与的三羟铝石液体培养时, 残留物中R比值均大于B-sample。 木质素或菌体等有机成分与三羟铝石结合后, 残留物中出现了甲基和亚甲基结构, 碳水化合物— OH形成氢键的伸缩振动也在增强, 尤其是木质素与三羟铝石缔结的情况。 酚羟基O— H, Al— OH等化学键受到菌体残留物的覆盖、 掩蔽, 使相应吸收峰的振动频率减弱。 氢键作用能使与≡ A1— OH相结合O— H键的极性减弱, 导致铝羟基振动频率下降。 10 d培养所得的矿物-菌体残留物, 由于木质素的引入导致芳香碳结构比例增加, 而后随氧化降解的进行, 脂族碳比例增大直至60 d培养完成, 而后再经历缩合。 经过对B-110-CK1和B-110-CK2处理所得残留物进行FTIR检测发现, 添加木质素或复合菌株悬液接种均可使残留物中的芳香碳比例增加, 而在三羟铝石参与微生物降解木质素所形成的矿物-菌体残留物, 比值R的变化表明残留物中芳香碳有减少、 再缩合的规律。
| 表2 三羟铝石参与形成矿物-菌体残留物FTIR主要吸收峰相对强度的变化 Table 2 The relative intensity change of FTIR main absorption peaks of mineral-microbial residue formed by bayerite |
2.2.3 δ -MnO2参与形成矿物-菌体残留物的FTIR测试结果
图6显示了δ -MnO2及其参与形成矿物-菌体残留物的FTIR, Md-10, Md-30, Md-60和Md-110分别代表δ -MnO2参与液体摇瓶培养10, 30, 60和110 d所形成矿物-菌体残留物的FTIR; Md-110-CK1, Md-110-CK2和Md-sample分别表示δ -MnO2参与CK1和CK2对照试验所形成残留物以及δ -MnO2原样品的FTIR。 3 404~3 435 cm-1处宽峰来自于δ -MnO2的— OH的伸缩振动或层间水分子— OH的伸缩振动, 2 924和2 854 cm-1分别代表不对称脂肪族C— H的伸缩振动以及对称脂肪族C— H的伸缩振动, 1 632 cm-1代表δ -MnO2表面吸附水的弯曲振动或芳香环骨架C=O的伸缩振动, 1 464 cm-1处吸收峰归属甲基类C— H的变形振动, 1 043 cm-1处峰为O— H的伸缩振动或多糖结构C— O的伸缩振动[20], 位于541~584 cm-1处的尖锐吸收峰归属层状结构Mn— O键的晶格振动。 由于在1 700 cm-1处没有明显的吸收峰, 通过该图很难推断是否含有羰基和羧基。
由表3可知, 与Md-sample相比, Md-110-CK1和Md-110-CK2处理下的残留物在3 404~3 435 cm-1处的吸收峰强度有所降低, 相反比值R有所增加, 可见, 添加木质素或复合菌株悬液接种均可受到δ -MnO2的强烈吸附, 使δ -MnO2缔合— OH的伸缩振动吸收峰减弱, 木质素或复合菌株悬液的引入会使芳香碳结构比例增高, 在1 632 cm-1处的吸收峰会产生叠加效果, 进而增加1 632/(2 924+2 854)的比值。
| 表3 δ -MnO2参与形成矿物-菌体残留物FTIR主要吸收峰相对强度的变化 Table 3 The change of FTIR main absorption peaks’ relative intensity of mineral-microbial residue formed by δ -MnO2 |
与Md-sample相比, Md-10, Md-30和Md-60在3 404~3 435 cm-1处的吸收峰强度均有不同程度降低, 而在110 d培养后, 该处吸收峰强度被极大增强, 甚至高于Md-sample。 动态培养所得的矿物-菌体残留物, 其比值R以及在1 041~1 047 cm-1处的吸收峰强度均高于Md-sample, 尽管如此, 在培养110 d后1 041~1 047 cm-1处吸收峰强度与Md-sample相似, 反之, 在541~584 cm-1处的吸收峰强度则低于Md-sample。 上述规律表明: 10, 30和60 d培养所得的矿物-菌体残留物, 代表羟基的吸收峰强度远低于未参加反应的δ -MnO2, δ -MnO2结晶度受到菌体堆积以及氢键作用使O— H键的极性减弱, 而在110 d培养后菌体物质层间水分子— OH在δ -MnO2基础上进行了叠加使该处吸收峰强度再次增强, 矿物-菌体残留物中的多糖类物质在整个培养期间, 尽管含量均大于δ -MnO2样品, 但在110 d培养后多糖含量有明显下降趋势, 该物质的极大消耗也表明了缔合的发生, 在此阶段, 细胞代谢物中多糖类物质的羟基通过氢键、 化学力与δ -MnO2表面上的锰(氢)氧化物作用[21]。 在培养过程, 由δ -MnO2参与形成的矿物-菌体残留物比δ -MnO2原样品含有更大比例的芳香碳, Huang等[22]在其报道中指出, δ -MnO2可通过Maillard反应加速腐殖化进程, 而残留物中芳香碳数量增加也验证了这一点, 在此过程, 菌体残留物不断聚集在δ -MnO2表面使541~584 cm-1处吸收峰所代表的Mn— O基团发生了屏蔽。
(1)针铁矿呈松针状结构, 参与微生物利用木质素形成矿物-菌体残留物后表面附着了条状的暗色物质, 表观结构不规则, 但晶体结构并未改变。 菌体中多糖类物质与针铁矿游离羟基的阴离子发生交换作用, 芳香碳结构比例增加, 菌体在针铁矿表面堆积掩蔽了Fe— OH键以及(001)面的γ -OH键, Fe— OH发生质子化使Fe— O键振动频率增强;
(2)三羟铝石表面结构疏松、 呈绒球状物质, 参与形成矿物-菌体残留物后, 缩聚作用明显、 疏松程度降低、 表面微孔结构减少。 氢键作用使矿物-菌体残留物的铝羟基振动频率下降, 即与≡ A1— OH相结合的O— H键极性减弱, 木质素引入使芳香碳结构比例增加, 但随培养进行, 其含量先下降, 而后再被缩合;
(3)δ -MnO2表面颗粒粗糙, 以絮状或颗粒状团聚, 参与形成矿物-菌体残留物后, 颗粒团聚趋势明显、 堆积更加紧密、 表面结构更加光滑。 60 d培养期间, δ -MnO2结晶度受到菌体堆积以及氢键作用使O— H键的极性减弱, 而后层间水分子— OH含量增加对其产生了叠加效应, 使3 404~3 435 cm-1处吸收峰强度增加。 菌体中多糖类物质的羟基通过氢键、 化学力与δ -MnO2表面发生缔合, 所形成的矿物-菌体残留物芳香碳结构比例增加, 但Mn— O基团受到掩蔽;
(4)δ -MnO2的参与能够使矿物-菌体残留物产生更大数量的芳香碳结构, 为HS形成提供更多的稳定性碳, 其次是针铁矿, 而三羟铝石则在培养30~60 d更有利于木质素的微生物降解。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|