作者简介: 方 芳, 1997年生, 中央民族大学生命与环境科学学院理工科创新班学生 e-mail: ffcelina@163.com
前期研究发现太湖过滤水和表层沉积物中Zn含量最高, 且表层沉积物中Cd存在强生态危害。 因此, 在优化实验条件下, 以电感耦合等离子体质谱(ICP-MS)为分析手段研究了太湖苏州湾大桥东表层沉积物(标记为SES)对Cd2+和Zn2+的吸附-解吸特性。 吸附动力学结果表明: SES对Cd2+和Zn2+的吸附能力相差不大, 在吸附时间 t<120 min时, 吸附是一个快速阶段, 而当 t≥120 min时则相反, 吸附趋于动态平衡; Cd2+和Zn2+的吸附更符合伪二级动力学模型。 吸附热力学实验表明, 沉积物对Cd2+的吸附更符合Freundlich模型, 而对Cd2+的吸附更符合Langmuir模型。 沉积物中Cd2+和Zn2+的解吸动力学研究发现, 二者均更符合Elovich方程, 为非均相扩散过程。 且当pH值增大时, 沉积物中Cd2+和Zn2+的解吸量逐渐减小, 并在pH=9时趋于稳定。 结合Cd2+和Zn2+的吸附-解吸特性发现, SES对Cd2+和Zn2+的吸附速率远远大于其解吸速率, 与作者前期研究结果一致。 揭示了太湖表层沉积物对Cd2+和Zn2+的吸附-解吸作用机理及不同因素对吸附-解吸行为的影响。 对研究太湖固-液两相界面重金属的分配和污染水体修复具有重要指导意义。
In our experiment, studies have found that the content of Zn is the highest in the filtered water and surface sediments of Taihu Lake, and Cd has the strongest ecological hazards on surface sediments. Therefore, in this paper, the adsorption and desorption characteristics of Cd2+ and Zn2+ on the surface sediments of Suzhou Bay Bridge East (marked as SES) of Taihu Lake were investigated by using inductively coupled plasma mass spectrometry (ICP-MS) under the optimized experimental conditions. Adsorption kinetics results showed that the adsorption capacity of Cd2+ was similar to that of Zn2+, adsorption was a rapid process within 120 min, and when t≥120 min, the result was the opposite and the adsorption reached to dynamic balance. In addition, the adsorption of Cd2+ and Zn2+ were corresponding to the pseudo-second-order kinetics model. Adsorption thermodynamics experiments showed that the adsorption of Cd2+ on the sediments was in accordance with the Freundlich model, while the adsorption of Zn2+ on the sediments were conformed to the Langmuir model. The assay of desorption kinetics of Cd2+ and Zn2+ in sediments found, both of which were more in accordance with the Elovich equation and belonged to the heterogeneous diffusion. When the pH increased, the desorption of Cd2+ and Zn2+ in the sediments decreased gradually, and tended to stabiliz at pH=9. Combination with the adsorption-desorption characteristics of Cd2+ and Zn2+, the adsorption rates of Cd2+ and Zn2+ were much larger than desorption rates of Cd2+ and Zn2+, which was consistent with the results of our previous studies. This study revealed the mechanism of adsorption and desorption of Cd2+ and Zn2+ on surface sediments of Taihu Lake and the effect of different factors on the adsorption-desorption behavior. It is of great significance to study the distribution of heavy metals and the remediation of polluted water in the solid-liquid interface of Taihu Lake.
太湖是我国五大淡水湖泊之一, 是无锡、 苏州等周边城市区域发展所需的主要水源。 近几年, 太湖周边城市快速的工业化发展, 重金属污染日益加剧, 长时间或大量的排放废水, 严重影响太湖环境。 锌(Zn)是人体的必需元素, 但过量时会导致肝、 肾功能及免疫力受损。 长期在镉(Cd)环境中暴露会造成嗅觉丧失症, 损害肾肺部, 导致肾皮质坏死和肺水肿。 众所周知, 水体表层沉积物是重金属重要的源和汇, 而吸附-解吸是重金属进入水体在沉积物-水界面进行的重要反应之一, 将直接影响重金属在沉积物-水界面的迁移转化和生物有效性。
近年来, 很多学者对河流表层沉积物的吸附-解吸特性进行了深入研究[1, 2], 但对太湖的研究多侧重于富营养化和重金属的污染评价, 而对表层沉积物中重金属(特别是Zn2+)的吸附-解吸特性研究较少。 本文采用电感耦合等离子体质谱(inductively coupled plasma mass spectrometer, ICP-MS)研究了在单离子体系下, Cd2+和Zn2+两种吸附质在SES吸附剂上的吸附-解吸行为, 分析了时间、 pH等不同条件对两种重金属离子吸附-解吸行为的影响和变化趋势。 对研究重金属在太湖水体和沉积物中的空间分布特征、 迁移转化和污染修复具有重要意义。
Agilent 7700X电感耦合等离子体质谱仪(Agilent, USA); Starter 300便携式pH计(Ohaus, USA); Milli-Q纯水系统(Millipore, USA); AVanti-j25冷冻高速离心机(Beckman, USA); THZ-82恒温振荡器(常州国华企业)。
Cd和Zn单元素标准溶液(1 000 mg· L-1, 国家标准物质研究中心)、 ICP-MS调谐液、 高纯氩气、 KNO3、 NaOH、 HNO3(国药集团化学试剂有限公司, 北京)。 所用试剂均为分析纯。
于2016年4月29日在太湖苏州湾大桥东采样点(120° 23'3″E, 31° 15'24″N)使用柱状底泥采样器采集太湖表层沉积物(标记为SES), 风干后过200目筛备用。
1.3.1 吸附实验
精确称取一定量表层沉积物于100 mL三角瓶中, 加入适量2 mol· L-1 KNO3溶液和单元素标准溶液, 调节pH, 振荡一定时间后过滤, 于ICP-MS上测定。 根据吸附前后的质量浓度差计算相应的吸附量(q, mg· g-1)。
1.3.2 解吸实验将吸附重金属以后的表层沉积物离心沉降, 弃去上清液, 加入适量2 mol· L-1 KNO3溶液和超纯水, 振荡一定时间后过滤, 于ICP-MS上测定。 根据解吸的质量浓度计算相应的解吸量(Q, μ g· g-1)。
实验测得表层沉积物的比表面积(BET)为43.09 m2· g-1。 与文献[3, 4]相比, 其值明显大于黄河表层沉积物(6.38~41.20 m2· g-1)和日本Kuchibuto河流的沉积物(6.5~32.8 m2· g-1)。 表明SES能提供更多的吸附位点, 对Cd2+和Zn2+的吸附有利。
图1为表层沉积物的扫描电镜图(scanning electron microscope, SEM)。 由图可以看出, SES的表面呈现大小不同的层状片形结构, 且相邻结构之间存在较大空隙。 由于太湖沉积物的组成以石英和长石等硅酸盐矿物为主(约占95%), 粘土矿物中伊利石/蒙脱石混层约占75%[5], 推测该层状片形结构可能为硅酸盐矿物。 而层状硅酸盐矿物具有二维网格状延展的Si— O四面体骨架, 其层间域内含有大量负电荷, 对重金属离子具有较强吸附性。 其次, 矿物与水接触时会进行表面羟基化, 在形成表面位后可发生表面离子化反应, 进而与重金属离子发生配合作用, 使得重金属离子在矿物表面吸附和富集。
2.2.1 固液比对吸附的影响
在不同梯度的固液比(10~60 g· L-1)条件下, 得到沉积物对Cd2+和Zn2+的吸附量曲线(图2)。 从图中看出, 随固液比增大, 吸附量逐渐降低。 当固液比从10 g· L-1增大至40 g· L-1时, SES对Cd2+的吸附量迅速从0.493 mg· g-1降至0.197 mg· g-1; 固液比继续增加时, 吸附量变化缓慢, 且增至60 g· L-1达到最小值0.133 mg· g-1。 同样对于Zn2+, 固液比增大至60 g· L-1过程中, 吸附量从0.440 mg· g-1降至0.157 mg· g-1。 对比SES对Cd2+和Zn2+的吸附量, 发现SES对Cd2+的吸附作用比对Zn2+更强。 由于电负性的大小在一定程度上反映了重金属离子形成化学键的强弱, 使得电负性大的离子优先被吸附。 Cd2+的电负性(1.69)大于Zn2+的电负性(1.65), 导致SES对Cd2+的吸附作用强于对Zn2+的吸附作用。
 | 图2 固液比对沉积物吸附Cd2+和Zn2+吸附量的影响Fig.2 Effect of solid-liquid ratio on Cd2+ and Zn2+ adsorption quantity on sediments |
2.2.2 pH对吸附的影响
图3是沉积物对Cd2+和Zn2+吸附量随pH变化的趋势图。 pH对沉积物吸附Cd2+和Zn2+的影响趋势相近, 均在pH 4~6时剧烈变化, 在pH 6以后趋于平缓, 且沉积物对Cd2+和Zn2+的吸附量分别在pH等于7和8时达到最大值(0.167和0.164 mg· g-1), 说明中性或弱碱性条件能促进沉积物对重金属的吸附。 pH主要通过影响沉积物颗粒的表面性质和重金属的存在形态, 改变沉积物对重金属的吸附水平[6]。 在酸性条件下, 溶液中存在大量的H+, 会与溶液中重金属离子产生竞争吸附, 产生斥力阻碍重金属离子与沉积物接触, 从而吸附量减少。 随着pH升高, 溶液中H+降低, 竞争吸附减弱, 使SES对Cd2+和Zn2+的吸附量增加。
由图3还可以看出, 当pH为5~6时, SES对Zn2+的吸附优于对Cd2+的吸附, 可能的原因是酸性条件下, 沉积物中重金属的弱酸态对pH变化比较敏感, 并且Cd和Zn的弱酸态在稳定性上存在差异所致。 其次, pH升高, 会促使重金属离子生成沉淀, Cd2+和Zn2+会进入到沉积物水合氧化物的金属原子配位壳中, 在共价键或配位键的作用下与OH-重新配位, 从而结合在沉积物表面, 使重金属离子转化为氢氧化物沉淀而被吸附[7]。 由于氢氧化锌在pH为5.4时开始沉淀, 而此时氢氧化镉尚未开始沉淀, 所以pH为5~6时SES对Zn2+的吸附优于对Cd2+。 又由于Cd2+在pH为7.4时才开始产生氢氧化镉沉淀, 但此时大部分吸附位点已被占据, 吸附趋于饱和。 故在pH大于7时, 吸附量变化缓慢。 因此, 本研究选用pH=6作为优化酸度条件。
2.2.3 时间对吸附的影响
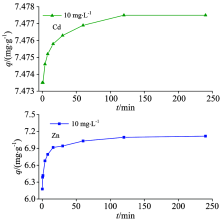
图4为沉积物对Cd2+和Zn2+的吸附量随时间变化的趋势图。 由图可以看出, 沉积物对Cd2+和Zn2+的吸附分为快吸附阶段和慢吸附阶段。 以10 mg· L-1为例, 对于Zn2+, 吸附时间从0增至16 min时, 吸附量从0增至6.916 mg· g-1, 随后在2 h时吸附量缓慢增至7.096 mg· g-1, 2 h后趋于平衡。 可能的原因是, 刚开始时, 沉积物表面存在大量的吸附位点可以吸附重金属离子, 随着吸附的进行, 吸附剂内重金属离子与溶液中重金属离子之间存在的静电斥力增强, 浓度差降低导致后期吸附缓慢直到达到动态平衡。 故选取120 min作为吸附的平衡时间。
2.2.4 吸附动力学
采用伪一级动力学模型、 伪二级动力学模型及粒子内扩散方程对SES吸附Cd2+和Zn2+的吸附机理进行研究。 相关公式及物理量见参考文献[3]。
沉积物的表面存在大量的极性官能团(— OH, — CHO和— COOH等), 这些官能团可在离子交换和表面沉淀等作用下与Cd2+和Zn2+形成配合物。 动力学拟合结果(图5)可知, SES对Cd2+和Zn2+的吸附均更符合伪二级动力学方程(R2≥ 0.997 1), 并以化学吸附为主。
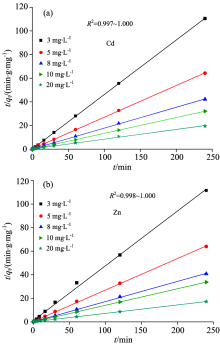 | 图5 沉积物吸附Cd2+和Zn2+的伪二级动力学方程拟合Fig.5 Pseudo-second-order kinetics plots for the adsorption of Cd2+ and Zn2+ on sediments |
Cd2+和Zn2+在SES上的吸附分为三个步骤: 溶液中离子输移到液膜、 从液膜到颗粒物表面和表面扩散至内部。 前两个阶段速率较快, 后一阶段速率较慢。 因此, 整个吸附过程的速率由后期的扩散作用决定。 由SES对Cd2+和Zn2+吸附的qt-t1/2图(图6)可知, 对于Cd2+, 在0~240 min内, 线性关系良好, 表明吸附过程中存在内部扩散。 而对于Zn2+, 存在多级线性过程[8], 第一过程为线性斜率最大的一段, 表明吸附速率变化快, Zn2+在沉积物表面进行非均相扩散, 所需时间约为16 min, 为吸附速率的控制步骤。 第二过程中吸附速率相对缓慢, 主要表示Zn2+由表面转至颗粒内部的扩散过程。
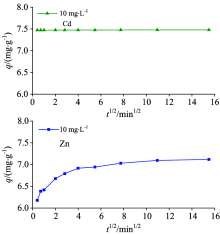 | 图6 沉积物吸附Cd2+和Zn2+的粒子扩散模型Fig.6 Particle diffusion model for the adsorption of Cd2+ and Zn2+ on sediments |
2.2.5 吸附热力学
采用Freundlich模型和Langmuir模型研究SES对Cd2+和Zn2+的等温吸附特性(相关公式及物理量见参考文献[3])。 通过拟合得到的吸附热力学结果及K, n, R2, qm, b列于表2。 由表2可以看出, SES对Cd2+的吸附更符合Freundlich模型, 而对Zn2+的吸附更符合Langmuir模型。 通过表2可知, n值均大于1, 表明Cd2+和Zn2+的吸附为优惠型吸附[9]。 由于Cd2+和Zn2+的K值在0.021~0.129之间, 说明SES对Cd2+和Zn2+的吸附容量受温度影响很小。
| 表2 沉积物对Cd2+和Zn2+吸附的Freundlich方程和Langmuir方程拟合结果 Table 2 Fitting results of Freundlich and Langmuir isotherms for Cd2+ and Zn2+ adsorption on sediments |
对于Cd2+, 由于288和308 K时, Freundlich和Langmuir等温方程均可以较好的描述Cd2+在沉积物中的吸附过程, 表明在该温度下既有化学吸附也有物理吸附。 其次, 在不同温度时SES对Cd2+的最大吸附量在0.199~0.564 mg· g-1之间, 且在298 K时达到最大值(0.564 mg· g-1), 该值高于黄河三湖河口沉积物对Cd2+的吸附量(0.13~0.21 mg· g-1)[3], 说明不同地区的表层沉积物对同一种重金属离子的吸附能力存在较大差异。
SES对Zn2+的吸附能较好的符合Langmuir方程, 说明SES对Zn2+的吸附多为单分子层的化学吸附。 其在不同温度下的最大吸附量在0.165~0.311 mg· g-1之间, 且在288 K时达到最大值(0.311 mg· g-1), 该值低于2010年太湖底泥沉积物对Zn2+的最大吸附量(0.357 mg· g-1)[10]。 可能是温度升高后增强了离子交换能力, 而降低了分子吸附能力, 导致在不同温度下沉积物对Zn2+的吸附作用结果存在差异。
比较太湖沉积物对不同重金属离子的最大吸附量[10], 发现沉积物对Cu2+的最大吸附量高于Cd2+和Zn2+, 可能原因为Cu2+的电负性(1.90)高于Cd2+和Zn2+, 形成了比Cd2+和Zn2+更强的化学键, 因此在沉积物中Cu2+与矿物质生成了共价键[11]。
2.3.1 解吸动力学
图7为Cd2+和Zn2+在沉积物上解吸量随时间变化的趋势图, 由图可以看出, 当重金属的初始浓度从5 mg· L-1变化到20 mg· L-1时, 沉积物中Cd2+和Zn2+的解吸量逐渐增大, 且随时间的增大, 它们的解吸量也增大。 在0~240 min内, 两种重金属离子的解吸量增加迅速, 分别达到1.320和1.319 mg· g-1, 在240 min后解吸量变化缓慢, 达到动态平衡。 其中, Cd2+在300 min后解吸量有所降低, 可能Cd2+在解吸的同时伴随有吸附、 凝聚、 再络合或再沉积等过程。
采用Elovich模型和抛物线方程对SES中Cd2+和Zn2+的解吸数据进行拟合, 结果(图8)显示, 两种重金属离子的解吸过程均更符合Elovich方程。 由于Elovich模型适用于活化能变化较大、 吸附剂化学组分复杂且非均一的过程。 因此, SES中Cd2+和Zn2+的解吸机制属于活化能变化较大的非均相扩散过程。
太湖周边遍布许多小型的纺织厂、 电镀厂和冶炼厂, 导致每年有大量的工业废水排入太湖, 我们的前期研究结果显示, 太湖过滤水中Cd和Zn含量均未超过《地表水环境质量标准》Ⅲ 类标准限值, 然而在表层沉积物中二者含量较高。 结合Cd2+和Zn2+的吸附-解吸特性发现, SES对Cd2+和Zn2+的吸附速率远大于解吸速率, 且当沉积物中Cd2+的解吸速率与Zn2+相当时, SES对Cd2+的吸附速率大于对Zn2+的吸附速率, 这与前期研究发现的太湖过滤水和沉积物中Zn含量最高相一致, 解释了为什么大量的含Cd2+工业废水排入太湖后, 过滤水中Cd2+含量远低于表层沉积物的原因。
2.3.2 pH对解吸的影响
pH对沉积物中Cd2+和Zn2+解吸的影响如图9所示。 结果显示, 随pH值增大, SES中Cd2+和Zn2+的解吸量减少。 对于Cd2+而言, 当pH在4~5之间时, 解吸量变化缓慢, pH在5~6之间解吸量降低(0.818→ 0.512 μ g· g-1), 直到pH=9时逐渐趋于稳定。 对于Zn2+, 当pH在4~7之间时, 解吸量迅速降低(1.884→ 0.173μ g· g-1), 而当pH> 7时, 解吸量降低缓慢, 并趋于稳定。 可能是由于在酸性介质时, 溶液中大量H+与吸附在SES表面的Cd2+和Zn2+竞争吸附位点, 使得更多的Cd2+和Zn2+解吸出来, 而在碱性环境中, 溶液中H+减少, 竞争吸附能力变弱, 使得Cd2+和Zn2+解吸受到抑制。
其次, 沉积物中重金属的可交换态在中性条件下可释放到水体中, 而碳酸盐结合态的重金属对pH变化比较敏感, 在酸性条件下容易解吸, 但重金属的残渣态是重金属在矿物晶体中以硅酸盐形式结合, 可还原态为重金属与FeMn结合的被包裹在一起或生成沉淀的部分, 具有较强的离子键, 均不易释放到水体中。 因此, 随着pH升高, 重金属离子的解吸量逐渐降低。
以ICP-MS为分析手段研究了SES中Cd2+和Zn2+的吸附-解吸特性。 研究结果表明, 随pH增大, SES对重金属离子的吸附量逐渐增大, 且在pH> 6后趋于稳定。 SES对Cd2+和Zn2+的吸附过程分为快吸附和慢吸附两个阶段: 吸附时间小于120 min时, 沉积物对重金属离子的吸附量迅速增大, 而在120 min吸附量缓慢增加逐渐趋于动态平衡。 SES对Cd2+的吸附速率大于对Zn2+的吸附速率, 且二者的吸附动力学均更符合伪二级动力学模型, 并以化学吸附为主。 吸附热力学结果显示, 沉积物对Cd2+的吸附更符合Freundlich模型, 吸附过程存在内部扩散, 而SES对Zn2+的吸附更符合Langmuir模型, 存在多级线性过程。 对解吸动力学研究发现, SES中Cd2+和Zn2+的解吸更符合Elovich方程, 为非均相扩散过程。 且随pH值的增大, Cd2+和Zn2+的解吸量逐渐减小, 并在pH=9时趋于稳定。 结合Cd2+和Zn2+的吸附-解吸特性发现, SES对Cd2+和Zn2+的吸附速率远远大于其解吸速率, 为太湖过滤水和表层沉积物中重金属的固液两相分配及重金属与表层沉积物之间的作用机理提供了依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|