作者简介: 孙 恒, 1990年生, 云南省农业科学院高山经济植物研究所研究实习员 e-mail: sunhengsci@163.com
评价药用植物质量的主要手段之一是有效成分含量检测, 不同采收期对药用植物有效成分含量有明显影响。 通过傅里叶变换红外光谱(FTIR)结合化学计量学建立快速预测不同采收期铁皮石斛中总黄酮含量的方法, 以期为铁皮石斛质量快速预测评价提供研究基础。 采收2014年1至12月的铁皮石斛样品干燥粉碎; 以氯化铝显色法测定铁皮石斛中总黄酮含量, 分析不同采收时间铁皮石斛总黄酮的累积规律; 采集样品红外光谱信息, 归属红外吸收峰, 拟合红外光谱数据和总黄酮含量数据, 结合一阶导数、 二阶导数、 多元散射校正、 标准正态变量、 正交信号校正等对数据进行预处理, 建立偏最小二乘回归模型预测样品中总黄酮含量。 结果显示: (1)样品和标准品芦丁均在270 nm附近有共有吸收峰, 实验以270 nm为总黄酮定量波长, 标准曲线为 y=6.076 5 x+0.055 8, 相关系数 r=0.996 6, 线性关系良好; 重现性、 精密度和稳定性相对标准偏差分别为1.00%, 0.37%和0.28%, 该方法稳定可靠; (2)总黄酮含量随时间变化趋势为先升高后降低, 6月—8月样品含量较高, 平均含量大于64.10 mg·g-1; (3)铁皮石斛红外光谱数据与总黄酮含量拟合后进行一阶导数、 二阶导数、 多元散射校正、 标准正态变量、 正交信号校正等组合处理, 用PLSR模型预测铁皮石斛的总黄酮含量, 结果最佳预处理方式为2D+SG5+SNV+OSC-PLSR, 训练集和验证集 r分别为0.979 0和0.882 4, 验证均方根误差(RMSEE)和预测均方根误差(RMSEP)分别为2.438 2和4.169 9, 铁皮石斛中总黄酮含量预测值与测量值较接近, 表明PLS模型可用于总黄酮含量的快速预测。 傅里叶变换红外光谱结合化学计量学能实现铁皮石斛中总黄酮含量准确预测, 为铁皮石斛质量评价提供快速、 有效的方法。
The detection of active ingredient contents is to evaluate the quality of medicinal plants, and different harvesting time has a significant influence on effective component contents of medicinal plants. In this study, Fourier transform infrared (FTIR) spectroscopy combined with chemometrics was used to establish a rapid method for predicting the total flavonoids content in dendrobium officinale at different harvesting time, in order to provide a basis for the rapid quality evaluation of this species. From January to December in 2014, a total of 111 samples were collected, dried and crushed. In addition, the content of total flavonoids in D. officinale was determined by using traditional method and the accumulation regularity of total flavonoids in D. officinale was studied. Moreover, the infrared spectra of the samples were recorded and their bands were identified. The original spectra were pre-processed by combining the first derivative, second derivative, standard normal variable, multiple scattering correction and orthogonal signal correction. Processed FTIR spectra were set as variable X and the contents of total flavonoids were set as variable Y. The PLS model was established to predict the total flavonoids content. The results showed that: (1) Both the sample and the standard rutin had a common absorption peak near 270 nm. In this experiment, the total flavonoid was measured at 270 nm. The standard curve equation of total flavonoids was y=6.076 5 x+0.055 8, r=0.996 6 and the precision, reproducibility and stability of relative standard deviation (RSD) were 0.37%, 1.00% and 0.28%, respectively. (2) The content of total flavonoids increased with time at first and then decreased, and the content of total flavonoids was higher than 64.10 mg·g-1 from June to August. (3) The FTIR data was integrated with the total flavonoid content of D. officinale by partial least squares regression analysis (PLSR). The results showed that the optimal pretreatment method was 2D+SG5+SNV+OSC-PLSR, the r and RMSEE of the training set were 0.979 0 and 2.438 2, respectively while R2 and RMSEP of validation set were 0.882 4 and 4.169 9, respectively. The predicted and the measured value of total flavonoid content was close to each other, indicating that PLS model can be used for rapid prediction of total flavonoid content. FTIR combined with chemometrics can accurately predict the total flavonoids content in D. officinale and provide a rapid and effective method for the quality evaluation of D. officinale.
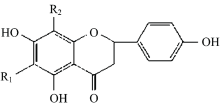
铁皮石斛(Dendrobium officinale Kimura et Migo)为兰科(Orchidaceae)石斛属(Dendrobium)多年生附生草本植物, 主要分布在我国云南、 湖南、 浙江、 广西、 贵州等地区[1]。 据报道, 铁皮石斛含有多糖、 芪类、 黄酮、 酚类等[2, 3, 4, 5]多种化合物, 有益胃生津, 滋阴清热的功效[2]。 目前铁皮石斛化学成分的研究多集中于多糖, 如Huang等[6]通过环磷酰胺人造小鼠氧化模型, 测试铁皮石斛及其纯化多糖, 粗多糖的抗氧化能力, 结果显示, 石斛及多糖能使小鼠胸腺、 血清和肝脏中的总抗氧化能力、 过氧化氢酶(CAT)、 超氧化物歧化酶(SOD)、 谷胱甘肽过氧化物酶恢复到正常范围内。 诸燕等[7]采用苯酚-硫酸比色法测定11个种一至三年生铁皮石斛多糖质量分数, 结果显示一年生、 二年生、 三年生多糖质量分数分别为33.31%, 41.35%, 28.39%。 2015版《中国药典》以多糖为指标性成分对铁皮石斛进行质量评价, 但其成分复杂, 仅以单一指标进行评价较为片面。 天然黄酮类化合物以C6— C3— C6为基本结构骨架(图1), 具有治疗心血管疾病、 抗肿瘤、 抗炎、 防治糖尿病、 抗菌、 抗病毒等生物活性[8]; 结构亚型多种多样, 分布极为广泛, 菌类、 蔬菜和中药中均有发现[9, 10, 11], 一直是药物研发的热点领域。
傅里叶变换红外光谱(FTIR)是一种分子振转光谱, 能获得样品的整体化学信息, 由于其快速、 无损、 简便等特点广泛运用于中药、 农产品、 酒类等质量控制和分析评价中[12, 13, 14]。 紫外可见光光谱(UV-Vis)属于电子光谱, 具有化学的信息全面性和整体性特征, 同时仪器价格便宜, 分析成本低、 分析速度快, 样品预处理简单, 检测灵敏度高等特点[15], 在中药质量控制、 食品原产地鉴别、 食品质量控制、 真假酒鉴别等[16, 17, 18, 19]多个领域均有应用。
红外光谱结合化学计量学被运用于诸多领域, Luí s等[20]基于傅里叶变换近红外光谱对废弃咖啡中咖啡因、 咖啡酸、 儿茶酸、 绿原酸和茶碱的定量分析结果, 偏最小二乘回归分析(PLSR)模型预测集相关系数
选取种源相同的铁皮石斛种苗, 并经云南省农业科学院药用植物研究所金航研究员鉴定为铁皮石斛(Dendrobium officinale), 2011年4月定植于玉溪市红塔区祥馨农产品种植基地, 2014年1月— 12月每月15日采收鲜条, 在60 ℃鼓风干燥5 d, 粉碎过60目筛备用。
傅里叶变换中红外光谱仪(Perkin-Elmer Fronter型, 配备DTGS检测器, 光谱范围4 000~400 cm-1, 分辨率4 cm-1, 信号累加扫描16次)。 压片机(YP-2型, 上海山岳科学仪器仪器公司)。 溴化钾(分析纯, 天津市风船化学试剂科技有限公司)。 UV-2550双通道紫外-可见分光光度计(波长范围: 190~900 nm, 日本岛津公司); 超声仪(SY3200-T型, 上海科导超声仪器有限公司); 超纯水机(Milli-Q型, 美国Millipore公司); 电子分析天平(美国奥豪斯公司)。
样品和溴化钾(KBr)分别于60和100 ℃无风烘制12 h。 取过筛样品与KBr粉末(1∶ 100)混合研磨均匀, 压制均匀成透明薄片, 放入仪器中测定, 同时扣除二氧化碳和水的干扰。 光谱采集过程中室温保持在25 ℃, 空气相对湿度保持在40%~48%。
1.4.1 标品和样品的光谱采集
精确称取芦丁标准品3.0 mg, 溶于10 mL乙醇溶液(70%), 后将母液依次稀释后加入显色剂(0.1 mol· L-1 AlCl3乙醇溶液), 在EXCEL中绘制标准曲线。 准确称取12个月111个铁皮石斛样品粉末(50± 0.2) mg置于具塞试管中, 加入10 mL 70%乙醇溶液, 超声提取1 h, 过滤移取滤液5 mL置于比色管中, 加入显色剂定容至10 mL, 显色时间20 min放入比色皿, 样品光谱采集前, 使用加入显色剂的空白溶液扫描背景, 扫描范围190~900 nm。
1.4.2 方法
1.4.2.1 精密度试验
以111号样品为考查对象, 准确称取(50± 0.2) mg样品1份, 同1.4.1节处理方式重复测定7次, 计算吸收波长的RSD, 考查精密度。
1.4.2.2 重现性试验
以111号样品为考查对象, 准确称取(50± 0.2) mg样品7份, 同1.4.1节处理方式测定样品, 计算吸收波长的RSD, 考查重复性。
1.4.2.3 稳定性试验
以111号样品为考查对象, 准确称取(50± 0.2) mg样品1份, 同1.4.1节处理方式提取, 分别在0.5, 1.0, 1.5, 2.0, 2.5, 5和10 h时测定紫外光谱, 计算吸收波长RSD, 考查稳定性。
利用回归方程结合样品吸光度计算样品中总黄酮含量。 将不同采收期样品的333条原始红外光谱在OMNIC 软件中进行平均、 基线校正、 纵坐标归一化处理。 利用MATLAB 2014a软件对数据进行Kennard-stone运算(筛选模型训练集与预测集); SIMCA-P+ 11.5软件进行Savitsky-Golay平滑(SG平滑)、 一阶导数(first derivation, 1D)、 二阶导数(second derivative, 2D)、 多元散射校正(multiplicative signal correction, MSC)、 标准正态变量校正(standard normal variable, SNV)、 正交信号校正(orthogonal signal correction, OSC)等组合处理; 建立偏最小二乘回归分析模型(partial least squares regression, PLSR); 图形制作软件为ORIGIN 8.0。
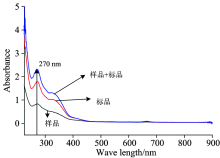
按上述实验条件下采集铁皮石斛样品、 样品+标准品、 标准品的紫外光谱, 结果见图2。 通过谱线对比发现, 样品、 样品+标准品、 标准品在270 nm左右有共有吸收峰, 且样品+标准品后吸收光谱变化明显。 因此, 本实验采用270 nm为总黄酮定量检测波长。
芦丁标准品吸光度与浓度回归方程为y=6.076 5x+0.055 8, 相关系数R2=0.9966, 线性关系良好。 方法学考察重现性、 精密度和稳定性考察结果表明, RSD分别为1.00%, 0.37%和0.28%, 该方法稳定、 可靠。 采集铁皮石斛紫外图谱, 记录270 nm处吸光度数据, 通过回归方程计算各月份样品中总黄酮含量见表1。 显示所有铁皮石斛样品中, 6月— 8月样品含量较高, 平均含量均大于64.10 mg· g-1, 含量值高的月份正好与云南雨季相吻合, 铁皮石斛处于开花结籽时期。 5月份含量值的标准差显著高于其他月份, 表示本月采集的样品个体差异较大。 总黄酮含量变化趋势为先升高后降低, 与李彩霞等[23]对铁皮石斛中多糖含量的积累研究结论恰巧相反, 可能是因为铁皮石斛有性繁殖过程消耗的多糖, 通过植物体内物质代谢与生物合成转化成黄酮类化合物[24]。
| 表1 铁皮石斛1月— 12月总黄酮含量 Table 1 Total flavonoid content of D. officinale samples collected from January to December |
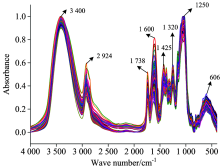
云南玉溪不同月份铁皮石斛红外图谱见图3。 不同采收时间样品红外光谱近似度较高, 吸收峰明显且较多, 1 800~400 cm-1波段内吸收峰比较密集。 其中900 cm-1以下波段主要为烯的碳氢弯曲振动, 苯环环弯曲振动和面外弯曲振动等; 1 310~900 cm-1波段是单键的伸缩振动区和部分含氢基团的弯曲振动; 1 500~1 310 cm-1主要代表了C— H的弯曲振动; 1 800~1 500 cm-1波段主要表征苯环的碳骨架环呼吸振动以及C= N, C= O, C=C等伸缩振动; 2 924 cm-1附近主要为烷烃C— H的伸缩振动; 3 400 cm-1附近主要为O— H伸缩振动。 红外光谱记录了样品中黄酮类化合物O— H, C= O, C=C 苯环等多种化学键的信息, 所以利用红外光谱快速预测铁皮石斛中总黄酮含量理论上可行[25, 26]。
偏最小二乘回归(PLSR)是一种是基于多自变量对多因变量的多元统计分析方法, 可避免因子结构不能确定、 非正态分布的数据和模型识别不清晰等潜在问题。 本工作以预处理铁皮石斛红外光谱数据为自变量, 样品总黄酮含量数据为因变量, 通过PLSR算法建立铁皮石斛总黄酮含量的回归预测模型。 在平均、 基线校正、 纵坐标归一化处理的基础上, 对光谱数据进行S-G平滑(5点, 9点, 15点)1D, 2D, MSC, SNV和OSC等处理。 SG平滑可以有效平滑高频噪音, 提高信噪比; 光谱中基线的平移、 漂移和散射可用导数处理, 且可有效消除其他背景的干扰, 分辨重叠峰提高分辨率和灵敏度; SNV和MSC用于消除由于样品颗粒分布不均匀及颗粒大小不同产生的散射对其光谱的影响; OSC可去除X变量中与Y变量相关性较低的数据[27]。 利用K-S算法(Kennard-stone)选取预测集(1/3)与训练集(2/3); 训练集数据用于建立铁皮石斛总黄酮含量的预测模型(用于稳定该模型), 预测集数据用于验证预测模型的预测能力(评估模型的预测能力)。 训练集模型的RMSEE和
| 表2 不同模型的参数和结果 Table 2 The different PLSR model parameters and results |
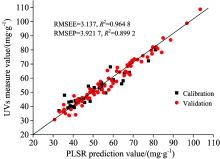
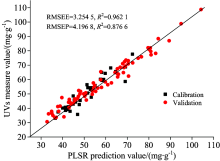 | 图4 2D+SG5+MSC+OSC-PLSR模型的训练集和预测集拟合结果Fig.4 The UVs measure value and 2D+SG5+MSC+OSC-PLSR prediction value |
企业收购铁皮石斛时质量控制可能的新方法— — 傅里叶变换红外光谱结合化学计量学能快速预测铁皮石斛中总黄酮。 111个样品原始光谱经预处理后用2D+SG5+SNV+OSC-PLSR和2D+SG5+MSC+OSC-PLSR建立的偏最小二乘模型的RMSEP均小于4.2,
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|