作者简介: 张彦军, 1973年生, 军事医学科学院卫生装备研究所高级工程师 e-mail: amms7@126.com
多通道近红外光光密度差异检测硬膜血肿的方法具有快速、 无创等优点, 光源周围检测器数量与位置对降低硬膜血肿程度预测模型的病态性, 提高血肿检测精度至关重要。 提出了基于变量投影重要性(VIP)分析的检测器位置筛选方法。 通过对距离光源位置2.0~5.0 cm范围内的30个检测器获得的光密度差异数据进行VIP分析, 分析比较确定VIP阈值后从中筛选出4个检测器。 以偏最小二乘法(PLS)建立基于4个检测位置获得的吸光度差预测血肿发生部位吸收系数的预测模型, 检测器VIP优化后血肿位置吸收系数预测结果平均相对误差由4.08%降低到2.06%。 可见利用VIP分析对检测器筛选后所建立预测模型仍可较好的对硬膜位置血肿程度进行判断。 该研究为近红外光硬膜血肿检测中检测器位置的选择提供了新的思路和重要参考。
Detection of dural hematoma based on multi-channel near-infrared differential absorbance has the advantages of rapidity and non-invasion. In addition,the reasonable setting of the detection array can reduce the morbidity of the model and improve the prediction accuracy of the absorption coefficient. In this paper, variable importance in the projection (VIP) analysis, an ancillary technique of pls, is used to select the detection array. A preliminary modeling for the prediction of dural position μa was established using light absorbance information from 30 detectors located at 2.0~5.0 cm from the light source with a 0.1 cm interval. After VIP screening, the detection array of 4 detection positions is determined, and the optical density information obtained by this array is used for modeling. Moreover, the relative error of the prediction result is reduced from 4.08% to 2.06%. After VIP detector screening, the prediction model still showed good prediction of the epidural position μa. This study provides a new approach and important reference for the selection of detector location in near-infrared dural hematoma detection.
硬膜血肿多发于颅脑创伤之后, 若无法及时准确的诊断并制定合理的诊疗方案, 会给患者带来不可逆脑损伤直至危及生命, 因此创伤性硬膜血肿的无创检测一直是生物医学工程领域的研究热点[1]。 由于近红外波段的光(650~900 nm)对组织内血红蛋白分子的高吸收特性, 通过分析出射光信息可以获得被测脑组织的相关光学属性, 从而实现脑部疾病的快速、 无创检测[2], 基于近红外光的光子输运模型已广泛运用于脑功能成像[3]、 脑部肿瘤成像、 脑血流量检测[4]和脑血肿检测[5]临床应用中。 Britton Chance所在的研究小组首次提出利用颅脑对称位置的光密度差检测脑血肿[6]。 本文在此研究基础上提出多检测器检测方案, 颅脑对称位置的吸光度差异作为模型的输入, 血肿发生部位的吸收系数作为模型的输出, 利用PLS(partial least squares)方法建立预测模型, 从而实现对受测者血肿程度预测。 临床研究表明, 由于成长环境、 年龄、 种族、 性别等因素的影响, 不同人头皮层和颅骨层厚度存在明显的差异, 而这一差异使得不同受测者血肿发生位置不同, 因此如何合理选择检测器位置和数量, 减小头皮层颅骨层厚度差异给检测模型带来的影响, 对提高设备实用性和准确性至关重要。
南京航空航天大学的钱志余教授所在课题小组利用Monte Carlo算法研究光子在生物组织中有效深度的规律, 验证了光子抵达生物组织的有效深度与源探距离存在两倍的关系[7], Gary E Strangman等分析了头皮颅骨厚度的变化对于选择光源与检测器之间距离的影响[8]。 无信息变量消除法[9]、 协同区间回归法[10]、 遗传算法等[11]在回归分析中广泛用于变量的筛选, 变量投影重要性(variable importance in the projection, VIP)分析方法, 该方法是pls提供的一种数据辅助分析算法, VIP分析方法可以计算出各个输入信息对于预测模型的贡献程度, 该方法在流行性疾病数据处理[12], 遥感影像数据分析[13]、 生物化学实验数据分析[14], 血液成分数据处理[15]等领域有着十分广泛的应用前景。 近红外光在生物组织内的传输受到组织吸收系数和散射系数的影响, 不同位置的检测器检测到的信息包含有相同的组织光学系数信息, 因此多个检测器之间信息存在共线性, 本研究拟采用变量投影重要性这一数据分析方法对多个位置的检测器进行建模贡献程度的分析, 筛选出对模型解释能力较强的检测位置, 实现简化检测装置, 提高检测速度的目的。 本研究对距离光源2.0~5.0 cm范围内的30个检测位置进行仿真模拟, 对各个检测位置检测到的信息进行分析, 计算出各个检测位置对血肿程度预测模型的贡献程度, 兼顾模型预测能力和设备的实际设计使用两个方面的因素, 最终确定出4个检测位置, 对这4个检测位置检测到的光密度信息进行偏最小二乘法(partial least squares method, PLS)建模, 建立血肿发生位置吸收系数与检测阵列检测到吸光度差异之间的预测模型。 结果表明, VIP筛选出的检测位置可以实现对血肿层吸收系数的准确预测, 该方法的使用为近红外光密度差异预测脑血肿的设备实现提供了参考, 为最终的临床应用打下基础。
偏最小二乘法对多重线性的输入变量提供了一种数据辅助分析方法, 即变量投影重要性(VIP)。 VIP分析用于计算各个输入变量对模型的解释程度, 从而实现对多个自变量之间模型解释程度的大小排列, 筛选出对模型贡献程度较大的自变量, 在保证模型预测精度的前提下, 简化模型复杂程度, 提高运算速度。 在本研究中, 充分发挥仿真实验的理想特性, 对2.0~5.0 cm范围内以0.1 cm等间隔间距选定30个检测位置, 其中30个检测位置检测到的光密度差作为模型的输入变量, 血肿层吸收系数变化作为输出限量, 进行pls建模, 然后利用VIP计算这30个检测位置的输入信息多模型的贡献程度。 假定有血肿层吸收系数为y, 各个检测位置的光密度差用x1, x2, …, xk表示, 对第j个自变量, 式(1)为VIP计算公式。
其中, k为输入信息的数即检测位置的数量, ch为相关检测位置之间提取的第h新变量, m为血肿预测模型中重新计算出的新变量个数, r(y, ch)是血肿层吸收系数和新变量的相关系数, 表示该新变量对血肿层吸收系数y的解释能力, whj是该检测位置在新变量中所占权重。 由于xj对y的解释能力是通过新变量ch传递, 如果ch对血肿层吸收系数预测的贡献程度很高, 而第j个检测位置的xj对ch的贡献度又非常大, 则可以认为xj可以较好地解释y变量。
在本研究中, 通过计算所有自变量的VIP值, 获得不同检测位置对血肿程度预测模型的解释能力, 通过设置合理的筛选阈值, 简化模型的输入信息, 忽略对模型贡献较小的输入变量, 在模型预测准确度变化不大的情况下, 极大的简化模型复杂程度, 对基于该算法的脑血肿检测设备的实际应用提供新的重要参考依据。
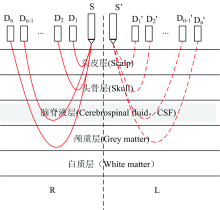
研究拟采用多通道光密度差异实现对颅脑血肿的检测, 检测阵列如图1所示: S和S'为光电二极管, 提供垂直入射到颅脑组织的近红外光; D1-Dn和D'1-D'n分别为距离光源不同间隔的光电检测器。 检测阵列的各个光电检测器同时采集来自经过颅脑组织吸收散射后出射到颅脑表层的近红外光, 检测阵列放置在颅脑对称的检测点, 依次采集各个位置的光密度信息, 两个对阵位置采集到的光密度信息分别是In和I'n, 然后利用式(2)— 式(4)计算出对阵位置在各个检测位置的吸光度差异。
本研究以人体颅脑分层结构为依据, 为模拟不同血肿程度影响, 建立5层平板模型, 其中第一层和第二层为颅脑组织的外层保护组织层, 即头皮层和颅骨层, 这两层对光子的吸收和散射在颅脑血肿检测中是干扰信息, 第三层通常是脑血肿发生的深度, 因此定义为脑积液层, 余下两层为大脑皮质(灰质层和白质层), 仿真模型选择的近红外波长为840 nm, 该波长下各层的光学参数如表1所示[16, 17]。 其中, n为各层组织的折射率、 μ a(cm-1)表征各层组织对近红外的吸收作用、 μ 's(cm-1)表征各层组织对近红外光的散射作用、 g为各向异性因子、 d(cm)表征各层组织的厚度信息。
| 表1 颅脑五层模型光学参数 Table 1 Optical parameters of the five-layer brain model |
外伤性颅脑血肿通常发生在头皮颅骨层以下, 该位置有一层硬膜结构, 临床上对血肿的划分是以血肿相对硬膜位置发生的部位, 如硬膜内血肿、 硬膜外血肿, 即上述模型所定义的血肿层位置。 血肿状态会随着时间发生变化, 其成分的变化会带来血肿层吸收系数的改变, 因此预测血肿层吸收系数对持续监测颅脑血肿的病变有重要意义[18]。 外伤性脑血肿发生时, 会造成硬膜位置吸收系数明显增大, 临床研究表明, 血肿产生时吸收系数往往会带来10倍以上变化, 硬膜位置为颅脑组织中的脑脊液层, 该层结构吸收和散射作用均非常小, 其吸收系数只有0.05 cm-1。 为模拟不同血肿程度, 本研究设置硬膜位置μ a取值范围为0.5~1.5 cm-1, 调整步距为0.1 cm-1。
利用Monte Carlo(MC)仿真对建立的脑部模型进行仿真。 MC已经广泛用于模拟光子在生物组织中的输运过程, 可以很好的描述光子在组织传输中能量状态的改变。 本研究中光子数设置为108个, 光学参数按照表1中840 nm近红外光下各层光学参数进行设置, 每种血肿程度对映的仿真实验进行3次, 取其平均值作为光密度的实际值。 根据Strangman等研究, 人脑头皮厚度为(6.9± 3.6) mm, 颅骨厚度为(6.0± 1.9) mm[8]。 在本仿真过程中, 头皮层颅骨层厚度取其平均值, 即头皮层为0.7 cm, 头骨层为0.6 cm。
选择颅脑头皮头骨厚度为1.3 cm, 其中头皮厚度7.0 mm, 颅骨厚度为6.0 mm。 在MC仿真结果中加入信噪比250∶ 1的白噪声以模拟使用实际设备中光电传感器的信噪比状况。 仿真光源为点光源, 总输入功率为1 J, 光源入射面积为0.01 cm2。
利用MC对不同血肿层吸收系数的五层颅脑模型进行模拟, 对2.0~5.0 cm范围内以0.1 cm等间隔间距选定30个检测位置, 每种吸收系数都可以获得这30个检测位置的光密度信息, 血肿层吸收系数为正常值时作为参考状态, 计算各个检测位置的光密度差异Δ OD。 不同血肿位置的吸收系数作为PLS模型的输出, 30个检测位置的Δ OD作为预测模型的输入, 建立血肿程度预测模型。 然后利用VIP计算公式获得各个检测位置对模型预测结果的贡献程度, 其归一化结果如图2所示。
根据VIP在2.0~5.0 cm径向的分布图, 可以看出不同检测位置对模型贡献程度存在较大差异, 而4个检测(2.1, 2.4, 3.4和4.2 cm)位置对模型贡献程度类似且都处于较高水平, 最终确定基于VIP值的筛选阈值为0.14, 该筛选阈值选择是否合理, 经进一步的研究分析, 通过设置实验组和两个对照组, 实验组为VIP筛选结果, 考虑到仿真实验的理想状态, 为更准确判定针对不同血肿程度的最佳检测器位置组合, 对照组1选择2.0~5.0 cm范围内30个检测器, 分度值为0.1 cm, 这30个检测器获得的光密度差异Δ OD作为输入所建立的PLS模型预测结果, 对照组2选择等间隔分布的光源和检测器, 这4个检测器距离光源的位置分别为2.0, 3.0, 4.0和5.0 cm。 对以上实验组和对照组三组检测阵列信息进行处理, 分别建立血肿层吸收系数和检测阵列光密度差异之间的回归模型, 采用留一法进行交叉验证。
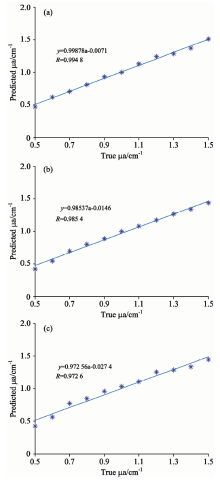
预测结果如图3所示, 图3(a)所示为经过VIP筛选的四个检测器所建立硬膜位置μ a预测模型的结果分析, 回归模型拟合结果和该层真实吸收系数相关度为99.48%, 平均误差为0.02 cm-1, 最大误差为0.04 cm-1; 图3(b)所示为对照组1选择30个检测器所建立硬膜位置μ a预测模型结果, 回归模型拟合结果和该层真实吸收系数相关度为98.54%, 平均误差为0.03 cm-1, 最大误差为0.07 cm-1; 图3(c)所示为对照组2平均选择的四个检测器所建立硬膜位置μ a预测模型, 回归模型拟合结果和该层真实吸收系数相关度为97.26%, 平均误差为0.05 cm-1, 最大误差为0.08 cm-1。 可见, 经过VIP分析优化后的实验组, 其对血肿可能发生位置的μ a预测结果更加准确。
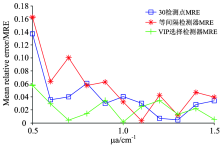
如图4所示为三组实验预测结果的相对误差, 对照组和实验组误差最大值均出现在μ a为0.5 mm-1时, 实验组最大值为0.058 2, 对照组1误差最大值为0.136 9, 对照组2误差最大值为0.162 9。 可以看出利用VIP方法筛选出的4个检测位置所建立的预测模型误差最小, 结果表明, 利用VIP分析方法可以实现简化血肿预测模型提高运算速度的目标。
利用VIP对近红外光通量差异检测硬膜位置μ a模型进行简化, 通过分析光源径向不同位置检测器对模型的重要性, 筛选出对模型重要的检测器, 利用较少的检测器建立准确度很高的模型, 模型相对误差较小, 且可以降低血肿检测过程对硬件的要求和数据运算量。 本研究对脑血肿检测设备的小型化、 便携性有重要参考意义, 为基于近红外光密度差异预测血肿最终实现临床应用打下基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|