作者简介: 马 杰, 1992年生, 西南科技大学环境与资源学院硕士研究生 e-mail: maandjie@126.com
大气颗粒物与微生物共存时的健康效应受到了越来越多的关注。 以大气颗粒物中石英与重金属铅为研究对象, 粉尘浓度为1.6 g·L-1, 制备载带不同浓度铅高硅质粉尘, 以人体常见菌—大肠杆菌为受试对象, 探讨载铅高硅质粉尘对大肠杆菌细胞壁膜损伤的机理。 采用噻唑蓝(MTT)测定微生物的细胞活力后发现, 与对照组相比, 大肠杆菌与载铅石英粉尘作用2 h后, 细胞活力表现出单一铅离子组大于载铅石英粉尘组, 并且呈现重金属剂量效应。 PI的摄入量测试表明, 高浓度载铅粉尘组中摄入量分别高出对照组36%与46%, 单一重金属组摄入量也有较高的增长, 而激光共聚焦显微镜观察图中, 染毒组均出现不同程度的红色荧光, 可以发现载铅石英粉尘作用后的细菌细胞壁膜通透性明显升高, 利用探针标记, 采取荧光分光光度法测定荧光强度显示胞内和溶液中活性氧逐渐增多, 载铅粉尘组(Q+Pb-2, Q+Pb-3)胞内ROS分别较对照组高出2倍和2.5倍, 参照前人研究, 发现溶液中ROS变化主要与重金属离子在其表面结合态数量决定。 综合分析, 活性氧在诱使细胞膜损伤过程中起到决定性作用。 红外表征中, 细胞膜表面磷酸二脂基团、 蛋白质甲基振动及酰胺带等基团与载铅石英粉尘作用后均发生明显峰位偏移, 均与载铅粉尘发生较强相互作用, 一定程度上影响细胞壁膜完整性。 综上, 重金属与粉尘共同作用使得细胞膜通透性发生变化, 细胞壁膜的完整性改变, 影响细胞活力, 最终导致细菌死亡, 活性氧及重金属等的作用导致细胞膜的损伤可能是载重金属高硅质粉尘的一种毒性作用机制。
Health effects of coexistence between atmospheric particulate matter and microbial have received more and more attention. In this paper, quartz and lead in atmospheric particles were used as the object to prepare silica dust with lead, which has different concentrations. The dust concentration was 1.6 g·L-1. All the work is to explore the mechanism of lead coated onto high-silica dust on cell wall/membrane injury of Escherichia coli. MTT (thiazolyl blue) was used to determine the cell viability of microbes. Compared with the control group, the cell viability of lead ion group was higher than that of the group of lead coated onto quartz dust after E. coli was treated for 2 h, it also presented a Dose effect. In PI intake test, it showed that intensity in the high concentration lead dust group was 36% and 46% higher than that in the control group, and intensity in the heavy metal group was the same as that in the former. For the Confocal laser scanning microscope, the results showed that the red fluorescence intensity of the experiment group was significantly higher than that of the control group, suggesting that the permeability of the cell membrane of the bacteria has obviously increased after treated with Pb coated onto quartz dust. The fluorescence intensity measured by fluorescence spectrophotometry showed that the intensity of ROS in the solution and cell both increased. Pb coated onto quartz dust group (Q + Pb-2, Q + Pb-3) were twice and 2.5 times higher than those in the control group, respectively. According to the previous study, the change of ROS in the solution is mainly determined by the amount of the binding state of heavy metal ions on the quartz surface. On the basis of above phenomenon, we found that Reactive Oxygen Species play an important role in inducing cell membrane damage. In the infrared characterization, the effects of Pb and Pb coated onto quartz dust on E. coli surface groups mainly attach importance to phosphodiester group, protein methylation and the amide band of the cell membrane. Those groups showed a significant peak shift after reacted with quartz dust, and all of them showed a strong combination with each other. In summary, the heavy metal and dust together changed the cell membrane permeability, destroyed the integrity of cell membrane gradually, and then affected cell viability, ultimately, the interaction lead to bacterial death. We infer that ROS, heavy metals caused damage to the cell membrane, which might be an vital toxic mechanism of Pb coated onto quartz dust.
大气颗粒物是造成空气污染的最主要来源之一。 其中矿物粉尘、 重金属、 微生物等成分都是大气颗粒物的重要组成部分。 目前对于大气颗粒物中化学组成、 来源研究表明, 降尘中矿物成分包括石英、 方解石、 钠长石、 蒙脱石等[1], Awadh[2]对西亚沙尘天气中矿物相分析表明, 石英占比达到49.2%。 重金属以矿物粉尘和其他介质作为载体[3], 形成复合多组分的大气颗粒物, 其生物活性及安全性也备受许多学者的关注。 超细矿物颗粒在大气中与微生物共存时, 不仅可以作为微生物的载体、 营养源, 且自身的化学组成及表面活性对微生物产生影响。 另外, 人体长期暴露在大气环境中, 矿物细颗粒和人体正常微生物个体在形态、 共存关系和空气动力学行为上均有高关联度[4]。
现今关于超细颗粒物对于微生物的损伤机理主要分为自由基引起氧化损伤[5, 6, 7]、 颗粒物的氧化还原特性致损伤[8]、 颗粒物物理损伤等[9]。 在接触过程中, 大气颗粒物会首先与细胞壁膜接触, 从而造成细胞膜结构完整性变化。 关于矿物颗粒与重金属的联合作用实验已有较多, 集中于纳米颗粒物n-TiO2, n-Al2O3等[10, 11, 12], 毒性评价的对象多集中在水生生物(水蚤、 鱼类等)。 虽然目前关于纳米颗粒物与重金属对水生动物的毒性效应有一定研究。 但这不能完全应用于超细颗粒物与重金属对细菌的毒性作用。
目前国内外对载带重金属超细大气矿物颗粒物的生物效应及从膜损伤角度探讨损伤机理的研究较少。 其多元组分在大气组分中的健康效应不可忽视。 因此本实验选取具有代表性的石英粉尘、 重金属铅以及大肠杆菌作为研究对象, 探讨作用过程中, 载铅粉尘对大肠杆菌的膜结构及其完整性的破坏, 揭示复合颗粒物组分对人体常见菌细胞膜损伤作用。 为评价大气颗粒物安全浓度及对健康的潜在威胁提供理论依据。
1.1.1 试剂和样品
牛肉膏蛋白胨培养基(pH 7.0); PI, SYTO9荧光探针, 购自于美国赛默飞世尔公司; 噻唑蓝(MTT), 二氯荧光乙酰乙酸盐(DCFH-DA)探针购自上海碧云天生物技术有限公司; 氯化铅(AR)、 磷酸二氢钾、 十二水合磷酸氢二钠、 氯化钠、 氯化钾, 购自于成都市科龙化工试剂厂; 石英粉尘, 购于四川南联矿业科技有限公司, 经卧式行星球磨机研磨6 h, D50=2.50 μ m; 载铅石英粉尘制备: 将不同浓度的氯化铅溶液与石英粉尘在无水乙醇中剧烈搅拌24 h后, 于干燥箱中烘干, 经过研磨后待用, 其中石英粉尘浓度为1.6 g· L-1, Pb2+浓度设置为80, 800和1 600 μ g· g-1, 载铅石英粉尘分别编号为Q+Pb-1, Q+Pb-2和Q+Pb-3, 与之对应单一Pb2+溶液编号为Pb-1, Pb-2和Pb-3, 粉尘对照组为Q+Pb-0, 大肠杆菌对照组为E.coli。
1.1.2 仪器
瞬态稳态荧光分光光度计, 日本日立公司; llegra X-15R 离心机, 美国贝克曼库尔特有限公司; Evolution 300紫外分光光度计, 美国赛默飞世尔科技有限公司; HZP-250全温振荡培养箱, 上海精宏实验设备有限公司; 酶标仪, 美国Bioteck仪器有限公司; TCS SP8激光共聚焦显微镜(CLSM), 德国Leica; 红外光谱仪Spectrum One型, 美国PE公司。
1.1.3 微生物培养
大肠杆菌(E.coli), 由绵阳四○四医院提供并纯化处理; 后将复苏的大肠杆菌分别接种于装有100 mL牛肉膏蛋白胨培养基的250 mL锥形瓶中, 放置于35 ℃, 150 r· min-1恒温震荡箱中培养8 h后, 取对数期大肠杆菌在高速离心机中以8 000 r· min-1离心10 min去除上清液, 用生理盐水反复洗涤菌沉淀三次, 在400 mL生理盐水中调节菌液OD600=1.0待用。
1.2.1 细菌存活率测试
将载重金属石英粉尘加入生理盐水溶液中100 W超声30 min, 其中对照组为Pb-0。 铅离子溶液浓度为80, 800和1 600 μ g· L-1, 分别编号为Pb-1, Pb-2及Pb-3。 将配置好的OD600=1.0的菌悬液400 mL分装于8个离心管中离心, 沉淀使用10 mL生理盐水重悬, 分别加入上述配置好的粉尘溶液中, 放入恒温震荡箱中作用2 h后获得菌体样品。
将重金属离子、 载重金属石英粉尘作用前后的大肠杆菌的样品200 μ L加入1.5 mL离心管中, 每管加入20 μ L MTT 溶液(5 mg· mL-1, 磷酸盐缓冲液溶解), 置回培养箱继续暗孵育2 h, 每个样品做3个平行, 以未经重金属离子、 载铅石英粉尘作用前后的大肠杆菌作为对照组。 反应结束后离心, 从一侧小心吸弃培养液, 尽可能避免吸去结晶物而影响结果。 然后, 每管加入150 μ L DMSO, 振荡溶解60 s, 加入96 孔板中, 使用酶标仪于550 nm波长测定各孔吸光度(OD)。 以细菌细胞活性百分比作为细菌细胞活性的评价指标, 其计算公式为
1.2.2 负载重金属粉尘溶液和胞内活性氧测定
采用DCFH-DA探针作为ROS检测试剂, 用荧光分光光度计检测荧光强度以反映2 h内载铅石英粉尘溶液中ROS水平变化的情况。 将一定量的粉尘溶于10 mL生理盐水溶液中, 随后加入配置好的探针溶液(10 μ mol· L-1) 1 mL, 试管在振荡器中培养2 h后在黑暗条件下利用荧光分光光度计, 测定荧光强度(Ex=488 nm, Em=525 nm), 以平均荧光强度反映溶液中活性氧水平变化的情况, 每个实验组设定3个平行。
胞内ROS测定利用DCFH-DA探针为荧光探针, 将1 mL OD600=1.0的菌悬液中在10 000 r· min-1离心10 min, 倾去上清液, 重悬于1 mL 10 μ mol· L-1的DCFH-DA探针中, 在恒温振荡器中37 ℃条件下孵育30 min, 每隔3~5 min颠倒混匀一下, 使探针和细菌充分接触, 然后用生理盐水洗涤菌液三次, 每次15 min, 以去除溶液中残留的DCFH-DA, 再重悬于0.85%的生理盐水中。 在9 mL一定浓度的复合污染矿尘悬液中, 然后加入1 mL加载探针的菌液, 在振荡器中培养2 h后在黑暗条件下利用荧光分光光度计, 测定荧光强度。 以未经载铅粉尘处理的菌液作对照。 其中以平均荧光强度反映活性氧水平。 计算公式如下
1.2.3 负载重金属粉尘作用后大肠杆菌的PI/SYTO9染色观察及荧光测定
细胞膜碘化丙啶(PI)是大分子荧光染料, 能与胞内的核酸等物质结合, 但是PI的特点是其无法穿过结构完整的细胞膜。 只有当细胞膜被破坏, 通透性发生变化, PI才能穿过细胞膜与胞内物质结合发光。 因此可以根据PI的汲取量来判断细胞膜的完整性情况。 以PI和SYTO9为荧光染料对细菌进行标记, 利用激光共聚焦显微镜观察细菌荧光及形态变化, 采用荧光分光光度法测定PI荧光强度。
取重金属离子、 载重金属石英粉尘作用前后的大肠杆菌的样品, 调节样品菌体悬液浓度至OD600=0.3, 向装有1 mL样品的1.5 mL离心管分别加入1∶ 100稀释的荧光探针, 于恒温干燥箱及黑暗条件下孵育30 min, 每隔10 min震荡混匀, 离心取沉淀, 进行压片制样, 在共聚焦显微镜上进行观察, 每组设定2个平行(两种荧光染色剂方法相同)。 采用激光共聚焦显微镜观察、 荧光分光光度计测定荧光强度, 其中SYTO9与PI激发波长为488 nm, SYTO9发射波长为503 nm、 PI为617 nm, 检测大肠杆菌胞内PI的荧光强度, 以表示大肠杆菌死活数量比以及膜的通透性变化。 其中以相对荧光强度表示PI摄入量变化。 公式如下
1.2.4 载铅粉尘作用后大肠杆菌红外光谱分析
收集单一铅离子、 载铅石英粉尘作用前后的大肠杆菌的样品, 于低温冷冻干燥机中干燥48 h, 利用傅里叶变换红外光谱仪进行测定, 光谱范围为4 000~400 cm-1, 扫描次数为32, 分辨率为4 cm-1, 用ominic软件对数据进行处理。
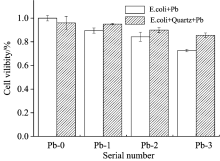
对数期的大肠杆菌与Q+Pb-1, Q+Pb-2, Q+Pb-3, Pb-1, Pb-2及Pb-3作用后, 由图1可以看出与对照组相比, 单一铅离子、 载铅石英粉尘均可导致大肠杆菌细胞活力降低, 毒性作用呈现出不同浓度单一重金属离子Pb(Ⅱ )大于铅石英粉尘, 并随着浓度升高, 毒性逐渐增强。 其中Pb-3存活率为细菌空白对照的72%, Q+Pb-3为对照组的85%, Q+Pb-0为对照组的94%左右。 由于超细石英颗粒对重金属的吸附作用, 使得重金属毒性有一定程度的降低, 但高浓度呈现增强作用。 辛元元[11]等研究纳米TiO2与重金属Cd对铜绿微囊藻毒性结果发现, 纳米颗粒对重金属的吸附使得生物存活率升高; 其他研究中, 重金属与矿物颗粒对大肠杆菌的联合作用后, 相比单一物质, 较高浓度下二者混合作用对细胞活力抑制更为严重, 这与本实验结果相一致。
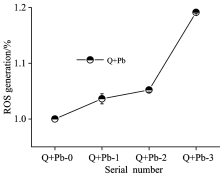
载铅石英粉尘在溶液中释放活性氧(ROS)相对荧光强度如图2所示, 与单一石英组相比, 溶液中的ROS含量均升高, 且随着负载铅离子浓度升高, 体系中的活性氧荧光强度呈现出明显的上升趋势, 其中Q+Pb-2和Q+Pb-3组荧光强度较Q+Pb-0组分别上升了6%和20%。 在粉尘和重金属的作用下, 大肠杆菌胞内的ROS水平均显著的升高, 且随着重金属离子浓度的升高呈现剂量效应, 而细胞壁膜中的蛋白质及磷脂的氧化反应与其密切相关。
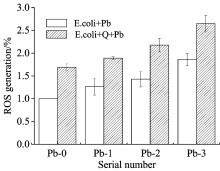
由图3分析发现, 与对照组相比, 铅离子、 载铅石英粉尘作用2 h后胞内产生ROS逐渐增多, 载铅粉尘作用后胞内ROS均大于单一铅离子作用组, Q+Pb-2与Q+Pb-3分别为对照组的2倍及2.5倍多, 显著高于与之对应的单子铅离子组。 其中且随着重金属浓度升高而升高。 现今大气颗粒物组分复杂多变, 各种物质之间相互作用显著。 而颗粒物毒性研究多集中在金属氧化型颗粒, 尤其是纳米颗粒, 其中活性氧及造成的氧化损伤也是目前重要的作用机制之一[13]。 研磨的石英粉尘在水悬液中会释放羟基自由基等活性氧物质, 王明翠[14]等研究表明新鲜研磨的石英粉尘在缓冲液体系中会释放一定数量羟基自由基, 且与粉尘浓度、 粒度等因素有关。 本实验组中, 参照本课题组测定液相自由基及活性氧的方法, 实验组与对照组相比, 各组粉尘组中的活性氧自由基的荧光强度均上升, 且随着负载铅浓度的逐渐增加, 液相中自由基的荧光强度逐渐上升, 与以往研究中发现载铅粉尘的羟基自由基荧光强度随着铅离子浓度上升而上升结果保持一致。
为了探讨载重金属粉尘对于微生物细胞膜的损伤机理, 运用Live/Dead Baclight TM荧光染料对细菌进行染色, 利用激光共聚焦显微镜观察细菌在不同实验组中颜色及形态变化。 SYTO9是一种应用很广泛的荧光染料, 它可以穿过活菌和死菌的细胞膜, 与胞内核酸结合, 发出绿色荧光。 而PI染料只能穿过死菌受损的细胞膜与核酸结合, 发出红色荧光。 共同染色后, 可以通过显微镜观察微生物细胞膜损伤情况, 绿色与红色的比例也可以定性的判断死活比例。 图4为不同浓度载铅粉尘作用后大肠杆菌的荧光图片。
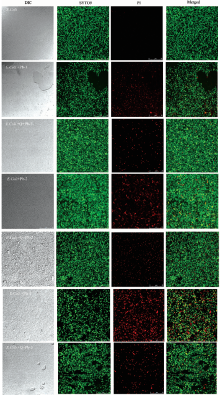 | 图4 载铅石英粉尘作用后的大肠杆菌共聚焦显微镜图片Fig.4 Confocal microscope images of Escherichia coli aftertreated with lead coated onto quartz dust |
图4中可以发现, 无论是单一铅离子或载铅石英粉尘对大肠杆菌的作用中, 相对于对照组, 图中的红色荧光随着负载重金属量的增加有逐渐增加的趋势, 可以看出石英与重金属对于细胞膜均造成一定的损伤作用。 图5中可以看出单一铅离子溶液和载铅石英粉尘组中, 荧光强度与对照相比均有较为显著的升高, 低浓度铅离子中, 单一铅离子溶液与载铅石英粉尘组中荧光强度变化相似, 高浓度中, 载铅石英粉尘组中荧光强度略高于单一铅离子溶液, pb-2组中高出对照组多达36%, 而在Pb-3组中高出对照组约44%。
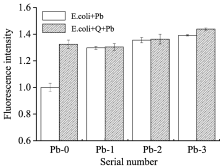 | 图5 载铅石英粉尘作用后的大肠杆菌中PI荧光强度Fig.5 Fluorescence intensity of PI in Escherichia coli after treated with lead coated onto dust |
PI作为一种大分子荧光染料, 可通过细菌的汲取量来判断细胞膜的完整性情况。 本实验中, 从共聚焦显微镜拍摄的图片中可以发现, 与对照组相比, 铅离子组与载铅石英粉尘组作用后的大肠杆菌均出现不同程度的红色荧光, 随着重金属浓度上升图中的红色荧光有逐渐逐渐增多的趋势, 这与实验组中PI荧光强度值相互呼应, 可以推测这种颗粒物对大肠杆菌造成的膜损伤呈现剂量效应, 重金属离子、 粉尘及其形成的自由基与膜成分结合, 发生脂质过氧化、 膜蛋白变性等不可逆变化, 细胞膜的完整性遭到破坏。 而一些抗菌剂及重金属离子作用的研究中发现重金属离子对细菌的细胞膜均存在不同程度的损伤[15, 16], 这与本实验的观察及测试结果相互印证。
对照组大肠杆菌的红外分析中, 1 076和1 234 cm-1分别代表磷酸二脂基团反对称伸缩振动峰和磷酸酯键伸缩振动峰。 1 390与1 450 cm-1处的吸收峰是由蛋白质中甲基对称伸缩振动和反对称弯曲振动引起的。 1 535 cm-1处吸收峰主要是酰胺Ⅱ 带, 是由仲酰胺的N— H键弯曲振动和C— N键。 1 638 cm-1处峰是酰胺Ⅰ 带的C=O键伸缩振动。
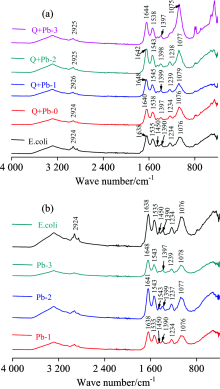 | 图6 铅离子与载铅石英粉尘作用后的大肠杆菌的红外光谱图Fig.6 Infrared spectra of Escherichia coli after treated with lead ion and lead coated onto quartz dust |
载铅石英粉尘与大肠杆菌作用后, 蛋白质中甲基弯曲振动峰首先消失, 随后蛋白质中其他基团与重金属离子相互结合, 低浓度铅离子作用组中, 载铅石英粉尘对蛋白质的酰胺带与磷酸二酯间发生了较强的相互作用, 与单一铅离子相比, 对于基团的结合和影响更大。 而高浓度载铅粉尘组中与单一铅离子红外谱图相似。 由此可以推测重金属较易与蛋白质的某些基团结合, 且粉尘对于这种结合有促进作用。 综上, 粉尘和重金属与大肠杆菌作用后, 菌体表面基团均不同程度的发生了变化, 二者在菌体与矿尘接触的微界面发了一定程度的相互作用, 从而造成细胞壁膜的损伤。 李帅等[17]研究发现纳米二氧化硅与大肠杆菌作用后基团同样发生偏移和消失, 与本实验结果一致。
(1)大肠杆菌与载铅石英粉尘及铅离子作用后, 细菌细胞活力均降低, 而粉尘溶液及胞内ROS增多, 细菌胞内摄入PI量增大, 且通过激光共聚焦显微镜观察得以证实, 表明氧化胁迫造成细胞壁膜的损伤, 是载铅高硅质粉尘一种重要致毒机制; 随着重金属浓度的逐渐升高, 细菌细胞壁膜通透性逐渐增大, 重金属与粉尘存在一定的累积作用。
(2)经过与载铅粉尘相互作用后, 包含大肠杆菌壁膜蛋白甲基振动峰、 酰胺带以及磷酸酯基团等红外特征峰均发生明显偏移, 表明细菌表面的蛋白质的基团发生变化, 也是壁膜损伤的诱因, 最终影响细菌的正常生理活动。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|