作者简介: 常孟方, 1990年生, 华东师范大学精密光谱科学与技术国家重点实验室博士研究生 e-mail: mfchang31@163.com
葡萄球菌核酸酶(SNase)是一种小型球状蛋白, 其变体常用来研究蛋白质的折叠过程。 不同于之前报道的研究方法和技术手段, 采用时间相关单光子计数(TCSPC)及飞秒荧光上转换技术, 结合紫外吸收谱和稳态荧光光谱, 研究了SNase蛋白变体Δ+PHS和Δ+PHS+I92A的荧光动力学, 以及不同温度下蛋白结构与热稳定性的关系, 证明蛋白质内色氨酸残基可作为一种内源性探针对蛋白变体的结构折叠和热稳定性进行印证和研究。 衰减相关光谱(DAS)表明了两种变体随温度变化的不同趋势, 在此基础上进一步分析了这两种变体的结构折叠及热稳定性的差异。 皮秒时间分辨发射光谱(TRES)显示色氨酸残基存在0.5 ns的连续光谱弛豫过程, 而光谱移动量可作为SNase变体蛋白结构紧密程度的判断依据。 飞秒上转换数据分析结果中, 0.5 ps的DAS在光谱蓝端为正、 红端为负, 表明了色氨酸残基受到弛豫效应的影响。 200 ps的寿命则说明色氨酸残基与周围猝灭基团之间存在电子转移过程。 时间分辨荧光各向异性(anisotropy)的分析结果则说明了色氨酸残基在蛋白质体系内具有独立的局部运动, 且其强弱与变体的热稳定性和热运动的整体效果有关。 测量和分析色氨酸残基的时间分辨荧光性质为深入研究SNase蛋白的结构和功能提供了新的思路。
Staphylococcal nuclease is a small globular protein, whose variants are widely used in the researches on protein folding. Different from methods and techniques reported in published papers, fluorescence dynamics of tryptophan residues in two staphylococcal nuclease (SNase) variants Δ+PHS and Δ+PHS+I92A were investigated by time-correlated single photon counting (TCSPC) and femtosecond fluorescence upconversion techniques, combined with UV absorption and steady-state fluorescence spectroscopy. Based on the analysis, structures and thermal stabilities of the two SNase variants were studied. The results proved that tryptophan could be used as an endogenous probe for the structural folding and thermal stability of the SNase variants. Decay associated spectra (DAS) of SNase variants showed different changing trends upon temperatures. According to this, structural folding and thermal stability of the two variants were analyzed. Time-resolved emission spectra (TRES) demonstrated the 0.5 ns continuous spectral relaxation process of tryptophan residue, in which the spectral shift showed the compactness difference of folding structures of the two SNase variants. In femtosecond upconversion results, DAS of 0.5 ps lifetime had “positive blue edge and negative red edge”, which showed relaxation effects on tryptophan residues in SNase variants. Moreover, the lifetime of 200 ps indicated the electron transfer between tryptophan residues and surrounding quenching group. Analysis of time-resolved anisotropy showed that the tryptophan residues had independent segmental motion in the protein system, and its intensity was related to the thermal stability of SNase variants and the overall effect of thermal motion. Time-resolved fluorescence measurement and analysis of tryptophan residue helped to investigate the relationship between structure and function of protein.
在生命科学领域中, 荧光光谱技术应用广泛[1, 2, 3], 特别是在生物大分子(包括蛋白质、 DNA等)检测及其动力学分析的研究中尤为重要[4]。 时间分辨荧光光谱技术是一种高灵敏度和高分辨率的测量手段, 主要包括基于非线性光学的频率上转换技术和时间相关单光子计数技术(time-correlated single photon counting, TCSPC), 二者分别用于测量数百飞秒量级和数百皮秒量级以上的荧光寿命。 色氨酸作为一种高效的内源性探针, 备受研究者们的青睐, 其分子式如图1(a)所示。 通过测量色氨酸残基的时间分辨荧光光谱, 并在此基础上进行相关的数学分析, 可以得出多肽或蛋白质微环境的变化以及结构变化[5]。 色氨酸残基的时间分辨荧光光谱通常都表现出多指数的衰减过程, 主流观点认为是由蛋白质基态异质性、 旋转异构体和溶剂弛豫效应等因素造成的。 此外, 由于多肽或者蛋白中存在例如肽键或者组氨酸一类的猝灭基团, 可能造成色氨酸残基的荧光寿命猝灭。 衰减相关光谱(decay-associated spectra, DAS)是一种分析溶剂效应的方法。 在此基础上, 可进一步构建出时间分辨发射光谱(time-resolved emission spectra, TRES)研究分析瞬时发射光谱的形状和相对移动, 从而判断出色氨酸残基激发态动力学过程的类型。 另一方面, 在不同的温度下测量不同偏振方向的色氨酸残基荧光衰减曲线, 并通过拟合分析出相应的各向异性(anisotropy)参数, 如色氨酸残基的局部转动速率和分子的整体旋转扩散效应, 可得出蛋白质结构变化和热稳定性的关系。 结合DAS、 TRES以及各向异性这三种研究方法, 本文通过色氨酸残基的荧光性质全面地分析了葡萄球菌核酸酶蛋白质的各项特性。
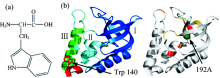 | 图1 色氨酸结构式(a)和SNase变体中色氨酸位点及I92A位点结构示意图(b)[7]Fig.1 Chemical structure of tryptophan (a) and presentations of tryptophan and I92A sites of SNase variant (adapted from Figure 1C and Figure 2 in reference 7) |
葡萄球菌核酸酶(staphylococcal nuclease, SNase)是一种小型球状蛋白, 共有149个氨基酸残基, 可通过可逆的结构折叠变为激活形式。 因此, SNase体系经常被用来研究蛋白质的折叠过程[6]。 研究者们通过突变SNase内部中心残基产生空穴的方式来改变其结构折叠的方式和稳定性, Δ +PHS就是一种高稳定(highly stable)的变体, 其结构中有10个空穴, 而空穴的形成有助于提升SNase结构的稳定性[7]。 在此基础上再对Δ +PHS的内部中心残基进行变异, 产生折叠结构更加紧密的变体, 如亚结构疏水螺旋中心部位的I92A等[7]。 其结构如图1(b)所示。 圆二色谱、 核磁共振(nuclear magnetic resonance, NMR)、 傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)、 小角度X射线散射(small-angle X-ray scattering, SAXS)、 模拟仿真等技术均运用在SNase及其变体的研究中[8]。 在SNase变体的140位存在色氨酸残基[见图1(b)], 对其稳态荧光的测量已作为辅助方法用在了SNase结构折叠的研究之中[7, 9]。 此外, 对SNase变体色氨酸残基超快时间分辨荧光动力学的研究揭示了SNase表面水合动力学过程[10]。 然而, 尚未有文献使用时间分辨荧光手段, 通过色氨酸残基的荧光动力学, 对SNase变体热稳定性及其结构折叠特性进行研究。
采用荧光频率上转换和TCSPC技术, 构建并分析了DAS、 TRES和各向异性三种光谱, 研究了两种SNase变体的微环境、 激发态弛豫和SNase体系内独立的局部运动过程, 从而得到了SNase两种变体Δ +PHS和Δ +PHS+I92A的荧光动力学特性、 结构特性以及热稳定性的相关结论。
SNase变体Δ +PHS和Δ +PHS+I92A的详细制备方法见文献[7]。 其中, 野生型葡萄球菌核酸酶和所有核酸酶碎片通过诱导质粒pL9生成。 通过改变基因序列可以构建出对应着不同核酸酶变体的pL9质粒。 而变体蛋白由导入相应pL9质粒的大肠杆菌菌株AR120产生。 之后通过离心、 悬浮、 萃取、 冻干的过程得到SNase变体蛋白粉末。
配制样品时, 在SNase变体蛋白的冻干粉末上加入pH 7.0的Tris缓冲液(Sigma, 美国), 轻轻晃动加速溶解, 得到0.25 mM的蛋白溶液。 之后将样品置于30 mm× 10mm× 1 mm的比色皿中以待测量。
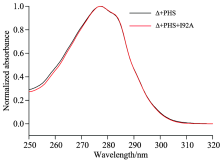
SNase变体的吸收谱是通过紫外-可见分光光度计(TU1901, 北京普析通用仪器有限公司)测量, 探测波长设为200~360 nm。 稳态荧光光谱由荧光分光光度计(FluoMax-4, Horiba, 美国)测量得出, 激发波长设为298 nm。
时间分辨荧光的测量是由自主搭建的TCSPC和荧光频率上转换平台完成的, 具体如文献所述[11]。 其中, 激发光源为半导体激光器(PDL800-B, PicoQuant, 德国), 中心波长在298 nm。 激发光通过透镜聚焦在样品上, 样品发射的荧光经过另一个透镜收集进入单色仪(7ISW151, 北京赛凡光电仪器有限公司)。 在选出特定的发射波长后, 荧光信号经由单光子探测器(PMA165A-N-M, PicoQuant, 德国)转化为电信号并输入至计数模块(PicoHarp300, PicoQuant, 德国)。 通过自主编写的数据采集软件记录单光子探测事件, 得到样品的荧光衰减曲线。 对于多探测波长荧光衰减曲线的测量, 探测光的偏振设为魔角(54.7° ), 波长范围是310~400 nm, 步长为5 nm。 由于实验系统的激发光为竖直偏振光, 探测荧光的各向异性时, 偏振方向分别选为竖直和水平, 探测波长设在340 nm。
荧光团对激发光的吸收过程小于10-15 s, 因此吸收光谱只能提供分子的平均基态信息[12]。 图2为两种SNase变体的吸收谱。 从图中看出两种SNase变体的吸收谱大致相同, 二者均有一个280 nm左右的吸收峰, 即为色氨酸残基的特征吸收峰。 由此我们选用吸收峰附近的298 nm作为色氨酸残基的激发波长。 此外, 两种变体的吸收谱特性不随温度的变化而改变。
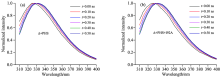
蛋白质中, 色氨酸残基的吲哚环对溶剂极性很敏感, 其发射光谱能够说明蛋白质中色氨酸残基的位置。 相较于内部包裹的色氨酸残基, 暴露在蛋白质表面的色氨酸残基有更长的发射峰值[12]。 图3为SNase变体随温度变化的稳态荧光光谱。 Δ +PHS SNase及其突变体I92A的发射峰值约为330 nm, 且不随温度的改变而移动。 从图中可以看出, 这两种SNase变体的色氨酸残基发射峰值均相对于其在水中350 nm处的本征发射峰[12]发生了蓝移。 这是因为Δ +PHS SNase及其突变体的Trp-140位于3号螺旋结构之中[如图1(b)所示], 色氨酸残基得到了保护, 极性溶剂效应对其影响有所减弱[12]。
SNase变体的荧光衰减曲线可以通过以下多指数模型描述
而在分析实验测得的时间分辨曲线时, 用上述多指数函数与IRF函数求卷积后再与测量数据比对, 通过初始值迭代, 拟合得到最佳的α i和τ i等参数。 拟合的效果通过
在构建DAS时, 需要对各个寿命进行固定关联, 全局拟合不同波长下的荧光衰减曲线, 并用稳态荧光光谱对拟合得到的结果归一化, 从而得到DAS光谱。
图4和图5是两种SNase变体的DAS。 Δ +PHS和其I92A变体均需用三个指数拟合, 这与两种蛋白质的结构有关[12]。 在中性环境水中, 色氨酸存在3.0和0.5 ns两个寿命[13], 而在SNase的两种变体中, 均存在着6和4 ns的较长寿命。 造成这一现象的原因很可能是SNase变体螺旋结构或者其折叠结构的疏水环境所致[7, 14]。
图4中, 随着温度的升高, Δ +PHS变体DAS图中各寿命成分的基本没有变化。 这说明了在288~303 K之间, Δ +PHS变体热稳定性较好[15], 蛋白的折叠路径较为单一, 因而动力学过程比较单一[8]。 而图5中Δ +PHS+I92A变体6.0 ns寿命成分的α 值随温度升高而降低, 4.0 ns的α 值随温度升高而上升, 0.2 ns则维持不变。 这是因为Δ +PHS+I92A变体的热稳定性较差, 且有多种不同的折叠路径[8], 其动力学过程十分复杂, 色氨酸残基荧光发射中的异质性作用较为明显。
图6为上转换实验平台测量出的SNase变体的超快时间分辨DAS。 图中展示了5 ps的超快寿命成分。 该成分的α 值在蓝端为正, 而在红端为负。 负值的存在是弛豫过程的重要标志[12]。 200 ps寿命成分的α 值在整个发射波长段内均为正, 这是因为色氨酸残基的吲哚环和周围的猝灭基团存在着电子转移的作用[16]。
TRES是在DAS光谱的基础上构建的, 展示了荧光分子被激光脉冲激发后一段离散时间内的发射谱变化趋势。 TRES可以用于分析激发态动力学过程。 连续光谱弛豫(CR)模型描述了荧光团的激发态弛豫动力学。 在分子受到激发之后, 溶剂在激发态偶极矩附近重新定向, 导致了溶剂的弛豫过程[12]。 如果溶剂弛豫时间比荧光寿命短, 那么荧光就从弛豫态发射。 而弛豫态能量比激发态能量低, 这就导致了一系列随离散时间红移的荧光发射光谱[12]。
构建TRES时需要测量荧光团不同波长下的荧光衰减曲线, 再通过下述的公式进行计算
其中F(λ )是稳态发射光谱, I(λ , t)是荧光衰减强度。 在多指数的函数模型中, 荧光强度可以替换为
于是, 计算TRES的公式为
这里α 'i(λ )=H(λ )α i(λ )[12]。
图7中两种SNase变体的TRES基本相同。 因为两种SNase变体的瞬态发射光谱形状未发生变化, 所以该衰减过程均可用CR模型进行描述。 该模型认为激发态弛豫是一个连续发光的过程, 并且激发态衰减速率与弛豫态相同[12]。
在图7中, 只有0~0.5 ns能够得出可分辨的TRES曲线。 由此我们可以看出两种SNase变体都存在弛豫过程, 其大小约为0.5 ns。 而Δ +PHS+I92A在激发的最初时间里红移得更多, 造成此现象的原因是由于其色氨酸残基周围水环境的极性较大[12], 从而其弛豫能量较大。 由此可以得出Δ +PHS+I92A变体的蛋白质折叠结构对色氨酸具有更大的保护作用, 这是因为I92A变体内部有更多的疏水腔, 使得折叠结构变得更加紧密[6]。
当荧光分子被偏振光激发时, 其发射光也具有偏振性。 荧光发射的偏振程度可用各向异性来描述。 荧光团的各向异性衰减相关时间反映了其围绕不同分子轴的旋转速率[12]。 蛋白质色氨酸残基的各向异性衰减通常可以分析出一个很短的相关时间, 这个值远小于蛋白整体的旋转扩散时间。 这个相关时间一般是由蛋白质表面或内部色氨酸残基的独立运动造成的[12]。 因此, 色氨酸残基的各向异性衰减速率被用来研究蛋白质的纳秒级动力学过程。
通过测量不同偏振的荧光衰减曲线, 可以分析得出蛋白质各向异性相关的参数。 设衰减光谱中与激发光偏振平行的分量为I∥(t)而与其垂直的分量为I⊥(t), r(t)为各向异性, 则有如下关系式:
通常, r(t)可用多指数衰减来拟合
其中,
| 表1 Δ +PHS SNase的各向异性衰减拟合参数 Table 1 Fitting parameters of anisotropy decays of SNase variant Δ +PHS |
| 表2 Δ +PHS+I92A SNase的各向异性衰减拟合参数 Table 2 Fitting parameters of anisotropy decays of SNase variant Δ +PHS+I92A |
转动相关时间θ 1表明了蛋白质色氨酸残基的局部运动过程, 而转动相关时间θ 2则对蛋白整体旋转扩散过程进行了描述[12]。 对于Δ +PHS变体来说, 其折叠结构的热稳定性很高, 而随着温度升高, 蛋白质热运动速度变快, 因此θ 2的值减小。 而对于Δ +PHS+I92A变体则不同, 由于折叠结构的热稳定性较低, 蛋白结构会随着温度升高而变得松散, 整体旋转扩散的速率减慢, 抵消了因为热运动而产生的快速运动过程, 因此θ 2的值基本维持不变。 由于色氨酸残基的局部运动造成了超快寿命θ 1。 然而因其拟合数值远小于系统分辨率, 故采用< 0.10 ns表示。 同样地, 由于热稳定性差, Δ +PHS+I92A变体的色氨酸残基在大于298 K时局部运动减慢, θ 1明显增大。 此外, 可以看出衰减相关时间所占比重g01随温度升高而降低, 这是色氨酸残基的局部运动随温度升高而减弱引起的。
采用皮秒以及飞秒时间分辨荧光光谱技术, 主要分析了在不同温度下两种SNase蛋白变体Δ +PHS和Δ +PHS+I92A的荧光动力学过程, 以及SNase变体结构的折叠变化与热稳定性的关系。 通过稳态荧光光谱表明了色氨酸残基受到SNase螺旋结构的保护。 两种变体的荧光衰减曲线可以进行三指数拟合, 详细地分析了色氨酸残基的微环境效应和猝灭现象。 与此同时, 通过SNase变体DAS随温度变化的不同趋势, 对两种变体的结构折叠及热稳定性进行了探讨。 上转换的分析结果则说明了色氨酸残基与周围猝灭基团的电子转移作用。 SNase变体色氨酸残基激发态连续光谱弛豫过程, 印证了SNase变体的折叠结构紧密程度不同。 此外, 本文还通过两种SNase变体荧光各向异性参数, 对色氨酸残基和整个SNase变体蛋白的结构特性进行了分析。 通过研究色氨酸残基在体系内独立的局部运动, 得到了两种SNase变体的热稳定性差异。
致谢: 感谢CBS(Centre de Biochimie Structurale, France)提供制备SNase变体所需的质粒和相关技术支持。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|