作者简介: 孙通, 1983年生, 江西农业大学副教授 e-mail: suntong980@163.com
利用共线双脉冲激光诱导击穿光谱 (LIBS)对溶液中的乐果含量进行定量检测。 采用圆柱形桐木木片对农药乐果进行富集, 然后利用双通道高精度光谱仪获取样本在206.28~481.77 nm波段范围的LIBS光谱。 选用4条磷元素谱线(P Ⅰ 213.618 nm, P Ⅰ 214.91 nm, P Ⅰ 253.56 nm, P Ⅰ 255.325 nm)为分析线, 碳元素谱线(C Ⅰ 247.856 nm)为内标线, 应用单变量线性拟合及最小二乘支持向量机(LSSVM)方法分别建立溶液中乐果含量的单变量定标模型、 LSSVM定标模型及基于内标法的LSSVM定标模型, 并进行比较。 三个定标模型中, 基于内标法的LSSVM定标模型性能最优, LSSVM定标模型性能次之, 而单变量定标模型性能最差。 结果表明, 共线双脉冲LIBS技术结合LSSVM及内标法可以用于溶液中的乐果含量定量检测, 所建立的定标模型的决定系数为0.999 7, 训练集和验证集的平均相对误差分别为11.24%及12.01%。 LSSVM方法及内标法均能在一定程度上改善定标模型的性能, 提高预测精度。
In this research, collineardouble pulselaser induced breakdown spectroscopy (LIBS) was used to detect dimethoate content in solutionquantificationally. Fortune paulownia wood chip with cylinder shape was used to enrichmentdimethoate, and the spectra of samples were acquired with a two-channel high precision spectrometer in the wavelength range of 206.28~481.77 nm. Four spectral linesof phosphorus (213.618, 214.91, 253.56, 255.325 nm) were selected as analytical lines, and carbonspectral line (247.856 nm) was used as internal standard line. Then, univariatelinear fitting and least squares support vector machine (LSSVM) were used to develop univariate calibration model, LSSVM calibration model and LSSVM calibration model based on internal standard method, and the performance of threecalibration models were compared. The results indicate that collinear double pulse LIBS combined with LSSVM and internal standard method is feasible for detecting dimethoate content in solution quantificationally. The coefficient of determination (R2) of LSSVM calibration model based on internal standard method is 0.999 7, and the average relative errors in training set and validation set are 11.24% and 12.01%, respectively. In the three calibration models, LSSVM calibration model based on internal standard method has the best performance, and the performance of LSSVM calibration model is the second, while univariatecalibration model hasthe worstperformance. So it can be concluded that LSSVM and internal standard method can improve the performance of calibration model to some extent, and improve the prediction accuracy.
引 言
乐果农药为中等毒有机磷杀虫剂, 主要用于防治油料作物、 粮食、 蔬菜及果树的刺吸口器及咀嚼口器的害虫和叶螨。 由于乐果农药的广泛和大量使用, 导致油料制品食用植物油、 粮食及果蔬中会含有乐果农药残留, 甚至残留含量超标, 严重危害人们的身体健康。 因此, 非常有必要对乐果农药残留含量进行快速检测研究。
激光诱导击穿光谱 (LIBS)是一种新颖的现代光谱分析技术, 具有快速、 绿色及原位检测等优点, 已应用于生物医药[1]、 矿业[2]、 冶金[3]、 航天及海洋探测[4, 5]、 文物鉴定[6]、 土壤污染[7]、 食品[8]等领域的元素检测分析。 对于农药残留LIBS检测, 国内外相关研究甚少。 Kim等[9]将硫磷和乙磷铝农药溶液喷洒于样品表面, 然后根据LIBS元素谱线分布对菠菜和大米中有无农药残留进行检测。 结果表明, 菠菜的分类正确率98%以上。 Multari等[10]利用LIBS 技术对组织脂肪和植物油中的三种农药(艾氏剂、 毒死蜱、 狄氏剂)进行种类和浓度分类研究。 通过建立多个分类模型先对污染物种类进行分类, 再对污染物浓度进行分类, 结果均较好。 Dong等[11, 12]将480 g· L-1的毒死蜱溶液按不同比例进行稀释, 然后喷洒于苹果表面, 再根据毒死蜱农药磷或氯元素的LIBS谱线对不同浓度农药残留的苹果进行分类, 并建立定标曲线。 结果表明, 喷洒稀释100倍与1 000倍毒死蜱溶液的苹果样品未能很好分类, 其余分类结果均较好。 在稀释80~130倍条件下, 其定标曲线的R2为0.88~0.95。 总结上述文献发现, 农药残留的LIBS检测研究处于起步阶段, 大多为定性检测。
利用共线双脉冲LIBS技术对溶液中的乐果含量进行定量检测。 选用4条磷元素谱线为分析线, 碳元素谱线为内标线, 应用单变量线性拟合及最小二乘支持向量机(LSSVM)方法分别建立溶液中乐果含量的单变量定标模型、 LSSVM定标模型及基于内标法的LSSVM定标模型(下文均简称: 内标法LSSVM定标模型), 并对定标模型性能进行比较。
试验用乐果农药含量为400 g· L-1, 由江苏腾龙生物药业有限公司生产。 甲苯为分析纯, 购自上海润捷化学试剂有限公司。 圆柱形桐木木片直径为2 cm, 厚度为4 mm, 定制于曹县黑森木业有限公司。
将乐果农药按不同比例(1∶ 10, 1∶ 50, 1∶ 100, 1∶ 500, 1∶ 1 000)溶入甲苯, 获得溶液的乐果含量分别为40, 8, 4, 0.8及0.4 g· L-1。 由于LIBS直接检测液体会引起液体飞溅及液面扰动等, 会降低LIBS稳定性及检测精度。 故将桐木木片浸泡于上述溶液吸附乐果农药, 再在烘箱内烘干后用于LIBS检测。
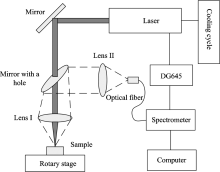
LIBS装置如图1所示。 光谱仪为定制的双通道高精度光谱仪(Avantes公司, 荷兰), 其双通道的波长范围分别为206.28~331.41和321.46~481.77 nm, 探测器为2 048像素线阵CCD。 激光器为Vlite-200型双脉冲固体激光器(镭宝光电技术有限公司, 北京), 输出波长为1 064 nm, 激光最大能量为300 mJ, 脉冲宽度为6~8 ns, 重复频率为1~15 Hz。 数字脉冲延时发生器型号为DG645 (Stanford Research Systems, 美国)。 二维旋转平台为SC300-1A型二维精密旋转仪 (卓立汉光仪器有限公司, 北京)。
采集LIBS光谱时, 将桐木木片放置于二维旋转平台上, 双脉冲固体激光器的两束激光经45° 反射镜、 穿孔反射镜, 然后再由透镜Ⅰ 依次汇聚于桐木木片表面; 激光与木片表面作用产生高温等离子体; 等离子体信号经透镜Ⅰ 汇聚, 然后由穿孔反射镜反射, 再由透镜Ⅱ 汇聚进入光纤探头, 最后被高精度光谱仪捕获, 得到LIBS光谱。 光谱采集由Avaspec 7.8软件 (Avantes公司, 荷兰)操作完成, 其光谱采集参数采用单变量优先法并根据P元素信号强度进行优化, 优化后参数设置如下: 第一及第二束激光能量分别为137和178 mJ, 两束激光之间延时为60 ns, 光谱采集延时为1.38 μ s, 积分时间为2 ms。 光谱采集时, 每5次平均1幅图, 1次采集10幅图, 即每条光谱为50个打击点的平均结果。 对于每一个浓度梯度的样本, 均重复采集3次光谱, 即每个乐果浓度的样本均有3条LIBS光谱, 因此共有15条LIBS光谱用于后续的分析。
最小二乘支持向量机是一种遵循结构风险最小化原则的核函数学习机器, 是支持向量机算法的改进, 能较好地解决小样本、 高维数、 非线性及局部极小点等问题。 该方法的基本原理[13]如下:
对于训练集样本(x1, y1), (x2, y2)…(xn, yn), 其中xi为输入向量, yi为目标值。 采用非线性映射φ (· )将样本的原始空间映射到高维空间
然后, 在高维空间构造最优决策函数
最后, 根据结构风险最小化原则确定决策函数的模型参数w和b。 结构风险的计算式为
其中, c为正规化参数;
本研究中, 以碳元素谱线为内标对磷元素谱线强度进行修正, 然后应用LSSVM方法建立乐果含量的定标模型。 在LSSVM分析中, 核函数为径向基函数, 最优参数通过“ simplex” 方法和留一交叉验证获取。
对于每个不同乐果浓度样本的3条LIBS光谱, 随机选取2条LIBS光谱作为训练集, 剩余1条LIBS光谱作为验证集。 训练集(10条LIBS光谱)用于建立单变量及LSSVM定标模型, 验证集(5条LIBS光谱)用于验证定标模型的性能。
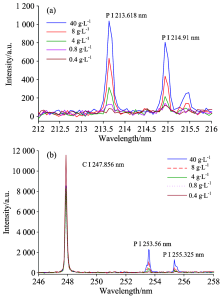
图2为5个乐果浓度的样本在212~216及246~258nm波段范围的LIBS光谱。 由图2及根据美国NIST数据库相关资料可知, 磷元素的主要谱线分别为P Ⅰ 213.618 nm, P Ⅰ 214.91 nm, P Ⅰ 253.56 nm及P Ⅰ 255.325 nm, 碳元素谱线为C Ⅰ 247.856 nm。 由图2可知, 4条P元素的谱线强度均随着乐果浓度下降而减少, 两者之间存在正相关性; 而C元素的谱线强度则变化不大, 且没有规律。 此外, 4条P元素谱线中, P Ⅰ 253.56 nm谱线的强度最大。
由于P Ⅰ 253.56 nm的谱线强度最大, 故选取该谱线建立乐果含量的单变量定标模型。 在训练集中, 将253.56 nm谱线强度与乐果含量进行线性拟合, 结果见图3。 由图3可知, 定标曲线方程为y=45.126x+351.49, 决定系数R2为0.894 7, 数据点相对于拟合曲线有较大的偏离, 表明拟合结果不理想。 采用该定标曲线模型对验证集数据进行预测, 结果见表1。 由表1可知, 1号及3号的预测结果较好, 其绝对误差和相对误差分别为-1.58 g· L-1, 3.95%和0.11 g· L-1, 2.82%; 但2号、 4号及5号的预测结果很不理想, 相对误差均大于100%。 由此表明, 单变量定标模型效果差。 究其原因, 可能由两方面因素造成, 一是P谱线强度与乐果浓度虽然存在正相关关系, 但不完全是线性关系; 二是单个P谱线所包含的信息量少。
| 表1 单变量定标模型对验证集的乐果含量预测结果 Table 1 Predicted results of dimethoate content in validation set by univariate calibration model |
LSSVM方法可以较好解决小样本及非线性问题。 针对单变量定标模型的缺陷, 以4条P元素谱线 (P Ⅰ 213.618 nm, P Ⅰ 214.91 nm, P Ⅰ 253.56 nm, P Ⅰ 255.325 nm)作为LSSVM的输入, 乐果含量作为输出, 采用训练集建立LSSVM定标模型。 图4为LSSVM定标模型对训练集的乐果含量预测结果。 由图4可知, LSSVM定标模型的决定系数R2为0.9983, 训练集的乐果相对误差范围为0.08%~65.70%, 平均相对误差为25.41%。 表2为LSSVM定标模型对验证集的乐果含量预测结果。 由表2可知, 验证集的相对误差范围为7.15%~40.00%, 平均相对误差为24.68%。 乐果含量较高, 其相对误差较小, 而乐果含量较低, 则相对误差较大。 对比表1及表2可知, LSSVM定标模型性能要优于单变量定标模型, 特别是低含量乐果的预测相对误差有较大的改善。 由此说明, LSSVM能充分利用光谱信息及解决非线性问题, 有效提高定标模型的预测精度。
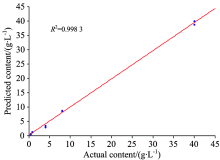 | 图4 LSSVM定标模型对训练集的乐果含量预测结果Fig.4 Predicted results of dimethoate content in training set by LSSVM calibration model |
| 表2 LSSVM定标模型对验证集的乐果含量预测结果 Table 2 Predicted results of dimethoate content in validation set by LSSVM calibration model |
在LIBS检测过程中, 由于受激光能量波动及环境因素变化等影响, 同一样品的多次测量结果会存在一定的差异。 内标法以分析谱线与内标线的比值作为输入, 能在一定程度上消除上述因素带来的测量误差, 提高LIBS方法的检测精度[14]。 根据内标元素含量基本不变、 谱线清晰易辨识且与分析谱线邻近为原则, 选取C Ⅰ 247.856 nm为内标元素。 采用内标法对4条P谱线强度进行校正, 以P谱线强度与C Ⅰ 247.856 nm谱线强度比值作为LSSVM模型的输入, 并采用训练集建立LSSVM定标模型。
图5为内标法LSSVM定标模型对训练集的乐果含量预测结果。 由图5可知, 乐果真实含量与其预测含量之间的拟合度较好, 定标模型的决定系数为0.999 7。 乐果含量的相对误差范围为0.08%~38.11%, 平均相对误差为11.24%。 表3为内标法LSSVM定标模型对验证集的乐果含量预测结果。 由表3可知, 验证集的相对误差范围为1.03%~25.00%, 平均相对误差为12.01%。 1~3号的乐果含量较高, 其相对误差较小, 均在10%以下; 4及5号的乐果含量低, 其相对误差有所增大, 分别为21.25%和25.00%。 对比表2及表3结果可知, P元素谱线经内标法校正后, 建立的LSSVM定标模型性能得到较大改善, 训练集和验证集的平均相对误差分别由25.41%, 24.68%下降为11.24%, 12.01%。 由此说明, 内标法可以较好地消除激光能量波动及环境因素变化等影响, 提高模型的预测精度。
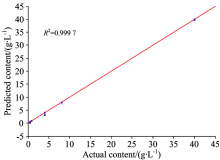 | 图5 内标法LSSVM定标模型对训练集的乐果含量预测结果Fig.5 Predicted results of dimethoate content in training set by LSSVM calibration model based on internal standard method |
| 表3 内标法LSSVM定标模型对验证集的乐果含量预测结果 Table 3 Predicted results of dimethoate content in validation set by LSSVM calibration model based on internal standard method |
利用共线双脉冲LIBS技术对溶液中的乐果含量进行定量检测, 采用内标法对P元素谱线进行校正, 并应用单变量线性拟合及LSSVM方法分别建立乐果含量的定标模型。 结果表明, 共线双脉冲LIBS技术结合LSSVM及内标法可以用于溶液中的乐果含量检测, 内标法LSSVM定标模型的决定系数为0.999 7, 训练集和验证集的平均相对误差分别为11.24%及12.01%。 内标法LSSVM定标模型性能优于LSSVM定标模型, 而LSSVM定标模型性能优于单变量定标模型。 由此表明, LSSVM方法及内标法均能在一定程度上改善定标模型的性能, 提高预测精度。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|