作者简介: 张贤杰, 1990年生, 昆明理工大学冶金与能源工程学院硕士研究生 e-mail: 564194628@qq.com
利用电喷雾质谱(ESI-MS)和紫外-可见吸收光谱(UV-Vis)分析, 研究了CrCl3·6H2O 浓度为0.1~0.6 mol·L-1的水溶液和[1ChCl∶2EG]/CrCl3·6H2O ILs中, Cr(Ⅲ)配合物的存在形式。 研究结果表明, 在含有CrCl3·6H2O的溶液中, Cr(Ⅲ)与Cl-和H2O形成[Cr(H2O)nCl6- n] n-3配合物, 其配合物的优势物种受CrCl3·6H2O浓度的影响。 水溶液中Cr(Ⅲ) 的优势配合物为[Cr(H2O)6]3+与[Cr(H2O)5Cl]2+, 并随CrCl3·6H2O浓度增加, 水溶液的UV-Vis吸收光谱峰红移, [Cr(H2O)5Cl]2+的相对含量增加。 而[1ChCl∶2EG]/CrCl3·6H2O ILs中的优势配合物为[Cr(H2O)2Cl4]-和[Cr(H2O)3Cl3], 且随CrCl3·6H2O 浓度增加, 溶液的颜色从浅橙红色逐渐变为深绿色, 溶液的UV-Vis吸收光谱峰蓝移, [Cr(H2O)3Cl3]的相对量增加。 说明CrCl3·6H2O的浓度变化, 将影响配体Cl-和H2O与Cr(Ⅲ)配位结合的配位数, 从而影响配合物优势物种的相对量。
The existing forms of Cr(Ⅲ) complexes in aqueous solution and [1ChCl∶2EG]/CrCl3·6H2O ILs containing 0.1~0.6 mol·L-1 CrCl3·6H2O, respectively, were investigated by using ESI-MS and UV-Vis absorption spectra. The results showed that Cr(Ⅲ) combined with Cl- and H2O to form [Cr(H2O)nCl6- n]n-3 in both cases, and the dominant species of which were affected by the concentration of CrCl3·6H2O. Concretely, the dominant complexes of Cr(Ⅲ) in aqueous solution are [Cr(H2O)6]3+ and [Cr(H2O)5Cl]2+, and the UV-Vis absorption spectra is observed to redshift with an increase in the concentration of CrCl3·6H2O, along with enhancement in the mole fraction of [Cr(H2O)5Cl]2+. By contrast, the dominant species of Cr(Ⅲ) in [1ChCl∶2EG]/CrCl3·6H2O ILs are [Cr(H2O)2Cl4]- and [Cr(H2O)3Cl3]. Increasing the concentration of CrCl3·6H2O results in gradual color change of the solution from light orange-red to dark green, blue shift of the UV-Vis absorption spectra, and higher mole fraction of [Cr(H2O)3Cl3]. Both the coordination number of Cl- and H2O that complexes with Cr(Ⅲ) as well as the relative content of the dominant complexes of Cr(Ⅲ) in solvent is proved to be influenced by variation in the concentration of CrCl3·6H2O.
引 言
铬的镀层因具有优良的耐蚀性、 耐磨性、 显微硬度和漂亮的外观, 广泛应用于汽车、 航天、 电子、 家居等行业作为功能材料、 防腐材料和装饰材料[1]。 传统的水溶液电镀铬是以六价铬为原料, 因溶液的毒性大、 对环境污染严重、 电镀过程中伴随着析氢, 显著降低电流效率(约为20%), 现已被多数国家所禁止, 并转而采用低毒性的三价铬水溶液电镀。 然而三价铬水溶液电镀体系的稳定性低、 成分复杂, 电镀过程中同样存在析氢现象, 使得电镀时的电流效率一般低于40%, 而且其镀层硬度较低, 难以达到功能性镀铬的要求[2]。 室温离子液体[3](ambient-temperature ionic liquids, ILs)种类繁多, 一般熔点低、 挥发性低、 可燃性低、 热稳定性较高、 电化学窗口较宽, 是一类发展和应用前景广阔的新型溶剂。 低共熔溶剂(deep eutectic solvents, DESs)型离子液体, 其性质与室温离子液体极为相似, 而且合成简单、 原料低毒或无毒, 在有机合成、 材料制备、 电化学、 萃取分离、 催化剂等领域的研究和应用快速增长[3]。 在ILs中不仅可电沉积出大部分水溶液中可电沉积的金属, 如Cu, Zn, Ni和Ag等; 也可电沉积出多种在水溶液中无法得到的活泼金属及其合金, 如Al, Ti和Al-Zn等, 且无析氢等副反应, 显著提高了电流效率并降低能耗[3, 4], 为环保型三价铬电镀体系的选取和优化提供了新的途径。 Abbott等采用含有Cr(Ⅲ )的ChCl/CrCl3· 6H2O和urea/CrCl3· 6H2O ILs为电解质(CHCl为氯化胆碱), 在几种基体材料上电沉积出27~30 μ m厚, 耐蚀性、 结合力和显微硬度较好的黑铬镀层, 电流效率高达96%[4, 5]。 此后, 利用[Bmim]BF4/CrCl3· 6H2O[6], [1ChCl∶ 3EG]/CrCl3· 6H2O[7], [BMIm]HSO4/CrC
氯化胆碱[HOC2H4N(CH3)3Cl, ChCl], AR, 国药化学试剂公司; 乙二醇(HOC2H4OH, EG), AR, 西陇化工股份有限公司; 氯化铬(CrCl3· 6H2O), AR, 天津风船化学试剂科技有限公司。 恒温磁力加热搅拌器RET basic(德国IKA公司); 真空干燥箱DZF-6090(上海精宏实验设备有限公司); 紫外-可见(UV-Vis)分光度计UV-1601(日本岛津公司); microTOF-Q11电喷雾质谱仪(德国Bruker公司)。
配制低共熔溶剂型离子液体前先将原料ChCl置于80 ℃真空干燥箱中干燥24 h, 而后将摩尔比1∶ 2的ChCl和EG在锥形瓶中混合, 于80 ℃油浴中恒温磁力搅拌至成为无色清亮液体即为1ChCl∶ 2EG IL; 称取一定质量的CrCl3· 6H2O加入到已配制好的1ChCl∶ 2EG IL中, 于80 ℃下恒温磁力搅拌使其充分溶解, 即可得到含有一定Cr(Ⅲ )浓度的[1ChCl∶ 2EG]/CrCl3· 6H2O ILs。
采用紫外-可见分光光度计分别测定含0.1~0.6 mol· L-1 CrCl3· 6H2O的CrCl3· 6H2O水溶液和[1ChCl∶ 2EG]/CrCl3· 6H2O ILs的紫外-可见吸收光谱, 扫描波长范围: 250~800 nm, 灵敏度: 600 nm· min-1, 石英玻璃比色皿: 宽10 mm× 厚1 mm。 采用电喷雾质谱仪(electrospray mass spectrometer, ESI-MS)对[1ChCl∶ 2EG]/CrCl3· 6H2O IL进行质谱分析, 离子源种类: ESI源(双重离子漏斗型电喷雾离子源), 离子源温度: 180 ℃, 干燥气流速: 4.0 mol· L-1, 喷雾器气压: 0.4 Bar, 正离子模式和负离子模式扫描。
298 K时, 含有0.1~0.6 mol· L-1CrCl3· 6H2O的[1ChCl∶ 2EG]/CrCl3· 6H2O ILs的颜色如图1(b)— (g)所示, 可见随所含CrCl3· 6H2O浓度的增加, 溶液的颜色逐渐从浅橙红色→ 黄绿色→ 褐绿色→ 深绿色。 若在1ChCl∶ 2EG IL中加入无水CrCl3, 或者同时加入无水CrCl3和相当于六个结晶水质量的水, 却难以使CrCl3溶解制得相应的溶液。
Cr(Ⅲ )的价层电子结构为3d34s04p0, 可利用两个空的d轨道(
 | 图2 Cr(Ⅲ )的d2sp3杂化轨道及其六配位的八面体配合物结构Fig.2 d2sp3 hybrid orbitals of the Cr(Ⅲ ) and the octahedral geometry of six-coordinate coordination complexes |
固体CrCl3· 6H2O化合物的主要存在形式为[Cr(H2O)4Cl2]Cl· 2H2O{其中的Cr(Ⅲ )以二氯四水合铬[Cr(H2O)4Cl2]+配离子形式存在}[11]。 CrCl3· 6H2O水溶液中, Cr(Ⅲ )的存在形态比较复杂, 它可与Cl-和H2O形成多种配合物(配离子), 如[Cr(H2O)6]3+, [Cr(H2O)5Cl]2+, [Cr(H2O)4Cl2]+, [Cr(H2O)3Cl3]等[12], 它们之间存在动态平衡[如式(1)], 其优势配合物受溶液环境的影响。
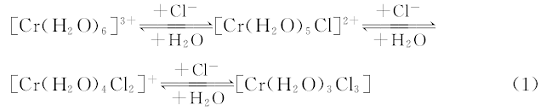
而Cr(Ⅲ )的各种配合物(物种)所占的摩尔分数见式(2)[10]。
式(2)中{[Cr(H2O)nCl6-n]n-3}为溶液中Cr(Ⅲ )的某种配合物的浓度, mol· L-1; [Cr(Ⅲ )]T是溶液中Cr(Ⅲ )的总浓度, mol· L-1; Ф n为溶液中含Cr(Ⅲ )的某种配合物浓度占Cr(Ⅲ )总浓度的摩尔分数。 由于缺乏配合物的生成稳定常数, 暂不进行具体计算。
新配制的CrCl3· 6H2O水溶液为深绿色, 而放置大约1 h后, 溶液颜色逐渐变浅[13], 溶液的UV-Vis吸收光谱峰蓝移, 其中占优势的配合物由[Cr(H2O)4Cl2]+逐渐转变为[Cr(H2O)5Cl]2+和[Cr(H2O)6]3+, 而后者是溶液最终达平衡时主要的Cr(Ⅲ )物种, 不过溶液的酸度增加将明显减慢这种平衡移动的速度[11]。 Elving等[12]也通过UV-Vis吸收光谱对CrCl3· 6H2O的酸性水溶液进行研究表明, 在中性或含酸浓度不高的水溶液中, [Cr(H2O)5Cl]2+和[Cr(H2O)4Cl2]+是优势物种, 而[Cr(H2O)3Cl3]只有在12 mol· L-1 HCl溶液中才被观察到。
而图1的[1ChCl∶ 2EG]/CrCl3· 6H2O ILs中, 随CrCl3· 6H2O浓度变化, 可能会改变Cr(Ⅲ )的各种配合物所占的摩尔分数, 而溶液的颜色更多地呈现优势物种的颜色。
将含有0.3 mol· L-1 CrCl3· 6H2O的[1ChCl∶ 2EG]/CrCl3· 6H2O IL进行ESI-MS分析测试, 结果如图3所示, 将图3的分析结果列于表1进行对比。
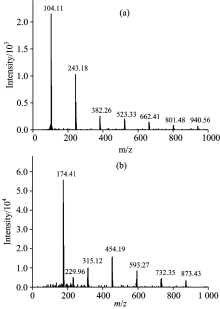 | 图3 [1ChCl∶ 2EG]/0.3 mol· L-1CrCl3· 6H2O IL的ESI-MS谱图 (a): 正离子模式; (b): 负离子模式Fig.3 ESI-MS graphs of [1ChCl∶ 2EG]/0.3 mol· L-1CrCl3· 6H2O IL (a): Positive mode; (b): Negative mode |
正离子模式扫描时[见图3(a)], 最强峰为胆碱阳离子Ch+, 其余的质谱峰为Ch+与Cl-结合形成的离子对[(Ch+)n+1· (Cl-)n]+(n≥ 1), 未见[Cr(H2O)4Cl2]+(m/z=195), [Cr(H2O)5Cl]2+(m/z=88.7)和[Cr(H2O)6]3+(m/z=53)三种Cr(Ⅲ )配阳离子的明显质谱峰。 负离子模式扫描时[见图3(b)], 也主要呈现Ch+与Cl-结合形成的离子对[(Ch+)n· (Cl-)n+1]-(n≥ 1), 但m/z=229.96处有一个强度较弱的质谱峰, 应为[Cr(H2O)2Cl4]-配阴离子。 从图3的ESI-MS分析结果中也未发现Cl-与EG, Cr(Ⅲ )与EG或Ch+分别形成其他缔合离子的质谱峰, 这与Abbot[4, 5]和McCalmant[14]的研究结果相似。 由于[Cr(H2O)3Cl3]呈电中性, 采用质谱分析是不能被检测到的, 但仍不能忽略它可能作为Cr(Ⅲ )配合物的主要物种之一而存在。
| 表1 [1ChCl∶ 2EG]/0.3 mol· L-1CrCl3· 6H2O IL中主要的离子物种 Table 1 The main ionic species in [1ChCl∶ 2EG]/0.3 mol· L-1 CrCl3· 6H2O IL |
分别对含有0.1~0.6 mol· L-1 CrCl3· 6H2O的水溶液和[1ChCl∶ 2EG]/CrCl3· 6H2O ILs进行UV-Vis光谱分析, 结果见图4所示。
 | 图4 UV-Vis吸收光谱 (a): CrCl3· 6H2O水溶液; (b): [1ChCl∶ 2EG]/CrCl3· 6H2O ILsFig.4 UV-Vis absorption spectra (a): Concentrations of CrCl3· 6H2O in aqueous; (b): [1ChCl∶ 2EG]/CrCl3· 6H2O ILs |
从图4可见, 在可见光区域内, 两种溶液都出现了两个强且宽的复合吸收带Ⅰ (4A2g→ 4T1g), Ⅱ (4A2g→ 4T2g)和一个较小的肩峰Ⅲ (约714 nm), 而且随溶液中CrCl3· 6H2O浓度变化, 吸收峰的波长发生小幅移动, 说明CrCl3· 6H2O浓度变化, 会在一定程度上改变[Cr(H2O)nCl6-n]n-3配合物中配体H2O和Cl-的数量之比, 从而改变Cr(Ⅲ )离子d— d跃迁所需的能量, 导致溶液的UV-Vis吸收光谱峰波长发生移动[10]。
根据配位化合物的“ 平均环境规则” , 采用单一配体H2O和Cl-分别形成的配合物[Cr(H2O)6]3+和[CrCl6]3-的晶体场分裂能Δ 值, 通过线性内插法计算得到相应的混合配合物[Cr(H2O)nCl6-n]n-3的Δ 值, 而Δ 值对应于该配合物UV-Vis吸收光谱线的较低能量的吸收峰[10]。 当与Cr(Ⅲ )配位的Cl-数量增加1个或H2O减少1个, 该配合物的UV-Vis吸收光谱峰波长较短的吸收峰发生红移约25 nm, 而波长较长的吸收峰则红移约30 nm[12]。 将Cr(Ⅲ ) 的各种配合物及其所对应的UV-Vis吸收光谱峰波长列于表2[13]中, 通过对比即可说明本实验中不同浓度的CrCl3· 6H2O水溶液中, Cr(Ⅲ )配合物的优势物种, 同样也可以说明[1ChCl∶ 2EG]/CrCl3· 6H2O ILs中, Cr(Ⅲ )配合物的优势物种。
| 表2 混合配合物[Cr(H2O)nCl6-n]n-3的 UV-Vis吸收光谱峰波长 Table 2 The wave length of the UV-Vis Spectrum bands of the complexes [Cr(H2O)nCl6-n]n-3 |
从图4(a)的UV-Vis吸收光谱线来看, 每种溶液中都存在不止一种配合物的物种, 所得到的UV-Vis吸收光谱线是各物种对UV-Vis光吸收程度叠加的结果。 将图4(a)的UV-Vis吸收光谱峰波长列于表3中, 与表2进行对比可以看出, CrCl3· 6H2O水溶液中的优势物种是[Cr(H2O)6]3+和[Cr(H2O)5Cl]2+, 水溶液中随CrCl3· 6H2O浓度从0.1 mol· L-1增加至0.6 mol· L-1, UV-Vis吸收光谱的峰Ⅰ 从412 nm→ 427 nm, 峰Ⅱ 从581 nm→ 604 nm, 分别红移了15 nm和23 nm。 水溶液中CrCl3· 6H2O浓度的增加, 导致Cl-浓度则从0.3 mol· L-1增加至1.8 mol· L-1, 增加至6倍, 而溶剂水是本体, 其浓度变化很小, 使得Cr(Ⅲ )混合配合物中的配体H2O部分被Cl-取代, 发生式(3)的平衡向右移动, 即配体的配位场强度顺序为Cl-< H2O[10], 与Cr(Ⅲ )配位的Cl-配位数增加, 将导致Cr(Ⅲ )离子的d轨道分裂能减小, d— d跃迁引起的UV-Vis吸收光谱峰发生红移。 说明随CrCl3· 6H2O浓度增加, 水溶液中[Cr(H2O)5Cl]2+配合物所占的摩尔分数增加, 而[Cr(H2O)6]3+的摩尔分数相应减小。 故0.1~0.6 mol· L-1CrCl3· 6H2O水溶液中, [Cr(H2O)6]3+和[Cr(H2O)5Cl]2+共存, 但CrCl3· 6H2O浓度较小(越接近0.1 mol· L-1或更小)时, 以[Cr(H2O)6]3+为主; 而当CrCl3· 6H2O浓度较大(越接近0.6 mol· L-1或更大)时, 则以[Cr(H2O)5Cl]2+为主。
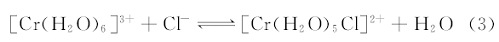
| 表3 不同浓度的CrCl3· 6H2O水溶液和[1ChCl∶ 2EG]/CrCl3· 6H2O ILs的UV-Vis吸收峰波长及其对应的Cr(Ⅲ )配离子 Table 3 The wave length of the UV-Vis absorption peak and the main Cr(Ⅲ ) complexes in aqueous solution and [1ChCl∶ 2EG]/CrCl3· 6H2O ILs which contain different Cr Cl3· 6H2O concentrations |
图4(b)的UV-Vis吸收光谱带也是各物种对UV-Vis光吸收程度的叠加的结果, 将图4(b)的UV-Vis吸收光谱峰波长列于表3中, 对比分析可知, CrCl3· 6H2O浓度在0.1~0.6 mol· L-1的[1ChCl∶ 2EG]/CrCl3· 6H2O ILs中, Cr(Ⅲ )配合物的优势物种为[Cr(H2O)2Cl4]-和[Cr(H2O)3Cl3]。 但随CrCl3· 6H2O浓度从0.1 mol· L-1增加至0.6 mol· L-1, 该溶液的UV-Vis吸收光谱的峰Ⅰ 从485 nm→ 473 nm, 峰Ⅱ 从679 nm→ 666 nm, 分别蓝移了12 nm和13 nm。
本研究测定了25 ℃时1ChCl∶ 2EG IL的密度为1.278 3 g· mL-1, 计算可知其中的Cl-浓度为4.74 mol· L-1, 而水的浓度接近0。 当CrCl3· 6H2O浓度从0.1 mol· L-1增加至0.6 mol· L-1时, [1ChCl∶ 2EG]/CrCl3· 6H2O ILs中的Cl-浓度将从5.04 mol· L-1增加至6.54 mol· L-1, 增加至1.30倍; 但其中H2O的浓度却从0.6 mol· L-1增加至3.6 mol· L-1, 增加至6倍, 可见H2O的浓度增幅比较显著, 这就可能导致有H2O和Cl-同时配位的Cr(Ⅲ )配合物中, 部分Cl-被H2O取代, 发生式(4)的平衡向右适当移动

因此, CrCl3· 6H2O浓度增加, 使[Cr(H2O)3Cl3]所占的摩尔分数也相应增大, 而[Cr(H2O)2Cl4]-的摩尔分数却相应减小, 这应该是[1ChCl∶ 2EG]/CrCl3· 6H2O ILs的颜色随CrCl3· 6H2O浓度增加逐渐从浅橙红色→ 黄绿色→ 褐绿色→ 深绿色变化的根本原因, 也是导致[1ChCl∶ 2EG]/CrCl3· 6H2O ILs的UV-Vis吸收光谱峰波长[图4(b)中的a→ f线]发生了蓝移的根本原因。 为了进一步验证上述的分析, 将含有0.1 mol· L-1CrCl3· 6H2O的[1ChCl∶ 2EG]/CrCl3· 6H2O IL于80 ℃真空干燥24 h, 结果溶液的颜色从浅橙红色变为红紫色[见图1(a)所示], 该溶液的UV-Vis吸收光谱线如图4(b)中的a1线, 与图4(b)中的a线对比发现, a1线的UV-Vis吸收光谱峰Ⅰ 红移至494 nm(红移了9 nm)。 对CrCl3· 6H2O进行热分析的结果发现, 71 ℃开始失去3个结晶H2O[5], 因此[1ChCl∶ 2EG]/CrCl3· 6H2O ILs经80℃真空干燥脱除部分H2O后, 可能导致与Cr(Ⅲ )配位的H2O的配位数减少, 而Cl-的配位数可能增加, 发生式(5)的平衡向右移动
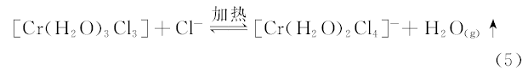
使[1ChCl∶ 2EG]/CrCl3· 6H2O ILs中[Cr(H2O)2Cl4]-的摩尔分数进一步增加, 该溶液的UV-Vis吸收光谱峰波长发生红移。 若在该溶液中添加CrCl3· 6H2O质量20 Wt%的H2O后, 溶液的UV-Vis吸收光谱峰波长明显发生蓝移至460 nm(蓝移了20 nm), 见图4(b)中的a2线, 应该是式(5)的平衡向左移动导致溶液中的[Cr(H2O)3Cl3]配合物的摩尔分数增加的结果。 此外, 实验中发现即使是将深绿色的[1ChCl∶ 2EG]/CrCl3· 6H2O溶液密封后加热至80 ℃及以上, 几分钟后溶液也会从深绿色变为紫红色, 而容器内壁可看到微量的水滴附着, 但当该溶液逐渐冷却至室温后, 颜色又逐渐恢复至原来深绿色, 这应该还是式(5)的平衡左右移动的结果。
通过对比分析可以认为在1ChCl∶ 2EG IL中, 配合物[Cr(H2O)2Cl4]-为红紫色, 而[Cr(H2O)3Cl3]为深绿色。 CrCl3· 6H2O浓度在0.1~0.6 mol· L-1范围的[1ChCl∶ 2EG]/CrCl3· 6H2O ILs中, Cr(Ⅲ )的优势物种是[Cr(H2O)2Cl4]-和[Cr(H2O)3Cl3]; 但CrCl3· 6H2O浓度较小(越接近0.1 mol· L-1或更小)时, 以[Cr(H2O)2Cl4]-为主, 溶液呈现红紫色-橙红色, 而当CrCl3· 6H2O浓度较大(越接近0.6 mol· L-1或更大)时, 以[Cr(H2O)3Cl3]为主, 溶液呈现深绿色; 若CrCl3· 6H2O浓度在0.3~0.4 mol· L-1范围, 应为[Cr(H2O)2Cl4]-和[Cr(H2O)3Cl3] 所占摩尔分数较为接近的共存, 溶液呈现黄绿— 褐绿色。
通过对CrCl3· 6H2O浓度在0.1~0.6 mol· L-1的水溶液和[1ChCl∶ 2EG]/CrCl3· 6H2O ILs进行ESI-MS和UV-Vis吸收光谱分析, 可以肯定在含有CrCl3· 6H2O的溶液中, Cr(Ⅲ )与Cl-和H2O可以形成[Cr(H2O)nCl6-n]n-3配合物, 其配合物的优势物种受CrCl3· 6H2O浓度的影响。
(1)在0.1~0.6 mol· L-1CrCl3· 6H2O的水溶液中, Cr(Ⅲ )的优势物种为[Cr(H2O)6]3+和[Cr(H2O)5Cl]2+, 并随着CrCl3· 6H2O的浓度增加, [Cr(H2O)5Cl]2+所占的摩尔分数会增加, 而[Cr(H2O)6]3+的摩尔分数则减小;
(2)CrCl3· 6H2O浓度在0.1~0.6 mol· L-1范围的[1ChCl∶ 2EG]/CrCl3· 6H2O ILs中, Cr(Ⅲ )的优势物种是[Cr(H2O)2Cl4]-和[Cr(H2O)3Cl3], 并随着CrCl3· 6H2O的浓度增加, [Cr(H2O)3Cl3]所占的摩尔分数增加, 而[Cr(H2O)2Cl4]-的摩尔分数减小; CrCl3· 6H2O浓度越接近0.1 mol· L-1或更小时, 以[Cr(H2O)2Cl4]-为主, 溶液呈现红色, 而当CrCl3· 6H2O浓度越接近0.6 mol· L-1或更大时, 以[Cr(H2O)3Cl3]为主, 溶液呈现深绿色。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|



