作者简介: 叶 婷, 女, 1996年生, 河北北方学院医学检验学院本科生 e-mail: 316580920@qq.com;乔海霞, 女, 1979年生, 河北北方学院医学检验学院本科生 e-mail: 1395004110@qq.com;叶 婷, 乔海霞: 并列第一作者
采用单电流阶跃电化学沉积技术, 在商业纯钛(CP-Ti)表面构建硅、 银、 氟离子共修饰羟基磷灰石(Si-Ag-F-HA)纳米复合薄膜。 Ag+的持续释放可以提供有效的抗菌性, Si4+作为生物活性元素可以有效地抵消Ag+的潜在细胞毒性。 采用电感耦合等离子体质谱法(ICP-MS)测定涂层中硅和银元素的释放规律。 采用傅里叶变换红外光谱(FTIR)、 扫描电子显微镜(SEM)、 能量弥散X射线谱(EDS)、 X-射线衍射(XRD)等技术对得到的材料进行了表征。 结果表明: Si, Ag和F三种元素均匀地掺杂到了HA的晶体结构中。 Si-Ag-F-HA为纳米级的针状晶体结构, 薄膜整体致密且均匀。 Si-Ag-F-HA纳米生物薄膜可以在一周内很好地诱导类骨磷灰石的形成, 具有优异的生物活性。 塔菲尔曲线测试结果证实涂层的耐SBF腐蚀性较好。 ICP-MS测试结果表明Si-Ag-F-HA纳米生物薄膜可以提供持续的Si和Ag离子释放。 FTIR 和ICP-MS等光谱技术为开发新型抗菌硬组织修复材料提供了高效快速的检测手段。
In this study, a novel silicon, silver, fluorine co-modified hydroxyapatite (Si-Ag-F-HA) nano-biofilms was deposited on CP-Ti through electrodeposition. Ag was incorporated into HA coating to improve the antimicrobial properties. Si was added as a second binary element to offset the potential cytotoxicity of Ag. The as-prepared coatings were examined by scanning electron microscope (SEM), energy-dispersive X-ray spectroscopy (EDS), Fourier transform infrared spectroscopy (FTIR) and X-ray diffraction (XRD) tests. Results highlight that F-, Si4+ and Ag+ could be evenly incorporated into the Si-Ag-F-HA coating. The results indicate that the Si-Ag-F-HA coatings take the morphology of nanoscale- villous-like, the composite coating becomes more compact. The composite coatings were found to be bioactive, based on the promotion of additional apatite onto the Si-Ag-F-HA coating surface from SBF. Potentiodynamic polarisation tests revealed that the corrosion resistance increased after Si-Ag-F-HA coating. The release of Si and Ag ions from Si-Ag-F-HA coatings shows sustained release kinetics without burst release, which reached a near steady state afterwards, thereby revealing long-term sustainable release. FTIR and ICP-MS provide a rapid and effective method for the development of new antibacterial hard tissue repair materials.
引 言
随着交通事故、 危险作业等各种原因造成的骨损伤日益增多, 以及硬组织置换医疗业的不断发展, 人们对骨替换材料的需求不断提高。 随着国内人口老龄化的到来, 生物医用材料的市场需求也会激增。 其中, 硬组织替代材料的开发和改进是一个非常活跃的研究领域[1, 2]。 随着膝关节、 髋关节置换、 颅骨修复等植入术的不断增多, 术后诱发生物材料-骨组织界面感染从而导致的植入体松动, 造成病人的长期疼痛和二次修复术的数量也日渐增多[3]。 因此, 如何促进骨组织很好的长入植入假体, 使得植入材料和骨组织有效地整合, 同时防止各种细菌在植入界面诱发炎症和感染, 被认为是预防假体松动的关键[3]。 目前, 医用硬组织修复领域的研究热点便是研发陶瓷磷灰石(通常为羟基磷灰石, HA)/医用金属(通常为商业纯钛, CP-Ti)复合材料, 即在CP-Ti基体上涂覆一层HA涂层[4]。 该复合材料在力学性能方面具备了金属优异的机械性能, 同时其表面的HA具备优异的骨整合特性, 可以提高植入材料与骨组织的结合能力, 是现在和未来人体硬组织损伤后修复或取代的理想材料。
1991年加拿大学者Shirkhanzadeh首次在钛合金表面采用电沉积法制备出HA涂层, 由于该方法的诸多优势, 逐渐引起了科研人员的广泛关注[5]。 然而, 该方法得到的涂层仍有一定的缺陷: 首先, 合成的HA与自然骨存在一定的差异, 如缺少微量元素, 降解性较差, 生物相容性相对较弱; 再者, HA涂层不具备抗菌性, 从而增加了植入部位术后感染的风险。 因此突破现有的涂层设计思路, 选择合适的微量元素植入载体是解决上述问题的一个突破口[6]。
针对上述问题, 在前期单电流阶跃法沉积F-HA复合涂层的基础上[5, 6, 7, 8], 采用硅(增加生物相容性)和银(增加抗菌性)对F-HA进行修饰, 期望得到的Si-Ag-F-HA复合涂层具备优异的耐腐蚀性, 抗菌性和细胞相容性。 值得注意的是, 在CP-Ti植入体表面采用电化学沉积技术, 在银离子、 氟离子和SiO2纳米粒子的共同修饰下对HA 涂层改性的相关研究尚未见报道。 目前, 傅里叶变换红外光谱(FTIR)技术有诸多优点: 如需要待测样的量少, 对特征基团灵敏度高以及制样分析简便; 电感耦合等离子体质谱法(ICP-MS)也有诸多优势: 如微量元素灵敏度高, 检出限低, 能同时分析多种元素; 上述两种方法已被广泛的用于纳米医用材料的化学元素和基团的鉴定[1, 2, 3]。 本文采用FTIR, ICP-MS, XRD, SEM, EDS和电化学法对Si-Ag-F-HA复合涂层的物相组成, 结构形貌和腐蚀特性等进行了分析。
本实验采用商业纯钛(CP-Ti)作为基体, 其表面的物理和化学形态是影响CP-Ti与HA涂层粘结强度的关键因素。 电化学涂覆前, 按照我们前期实验采用的常规方法, 对CP-Ti表层进行砂纸打磨、 酸液浸泡处理, 以便除去基体表面的TiO2, 同时对 CP-Ti进行活化[5, 6, 7, 8]。 薄膜涂覆实验采用LK2005A型电化学工作站(天津兰立科)进行, 设定为单电流阶跃模式。 采用经典的三电极系统: 参比电极选用232型饱和甘汞电极, 处理好的CP-Ti为工作电极, 大面积Pt片为对电极, 正负电极距为1.5 cm。 所有试剂均为分析纯(阿拉丁试剂, 上海晶纯生化科技股份有限公司)。 将2.1× 10-2 mol· L-1 Ca(NO3)2, 2.5× 10-2 mol· L-1 NH4H2PO4, 2.1× 10-2 mol· L-1 Ag(NO3)2和2× 10-3 mol· L-1 NaF溶于1 000 mL的烧杯中。 然后在上述电解液中加入0.8 g纳米SiO2, 磁力搅拌4 h, 超声2 h, 调节溶液的pH为4.1。 电沉积过程在100 mL烧杯中进行, 沉积电流: 8× 10-4 A· cm-2, 溶液温度: 62 ℃, 沉积时间: 55 min。 得到的Si-Ag-F-HA纳米生物薄膜用去离子水浸洗3次, 62 ℃烘干。 最后将样品在马沸炉中200 ℃保温2 h, 随炉自然冷却待用。
采用NICOLET NEXUS670型傅里叶变换红外光谱分析仪(FTIR)检测涂层的化学基团振动峰, 分辨率4 cm-1, 测试范围4 000~500 cm-1, 信号累加16次。 采用JEOL JSM-7500F型场发射电子显微镜(FE-SEM)观察涂层表面形貌; 采用Max20 EDAX型能量弥散X-射线能谱仪检测涂层的元素分布和含量; 采用D/Max-2500型X-射线衍射仪检测涂层的晶体特性, 铜靶(λ =1.541 8 Å ), 管压40 kV, 管流40 mA, 扫描步长为0.06° · s-1, 范围10° ~60° 。
模拟体液(SBF)的配置方法如下[5]: 在1 000 mL的烧杯中加入800 mL的超纯水, 在剧烈磁力搅拌的情况下, 依次加入分析纯的8.035 g NaCl, 0.355 g NaHCO3, 0.225 g KCl, 0.231 g K2HPO4, 0.311 g MgCl2· 6H2O, 40 mL 1 mol· L-1的HCl, 0.292 g CaCl2, 0.072 g NaSO4, 6.118 g (CH3OH)3CNH2(Tris盐酸缓冲液), 然后利用1 mol· L-1的HCl调节溶液的pH至7.4, 最后用1 000 mL的容量瓶将该溶液定容。 SBF浸泡实验如下: 将规格50 mL离心管置入37 ℃超级恒温槽中, 将样品放入离心管中, 每管加入40 mL SBF, 确保溶液和样品的浸泡比为20 mL· cm-2, 每48 h定时换液, 浸泡持续6 d后, 将样品用超纯水润洗5次, 烘箱中37 ℃烘干。 采用NICOLET NEXUS670型傅里叶变换红外光谱分析仪(FTIR)检测涂层的化学基团振动峰, 分辨率4 cm-1, 测试范围4 000~500 cm-1, 信号累加16次。
极化曲线测试实验采用CHI660E型电化学工作(上海辰华)站进行, 采用经典的三电极系统: 参比电极选用232型饱和甘汞电极, Si-Ag-F-HA纳米薄膜为工作电极, 大面积Pt片为对电极, 正负电极距为1.5 cm。 将样品的一面用AB胶覆盖, 确保1 cm2的样品在100 mL的SBF中。 将工作站设定为Open circuit potential模式, 开路电位测试20 min, 使得在进行极化测试前样品表面达到稳定的开路电位。 然后将工作站设定为Tafel模式, 样品进行极化曲线测试, 扫描范围-0.6~0 V, 扫描速度为0.01 V· s-1, 扫描时间为1 min。 同样测试条件下的CP-Ti作为实验对照组。
将规格10 mL离心管置入37 ℃超级恒温槽中, 将样品放入离心管中, 每管加入10 mL磷酸盐缓冲液(PBS), 确保溶液和样品的浸泡比为5 mL· cm-2, 持续浸泡1, 3, 5和7 d后, 将样品从离心管中取出, 检测每个阶段离心管中溶液的离子浓度。 采用电感耦合等离子体质谱仪(ICP-MS)测定涂层中硅和银元素的释放情况。 每组样品重复三次。
图1(a)为Si-Ag-F-HA纳米生物薄膜在低倍下的SEM结果, 涂层整体致密而均匀, 未出现明显的龟裂, 且涂层孔隙率较小, 可以对CP-Ti基体起到潜在的保护作用。 图1(c)为Si-Ag-F-HA纳米生物薄膜在高倍下的SEM结果, 涂层由致密的纳米级针状晶体组成, 针状晶体的直径约为200 nm这些纳米晶体垂直于CP-Ti基体表面, 有序生长。 Si-Ag-F-HA生物薄膜的这种纳米针状形貌与人体牙釉质的无机成分(磷灰石晶体)的形貌相类似[6]。 有研究表明, 当生物材料的晶体形貌和大小与自然骨类似时, 该材料可能会表现出与自然骨一样的生物相容性, 从而更易于与骨组织形成骨健合[6]。 图1(b)为对Si-Ag-F-HA薄膜进行能量弥散X射线点扫描的能谱图, 结果表明薄膜中含有Si, Ag, F, P, Ca, C及O元素, 其中(Si+Ag+Ca)/P的原子量比约为1.27, Si的质量分数约为1.77 Wt%, Ag的质量分数约为1.04 Wt%, F的质量分数约为1.31 Wt%, 所以实验得到的薄膜为缺钙型硅、 银离子共修饰F-HA(Si-Ag-F-HA)纳米生物薄膜。
 | 图1 Si-Ag-F-HA涂层的傅里叶红外光谱图(a和c); Si-Ag-F-HA涂层的能量弥散X射线谱图(b)Fig.1 Coating crystal morphologies of Si-Ag-F-HA coating (a) and (c); (b) EDS spectra of the Si-Ag-F-HA coating |
图2为对Si-Ag-F-HA薄膜进行能量弥散X射线面扫的能谱图, 结果表明薄膜中含有Si, Ag, F, P, Ca, C及O元素, 且各种元素均匀地分布在薄膜中, 表明Si, Ag, F三种元素均匀地掺杂到了HA的晶体结构中。
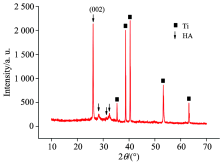
图3的XRD测试结果表明, Si-Ag-F-HA纳米生物薄膜主要由HA晶体构成(国际标准PDF卡片, 09-432), 没有磷酸钙、 氧化钙和磷酸氢钙等杂峰的出现, 可见硅、 银离子共修饰F-HA得到的磷灰石就是纯HA相。 这里值得注意的是Si-Ag-F-HA纳米生物薄膜的在(002)晶面出现了择优生长, 即纳米晶体垂直于CP-Ti基体表面有序生长, 这一结论与SEM的观察结构完全一致[6]。 总之, 通过简便高效的单电流阶跃沉积法可以在CP-Ti表面制备出结晶度好, 生长有序, 分布均匀且掺杂有硅(增加生物相容性)和银(增加抗菌性)的磷灰石纳米生物薄膜。
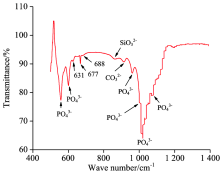
Si-Ag-F-HA纳米生物薄膜的FTIR结果如图4, 波数631 cm-1处为羟基振动峰。 波数1 096, 1 055和963 cm-1为P
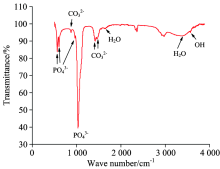
Si-Ag-F-HA纳米生物薄膜在SBF中浸泡6 d后, 其FTIR结果如图5, 波数1 099和967 cm-1为P
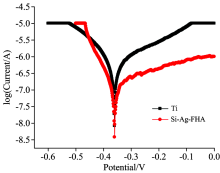
塔菲尔曲线测试结果如图6所示, 前期的研究表明通过塔菲尔曲线得到的腐蚀电流(GiGcoor)的可以作为判断薄膜腐性强弱的一个标准[9, 10]。 且icoor越小, 表明材料的耐腐蚀性能越强。 与CP-Ti对比, Si-Ag-F-HA纳米生物薄膜的icoor从10.21 μ A降低为0.89 μ A, 降低了约11倍。 SEM观察得知Si-Ag-F-HA为纳米晶体构成的致密保护膜, 所以得到的塔菲尔曲线测试结果证实涂层的耐SBF腐蚀性较好。 这一特性使得复合涂层长期保持生物活性, 减少植入松动和术后感染的可能[10]。
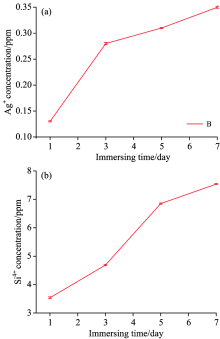
图7为样品在PBS中浸泡7 d的Ag+和Si4+释放结果。 结果表明Ag+和Si4+都可以持续释放, Si-Ag-F-HA纳米生物薄膜可以提供连续的Si和Ag离子释放。 两种离子的掺杂并未对涂层的降解动力学有显着的影响。 Ag+的持续释放可以提供有效的抗菌性, 与此同时其可能对成骨细胞产生毒性, 而Si4+的释放可以增加涂层的细胞相容性, Si4+作为生物活性元素可以有效地抵消Ag+的潜在细胞毒性[11, 12]。 本课题组将在后续试验中进一步研究Si4+和Ag+对成骨细胞的综合效应, 为开发新型抗菌硬组织修复材料提供理论依据。
目前, HA涂层相对较差的抗感染性, 是造成目前植入假体松动和金属基材腐蚀的重要原因。 而银离子具有较好的抗菌性。 本研究在含有Si, Ag和F离子的Ca-P电解液中, 采用简易的电解沉积技术, 对CP-Ti表面进行了改性, 使得其表面涂覆一层纳米Si-Ag-F-HA复合薄膜。 研究了硅、 银、 氟离子共修饰对HA涂层的元素含量、 晶体结构和物相组成的影响。 结果表明: 硅、 银、 氟离子均匀地掺杂到了HA涂层中, Si-Ag-F-HA为纳米级的针状晶体结构, 薄膜整体致密且均匀。 模拟体液体外矿化表明, 涂层表面有含碳酸根的类骨磷灰石形成, 则涂层的体外生物活性较好。 Si-Ag-F-HA纳米生物薄膜可以提供连续的Si和Ag离子释放。 本研究旨在为开发新型抗菌硬组织修复材料提供新的设计思路和理论依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|