作者简介: 郭鹏程, 1991年生, 武汉工程大学理学院研究生 e-mail: 1614591072@qq.com
采用激光拉曼光谱分析比较了灵芝孢子油、 橄榄油、 葵花籽油及鱼肝油的光谱特征, 结果显示激光拉曼光谱法可以用于快速检测灵芝孢子油: 灵芝孢子油具有位于1 563 cm-1处峰强较弱线宽较宽的特征拉曼峰, 而且位于1 445和1 660 cm-1两处拉曼峰的相对强度比与其他油不同。 同时运用激光拉曼光谱法分析了变质的灵芝孢子油和廉价的灵芝孢子油, 发现暴露在空气中一段时间后的灵芝孢子油的活性成分基本被氧化了, 市场上廉价的灵芝孢子油可能是由变质的灵芝孢子油、 葵花籽油、 或其他廉价植物油混合掺杂而成的。
Raman spectroscopy has been applied for rapid analysis of ganoderma spore oil. It is found that the Raman spectrum of ganoderma spore oil has a weak and broad characteristic phonon mode at 1 563 cm-1, which is not observed in olive oil, sunflower seed oil, and cod-liver oil. In addition, the relative intensity ratio of the two phonon modes at 1 445 and 1 660 cm-1 in ganoderma spore oil is very different comparing with that in olive oil, sunflower seed oil, and cod-liver oil. Furthermore, Raman analysis of deteriorated ganoderma spore oil and fake ganoderma spore oil is investigated. Our results showed that when ganoderma spore oil is exposed in air, its active ingredients will be oxidized, and the fake ganoderma spore oil on market could be a mixture of deteriorated ganoderma spore oil, sunflower seed oil, or other cheap vegetable oils.
引 言
灵芝是一种名贵的中草药。 从中医的角度上来说, 灵芝具有扶正固本、 延年益寿等功效[1]。 灵芝孢子是灵芝的有性生殖细胞, 灵芝孢子中包含了灵芝中所有的活性成分, 主要包括三萜类、 多糖类、 蛋白质类等物质, 同时还有核苷类、 甾体类、 生物碱类、 氢醌类、 氨基酸类等活性成分[2, 3]。 实验证明三萜类成分有抗肿瘤、 抑制胆固醇合成、 抗病毒、 降血糖、 保肝平喘等功效; 灵芝多糖有调节免疫功能、 抗肿瘤、 抗氧化、 保护神经细胞、 改善学习记忆、 降血脂等作用; 蛋白质类中的以麦角甾醇为首的甾醇类, 有抑制肿瘤细胞增殖、 保肝、 保护神经元、 抗炎等药理活性[4, 5, 6]。 由于灵芝孢子油具有的潜在功效, 其价格非常昂贵, 其功效也被吹嘘的神乎其神; 而且市场上相关产品的质量参差不齐, 如一些不法商家为牟取暴利, 在灵芝孢子油中掺杂相对廉价的植物油, 严重影响了消费者的切身利益。 因而找到一种简单有效的科学方法检测灵芝孢子油有重要意义。
目前, 用来检测油品品质的常用方法有高效液相色谱法和气相色谱法等[7, 8, 9]。 这些方法一般都需要经过样品预处理, 而且操作复杂、 检测时间长, 无法满足快速检测的要求。 拉曼光谱具有快速、 准确、 无损、 无需样品复杂预处理等优点, 而且可获得样品的物理化学及深层结构信息, 已广泛应用于物理、 化学、 材料、 生物医学、 食品科学与安全等领域[10, 11, 12]。 在食用油检测领域, 拉曼光谱已被用于橄榄油掺假鉴别[13], 自由脂肪酸含量分析, 油脂氧化监测[14]等。 本文运用激光拉曼光谱法分析灵芝孢子油与几种常见油的光谱区别, 并检测灵芝孢子油变质和掺假, 这对保障消费者权益和整个保健品行业的发展等具有重要意义。
所用灵芝孢子油、 葵花籽油、 橄榄油、 及鱼肝油样品均为从正规商场购买所得, 所用变质灵芝孢子油样品为从正规商场购买的灵芝孢子油在空气中暴露了1个月, 所用廉价灵芝孢子油样品为从网上购买所得。
拉曼光谱采用韩国NANOBASE公司的XperRam200激光共焦显微拉曼光谱仪对样品进行检测。 激光波长为532 nm, 激光照射在样品上的功率约为2 mW, 光谱采集波数范围为400~1 800 cm-1。 光谱采集时间为30 s, 光谱采集均在暗室条件下进行, 在光谱采集时间内激光照射对各种油的破坏可以忽略不计。
图1比较了灵芝孢子油(从正规商场购买的灵芝孢子油)、 葵花籽油、 橄榄油及鱼肝油的拉曼光谱。 为了更清楚的分析对比各种不同类型油光谱的差别, 图1中所有谱的强度都用位于1 660 cm-1处拉曼峰的强度为参考做了归一化。 从图1中可以看出, 各种不同类型油的拉曼光谱比较相似, 在800~1 800 cm-1光谱范围内都能观测到位于870, 970, 1 080, 1 265, 1 305, 1 445, 1 660和1 750 cm-1等八个拉曼峰, 只是这些拉曼峰的线宽和相对强度不同。 这些拉曼峰是各种不同类型油中主要成分脂肪酸的特征振动模式[15]。 因而, 灵芝孢子油与各种常见的食用油相比, 主要区别应该是脂肪酸的种类和比例不同, 同时可能含有一些其他的微量成分。 虽然各种不同类型油的拉曼光谱大体相似, 但图1显示各种不同类型油的光谱也有各自的特点, 这些特点应可以用来快速检测不同类型的油。
 | 图1 灵芝孢子油、 橄榄油、 葵花籽油及鱼肝油的拉曼光谱Fig.1 Raman spectra of ganoderma spore oil, olive oil, sunflower seed oil and cod-liver oil |
灵芝孢子油拉曼光谱图的特点表现为以下几点。 (1) 位于1 565 cm-1处有一个峰强比较弱线宽比较宽的拉曼峰, 其对应的是N— H弯曲振动和C— N键的伸缩振动, 即酰胺Ⅱ 键的特征拉曼峰。 (2) 位于1 750 cm-1处的拉曼峰强度非常弱, 该拉曼峰对应的是C=O键的伸缩振动[15]。 (3) 位于1 800 cm-1处有峰强非常弱线宽比较宽的拉曼峰, 其对应的是糖醛栓类C— H伸缩和变角振动。 (4) 在800~950 cm-1光谱范围内的拉曼峰线宽较宽, 仅表现为一个宽的拉曼带。 (5) 有非常微弱的荧光。 橄榄油拉曼光谱图的特点是, 位于1 160和1 525 cm-1两处有峰强较弱的拉曼峰, 其分别对应的是— (CH2)n— 基团的C— C伸缩振动峰和(RHC=CHR)中C=C伸缩振动峰[16]。 葵花籽油拉曼光谱图的特点是, 在800~950 cm-1光谱范围内的拉曼峰比较容易分辨, 而且在1 565 cm-1处有峰强非常弱线宽比较宽的拉曼峰。 鱼肝油拉曼光谱图的特点是, 在800~950 cm-1光谱范围内的拉曼峰比葵花籽油更容易分辨, 位于1 080和1 305 cm-1两处的拉曼峰很弱, 而且位于1 445 cm-1等处的拉曼峰与灵芝孢子油、 葵花籽油、 橄榄油相比要弱很多。
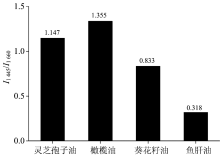
灵芝孢子油、 葵花籽油、 橄榄油、 及鱼肝油的拉曼光谱图除了以上特点, 图1还显示各种不同类型油中拉曼峰的相对强度比有明显差别。 这些拉曼峰相对强度比的差别表明各种不同类型油中脂肪酸的种类和比例不同[13, 17]。 图1中位于1 445和1 660 cm-1两处拉曼峰的峰强强, 峰形好, 而且受其他拉曼峰的干扰小。 因而我们选用这两个特征拉曼峰的相对强度比用于快速检测各种不同类型的油。 比较了灵芝孢子油、 葵花籽油、 橄榄油、 及鱼肝油中1 445和1 660 cm-1两处拉曼峰的相对强度比。 如图2所示, 各种不同类型油中I1 445/I1 660都不一样, 且比值差异明显, 因而可以很好的用于快速检测不同类型的油。
以上讨论得出, 运用灵芝孢子油的拉曼光谱特征, 及1 445和1 660 cm-1两处拉曼峰的相对强度比, 可以方便快速的检测灵芝孢子油。 下面我们将运用拉曼光谱法检测灵芝孢子油的变质及廉价的假冒灵芝孢子油。
图3比较了灵芝孢子油、 变质了的灵芝孢子油(在空气中暴露了1个月)、 及廉价灵芝孢子油的拉曼光谱(图中所有谱的强度都用位于1 660 cm-1处的拉曼峰的强度为参考做了归一化)。
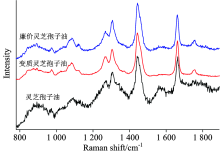 | 图3 灵芝孢子油、 变质灵芝孢子油、 及廉价灵芝孢子油的拉曼光谱Fig.3 Raman spectra of ganoderma spore oil, deteriorated ganoderma spore oil and cheap ganoderma spore oil |
如图3所示, 在空气中暴露了1个月后的灵芝孢子油的拉曼光谱发生了非常显著的变化, 主要表现为: (1) 酰胺Ⅱ 键对应的1 563 cm-1拉曼峰基本消失了, (2) C=O键对应的1 750 cm-1拉曼峰明显变强了, (3) 微弱的荧光基本消失了, (4) I1 445/I1 660发生了显著的变化, 从1.147变为1.276。 这些光谱的变化都表明在空气中暴露了1个月后的灵芝孢子油发生了明显的变质, 变质的原因可能是灵芝孢子油中酰胺II键被氧化破坏了, 同时C=O键由于氧化变得更强了, 而且产生荧光的其他微量成分也被氧化破坏了。
廉价灵芝孢子油的拉曼光谱和已变质的灵芝孢子油的拉曼光谱很相似, 主要区别是廉价灵芝孢子油中位于1 563 cm-1处有一个非常弱的拉曼峰。 同时廉价灵芝孢子油中位于1 563 cm-1处拉曼峰和葵花籽油中的该峰很相似。 这些光谱特征表明廉价灵芝孢子油可能是由变质的灵芝孢子油、 葵花籽油、 或其他廉价油混合而成的, 具体分析廉价灵芝孢子油的成分需要更进一步的研究。
通过比较分析灵芝孢子油与橄榄油、 葵花籽油及鱼肝油的拉曼光谱区别发现, 激光拉曼光谱法可以用于方便快速检测灵芝孢子油。 与橄榄油、 葵花籽油、 及鱼肝油相比, 灵芝孢子油具有位于1 563 cm-1处峰强较弱线宽较宽的特征拉曼峰, 而位于1 750 cm-1处的拉曼峰非常弱, 同时位于1 445和1 660 cm-1拉曼峰的相对强度比和其它油明显不同, 而且在532 nm激光激发下荧光效应比其他油要稍强。 同时本文运用激光拉曼光谱法分析了氧化变质的灵芝孢子油和市场上廉价的灵芝孢子油, 发现暴露在空气中1个月后的灵芝孢子油中活性成分基本被氧化了, 市场上廉价的灵芝孢子油可能是由变质的灵芝孢子油、 葵花籽油、 或其他廉价油混合而成的。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|