作者简介: 李静辉, 1987年生, 黑龙江八一农垦大学硕士研究生 e-mail: lijinghui_yy@sina.com
建立薄层色谱(TLC)与表面增强拉曼光谱(SERS)联用技术对改善睡眠类保健食品中四种非法添加化学成分(三唑仑、 艾司唑仑、 氯硝西泮及奥沙西泮)的快速检测新方法。 以环己烷-乙酸乙酯-乙醇(5∶3.5∶2)为展开剂, 利用 TLC 将添加成分与保健食品基质初步分离, 在UV254 nm下检测定位; 以780 nm激光为激发波长, 水相银溶胶为表面增强剂, 采用SERS法对TLC上的微量添加成分定性检测。 通过模拟阳性样品实验, 考察保健食品基质对添加成分TLC-SERS的影响, 并考察四种化学成分的检测限。 建立了改善睡眠类保健品中非法添加四种化学成分的TLC-SERS检测方法。 四种添加成分的TLC-SERS与相应对照品的拉曼光谱特征峰存在明显相关性; 保健食品的基质对添加成分的检测几乎没有干扰; 四种化学成分的检测限为1~4 μg。 最后, 对市售五种改善睡眠类保健食品进行检测, 均不存在非法添加情况。 该研究利用TLC与SERS相结合的方法应用于改善睡眠类保健食品中掺杂化学成分的快速检测, 并获得了镇静安眠类共四种化药的TLC-SERS谱, 建立了改善睡眠类保健食品中非法添加三唑仑等四种化药的检测方法; 该法专属、 灵敏、 快速、 简单, 并且没有显著的检测时间限制, 为改善睡眠类保健食品中掺杂化学成分的现场检测方法研究提供新的参考依据。
A novel facile method for on-site detection of sleep problems chemicals (e. g. triazolam, estazolam, clonazepam and oxazepam) adulterated in health-care food for promoting sleep using thin layer chromatography (TLC) combined with surface enhanced Raman spectroscopy (SERS) was reported in the present paper. Firstly, chemical drugs added in simulation of positive drugs were separated with substrate in health-care food by TLC initially, mobile phase was cyclohexane-ethyl acetate-ethanol (5∶3.5∶2); detected and located by UV under 254 nm. Then trace substances were qualitative detected by SERS, excitation wavelength was 780 nm, surface enhancer was aqueous phase silver sol. The effect of matrix on the addition of health-care food was investigated by TLC-SERS in the positive experiment, and the detection limits of the 4 kinds of chemical components were also investigated. TLC-SERS detection method for 4 kinds of chemical components, which were illegally added in sleep health care products, was established. The characteristic peaks of Raman spectra of the chemical drugs added into health-care food obtained by TLC-SERS method were nearly consistent with the reference substance. TLC-SERS of matrix of health-care food to add ingredients was almost no interference. The LOD of 4 kinds of chemical components was from 1 to 4 μg. In addition, commercially available five kinds of Chinese medicine and health-care food for improving sleep were tested, randomly; there was no illegal substance added in the case. In this study, TLC-SERS method is applied in rapid testing of health-care food adulteration for the first time, with obtaining some ideal results, such as SERS spectra of 4 kinds of sedative hypnotics chemical drugs, as well as TLC-SERS detection methods for 4 frequently adulterated sedative hypnotics chemical drugs. TLC-SERS method is specific, sensitive, rapid, and without significant detection time constraints, would have good prospects in on-site detection of chemicals for doping in health-care food.
引 言
随着市场经济飞速发展, 人们的工作压力逐渐加大, 以及老年化时代的到来, 失眠逐渐成为常见的亚健康现象, 对人们的正常工作与生活造成极大困扰。 为了在缓解此现象的同时, 不会引起较大毒副作用, 保健食品成为人们的首选对象, 故我国保健食品的消费与日俱增。 目前市售改善睡眠作用的保健食品中, 大部分以褪黑素及维生素B6为原料, 还有一部分产品的原料是具有镇静安神作用的中药材[1]。 一些不法商贩为了牟取暴利, 利用此类保健食品成分复杂、 价格较贵、 质量标准不完善及监管措施有漏洞等现象, 在其中非法添加镇静催眠化学药物, 肆意提高疗效[2, 3]。 由于添加化学成分的不确定性及添加剂量的不稳定性, 消费者在不知情的情况下长期服用或过量使用, 会引起抑郁、 焦躁等严重不良反应, 危害身体健康, 故建立保健食品中非法添加化学药物的快速检测方法, 对防范此类不法行为、 保障人民健康具有极为重要的意义。
目前, 常见检测保健食品中非法添加化学药物的方法有HPLC[4, 5]、 HPLC-MS[6]、 GC-MS[7]、 UPLC-MS[8]、 TLC-FTIR[9], 这些方法准确、 灵敏, 但也存在着对样品前处理技术及实验条件要求较高、 检测周期长等不足; TLC作为经典的分离手段, 具有简便、 快速、 成本低、 需样量少等优点, 但专属性较低, 对于通常含有几十种物质的保健食品等复杂体系很难准确鉴别其目标成分。 为此, 建立专属性强、 灵敏度高、 快速准确, 并能同时检测保健食品中多种化学添加成分的分析方法势在必行。 近年来研究较多的表面增强拉曼光谱法(surface-enhanced Raman spectroscopy, SERS) 能提供分子振动能级的指纹图谱, 可使拉曼信号增加104~105倍, 在微量成分鉴别上具有很大优势, 特别是TLC与SERS联用技术集专属、 灵敏、 简单、 快速于一体, 已被逐渐应用于样品快速检测[10], 例如尿液中生物标志物检测[11]、 水质污染监测[12]、 结构类似物鉴别[13]、 人体血液中吗啡监测[14]等。
本工作致力于TLC与SERS联用技术的研究, 利用TLC实现复杂体系的初步分离, 再利用SERS进行组分鉴别。 本研究收集了改善睡眠类保健食品中常见的四种非法添加化学药物, 并建立了同时快速检测这些添加成分的TLC-SERS方法, 该法专属、 灵敏、 简单、 快速, 为保健食品中非法添加化学药物的监测提供了新的参考依据。
DXRxi显微拉曼成像光谱仪(Thermo Fisher Scientific, USA); XS105 DualRange 分析天平(精密度: 0.01 mg, METTLER TOLEDO, Switzerland); SLR温控型红外快速加热板(Wiggens公司); Nano-ZS90 纳米粒度仪(Malvern Instruments Ltd, UK); KQ-250B型超声波清洗器(昆山市超声仪器有限公司); WFH-203B 型三用紫外分析仪(上海精科实业有限公司); 硅胶GF254铝合金薄层板(Merk, Germany)。 三唑仑(批号: 171230)、 艾司唑仑(批号: 171219)、 氯硝西泮(批号: 171227)、 奥沙西泮(批号: 171229)对照品均购自中国食品药品检定研究院。 美通宁片(批号: 160401)、 恬静胶囊(批号: 20160603)、 睡好片(批号: 15110010)、 纽斯葆牌褪黑素片(批号: 6A175)、 野酒花牌改善睡眠胶囊(批号: 20160402)均为市售改善睡眠类保健食品。 硝酸银、 柠檬酸三钠、 乙酸乙酯、 无水乙醇、 环己烷等均为分析纯。 实验用水为纯化水。
1.2.1 银胶溶液的制备
称取硝酸银90 mg, 溶于500 mL水中加热至沸腾, 加入1%柠檬酸钠溶液10 mL, 然后保持沸腾1 h, 冷却, 得银胶溶液。 取上述银胶溶液4 mL, 离心后移去2 mL上清液, 得到2倍浓缩的银胶溶液, 4 ℃保存备用。
1.2.2 溶液的制备
对照品溶液: 精密称取艾司唑仑、 奥沙西泮对照品各适量, 分别加甲醇配制1 mg· mL-1的溶液; 精密称取三唑仑、 氯硝西泮对照品各适量, 分别配制0.5 mg· mL-1的甲醇溶液, 备用。
样品溶液: 取一次口服剂量的样品, 研细, 加入甲醇2 mL溶解, 超声15 min, 离心后取上清液, 浓缩至 1 mL, 备用。
模拟阳性样品溶液: 取某改善睡眠类保健食品样品(经齐齐哈尔市食品药品检验检测中心检测不含有以上四种对照品, 可作为阴性样品)适量, 研细, 精密称取三唑仑、 艾司唑仑、 氯硝西泮、 奥沙西泮对照品适量加入样品中, 加入甲醇2 mL溶解, 超声 15 min, 离心后取上清液, 浓缩至1 mL, 使四种化学成分与相应的对照品一致, 备用。
1.2.3 TLC-SERS检测
分别吸取对照品溶液、 阴性样品溶液以及模拟阳性样品溶液适量, 点于同一GF254硅胶板上, 以环己烷-乙酸乙酯-乙
醇(5∶ 3.5∶ 2)为展开剂, 室温条件下, 展开, 取出晾干, 在UV254 nm紫外灯下检视定位, 分别将对照品与其Rf值相同处的斑点滴加4 μ L银溶胶, 采用显微拉曼成像光谱仪进行检测相应的SERS。 三唑仑、 氯硝西泮对照品溶液浓度较低, 应采用乙醇对相应色谱斑点原位浓集后, 在浓集点处滴加4 μ L银胶溶液, 其他操作同上。
拉曼光谱仪工作条件: 激发光波长: 780 nm激光; 放大倍数: × 10; 扫描范围: 50~3 300 cm-1; 图像像素大小100.0 μ m; 光阑: 50 μ m共聚焦针孔; 扫描方式: 区域面扫; 激光功率: 24.0 mW; 曝光时间: 0.2 s; 曝光次数: 20; 平滑点数为 5; 采用OMNICxi软件进行数据处理; Savitzky-Golay 平滑; Origin Pro 8.0制图。
参照国家药品标准和相关文献方法, 对TLC展开条件进行比较及优化, 实验中分别考察了三个展开系统对三唑仑、 艾司唑仑、 氯硝西泮及奥沙西泮的展开情况: (1) 正庚烷-氯仿-无水乙醇-乙酸乙酯(5∶ 2∶ 2∶ 1.5); (2) 氯仿-苯-丙酮-甲醇(5∶ 5∶ 3∶ 1); (3) 环己烷-乙酸乙酯-甲醇(5∶ 3.5∶ 2), 根据四种化学成分的分离效果与展开剂的毒性大小, 最终选择(3)作为本试验的TLC展开剂。
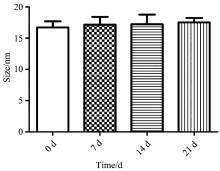
2.2.1 银溶胶粒径及电势变化
从银溶胶制备之日起, 每隔七天采用纳米粒度仪分别测定所制备的银胶溶液粒径(Size)、 电势(Zeta)。 如图1及图2所示, 银溶胶放置0~21 d天, 粒径与电势变化无显著性差异(p> 0.05), 其中粒径约为16.0 nm, 电势约为-35.0 mV, 说明所制备的银胶溶液纳米颗粒分布较为均匀, 具有良好的稳定性。
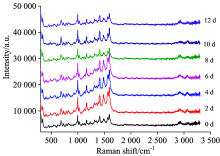
2.2.2 银胶溶液放置时间对TLC-SERS的影响
参照1.2.3节进行实验, 从银胶溶液制备之日起, 每隔两天对艾司唑仑TLC-SERS进行检测, 比较分析不同放置时间的银溶胶对谱图的影响。 如图3所示, 银溶胶放置0~12 d内, 各时间段艾司唑仑的 TLC-SERS峰型基本一致, 峰强略有不同, 说明所制备的银胶溶液在短期内可以重复使用, 具有良好的稳定性。
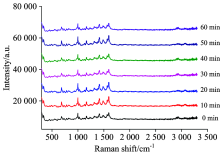
2.2.3 检测时间对TLC-SERS的影响
参照1.2.3节实验, 以艾司唑仑为例, 在TLC斑点位置滴加2 μ L银胶溶液, 待银胶溶液挥干后, 分别在0~1 h内每隔10 min检测一次, 观察谱图变化。 由图4可见, SERS信号基本无明显变化, 说明检测斑点在经TLC分离、 UV254 nm定位后, 1 h内检测稳定性良好。
以532 nm激光为激发光源, 空白银溶胶在1 200~1 800 cm-1处有较强的信号; 以 780 nm激光为激发光源, 空白银胶几乎没有信号。 为了防止银胶溶液信号对目标物检测信号的干扰, 实验中选用 780 nm激光作为激发光波长, 见图5。
 | 图5 不同激发波长条件下空白银溶胶拉曼光谱图Fig.5 The Raman spectra of blank silver colloids under 780 nm (red) and 532 nm (blue) |
将对照品(三唑仑)溶液、 样品溶剂(甲醇)、 空白银胶溶液分别点于同一硅胶GF254薄层板上, 参照1.2.3节进行实验, TLC斑点处检测 SERS信号。 如图6所示, 空白银溶胶及样品溶剂均无明显的SERS信号, 而对照品与对照品粉末有相近的拉曼特征峰信号, 说明甲醇溶剂与银胶溶液对目标成分SERS几乎无干扰。
如图7所示, 三唑仑、 艾司唑仑、 氯硝西泮及奥沙西泮的Rf值分别为0.24, 0.35, 0.72和0.80, 且可与保健食品主要成分(褪黑素与维生素B6)及其他基质初步分离。
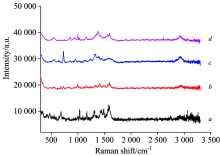
如图8所示, 经TLC分离的阳性样品中四种化学药物的SERS图谱与相应对照品一致, 但阴性样品无SERS信号, 且四种化学成分SERS图谱有明显区别, 说明本法专属性较强, 可以用于化学药物的定性鉴别。
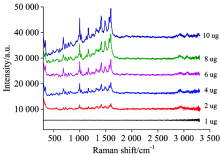
分别取不同体积的对照品(艾司唑仑)溶液(1, 2, 4, 6, 8和10 μ L)点于同一硅胶GF254薄层板上, 相应的沉积量分别为1, 2, 4, 6, 8和10 μ g, 参照1.2.3节实验, 在与最高浓度层析斑点Rf值一致的位置分别做上标记后检测SERS信号。 根据信噪比(S/N=3)判断检测限(LOD), 如图9所示, 艾司唑仑的LOD为4 μ g。 按照此方法分别对其他三种对照品的LOD进行考察, 三唑仑、 氯硝西泮、 奥沙西泮的LOD分别为1, 1和4 μ g, 见图10, 均低于保健食品中可能的添加量。
因为《中国药典》2015版二部收载的艾司唑仑、 三唑仑、 氯硝西泮、 奥沙西泮口服剂量最小规格分别为1, 0.125, 0.25和15 mg, 故一次服用计量的保健食品中四种化学成分的掺杂量可能分别是1, 0.125, 0.25和15 mg, 按1.2.3节实验, TLC沉积量分别为10, 1.25, 2.5和150 μ g, 均高于相应对照品的的LOD。 故本法可用于检测保健食品中常规掺杂量的化学成分, 具有较高的灵敏度。
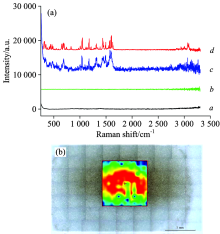
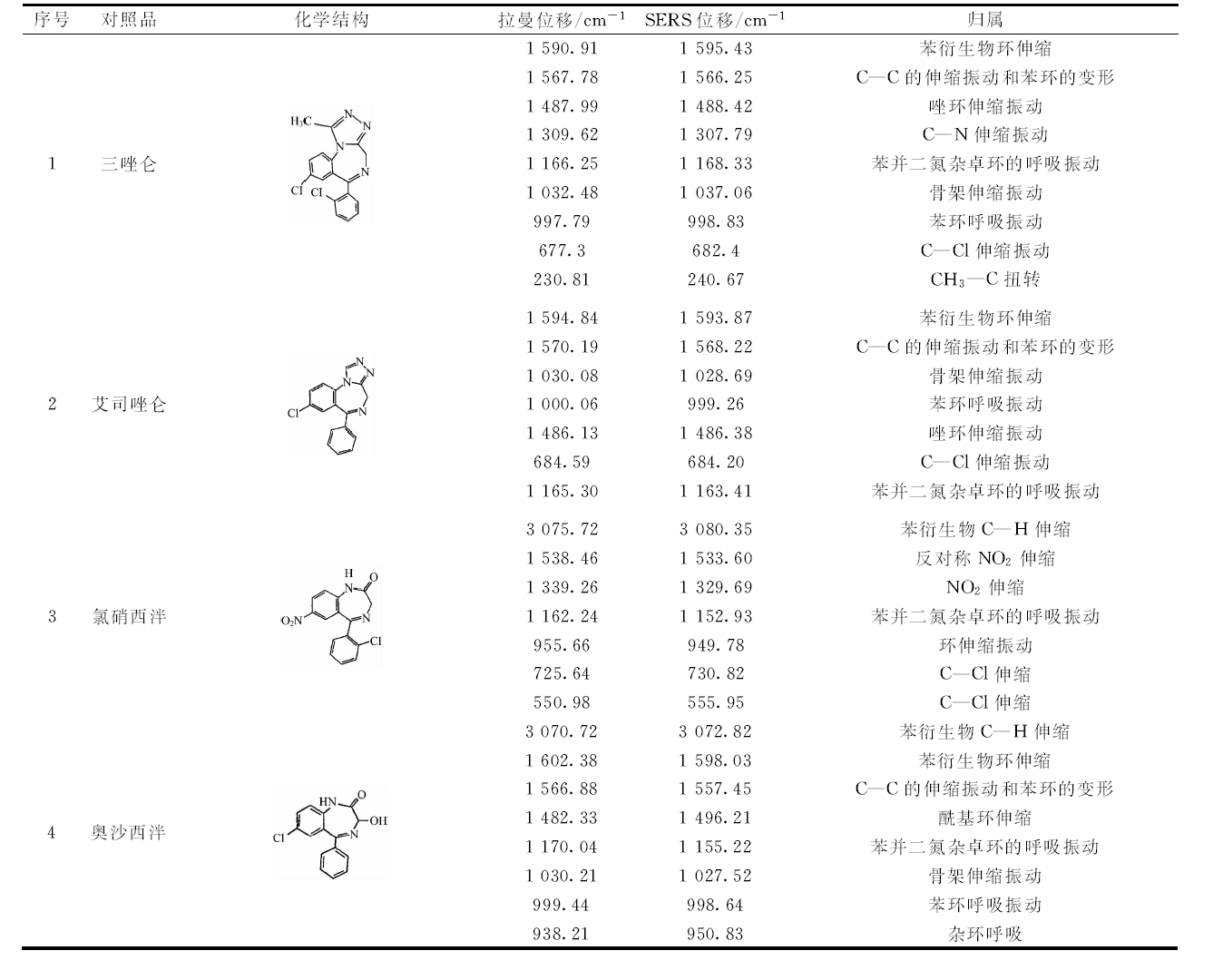
将三唑仑、 艾司唑仑、 氯硝西泮、 奥沙西泮四种对照品的拉曼光谱[见图11(a)]与相应TLC-SERS[图11(b)]比较并解析, 每种对照品选择5处以上相对峰强较高的特征峰, 并对其进行特征峰归属, 见表1。
 | 图11 四种对照品拉曼光谱(a)与TLC-SERS(b) a: 三唑仑; b: 艾司唑仑; c: 氯硝西泮; d: 奥沙西泮Fig.11 Reference conventional Raman spectroscopy (a) and TLC-SERS (b) a: Triazolam; b: Estazolam; c: Clonazepam; d: Oxazepam |
| 表1 四种对照品拉曼光谱TLC-SERS特征峰及归属 Table 1 The characteristic peak of four reference substance Raman and TLC-SERS spectra |
三唑仑、 艾司唑仑、 氯硝西泮及奥沙西泮均属苯并二氮杂卓类抗焦虑化学合成药, 彼此的拉曼光谱存在明显差异, 但同一成分的拉曼光谱与其 TLC-SERS 存在明显相关性。 例如四种化学物质均存在相同的苯并二氮杂卓环的特征吸收峰分布在1 162~1 170 cm-1范围内; 氯硝西泮的拉曼光谱及SERS中均有明显的硝基特征峰1 339.26和1 329.69 cm-1, 可以作为定性分析的指纹信息, 区别结构相近的氯硝西泮与奥沙西泮 ; 三唑仑中甲基的特征峰位移为230.81 cm-1, 相应SERS位移为240.67 cm-1, 由此可区别结构非常相近的三唑仑与艾司唑仑。
众所周知, TLC 反映的是目标成分极性或某个官能团的特性, 而上述实验表明拉曼光谱与SERS反映的是目标成分的指纹结构信息, 因此, TLC-SERS联用方法具有很高的专属性。
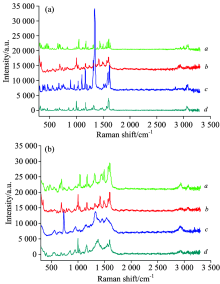
取不同种样品, 按1.2.3节实验, 得到TLC, 见图12。 样品3和样品5色谱带中出现与三唑仑对照品Rf相近斑点, 疑似添加三唑仑。 由于保健食品体系的复杂性, 仅凭色谱 Rf 相近尚不能准确判定该斑点成分为相应的对照品(三唑仑)。
为了进一步鉴别与三唑仑对照品Rf相近斑点, 分别对样品3、 样品5与对照品斑点进行 SERS 检测。 结果显示, 样品3和样品5的SERS信号与三唑仑对照品SERS信号存在明显差异, 见图13。 后经齐齐哈尔市食品药品检验检测中心验证, 样品3与样品5均不含有三唑仑。
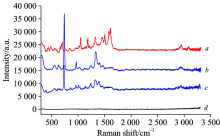 | 图13 样品3及样品5 TLC-SERS检测结果 a: 空白银胶溶液; b: 样品3; c: 样品5; d: 三唑仑Fig.13 TLC-SERS of sample 3 and sample 5 a: Blank silver colloid solution; b: Sample 5; c: Sample 3; d: Triazolam |
由此可见, TLC-SERS的专属性明显高于仅在UV254 nm项下检视的TLC。
研究所建立的检测方法用于改善睡眠类保健食品中非法添加三唑仑、 艾司唑仑、 氯硝西泮及奥沙西泮四种化学药物的快速检测, 具有专属性强、 灵敏度高、 简便快速、 检测成本低等优点, 可为保健食品非法添加成分快速检测方法研究提供技术参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|