作者简介: 吴晓静, 1963年生, 合肥工业大学化学与化工学院副教授 e-mail: wuxiaojing@ustc.edu
采用质谱、 拉曼光谱及理论计算对[ M(H2O) n]+( M=Li, K)水合团簇进行了研究。 质谱分析[ M(H2O) n]+( M=Li, K)水合团簇的离子峰, 推测其水溶液中最大水化数为12和13。 采用拉曼光谱对浓度梯度相同的LiCl和KCl水溶液进行了讨论与比较, Li+和K+的水化作用导致~3 208 cm-1水结构拉曼峰发生了明显的变化, 其中LiCl和KCl溶液的浓度分别在0~2.0和0~2.5 mol·L-1范围内, 水化作用呈线性增强, 浓度大于2.0和2.5 mol·L-1时, 偏离线性关系, 出现缔合。 理论计算[ M(H2O) n]+水合团簇结构和理论拉曼光谱表明, Li+, K+分别在 n>4和 n>6开始第二水化层, O—H伸缩振动频率发生了蓝移, 氢键结构遭到了破坏, 与实验结果一致。
[ M(H2O) n]+( M=Li, K) hydrated clusters have been studied by Mass spectra, Raman spectra and the theoretical calculation. [ M(H2O) n]+( M=Li, K) hydrated clusters ion peaks could be obtained by Mass spectra, which could speculate that their maximum hydration numbers are 12 and 13 in their aqueous solution respectively. The same concentration gradient LiCl and KCl aqueous solutions of Raman spectra have been discussed and compared, the ~3 208 cm-1 Raman spectra of water structure had obvious changes because of the hydration of Li+ and K+. Between the 0~2.0 and 0~2.5 mol·L-1 concentration range of LiCl and KCl aqueous solution, respectively, their differential Raman spectra of ~3 208 cm-1 negative peak integral strength decreased in a linear, and hydration increased gradually. While concentration was more than 2.0 and 2.5 mol·L-1, the decrease of ~3 208 cm-1 negative peak integral strength deviated from linear relationship, and began to appear association. Theoretical calculation of structure and Raman spectra of [ M(H2O) n]+( M=Li, K) hydrated clusters showed that Li+ and K+ would form their second hydrated layer while n>4 and n>6 respectively, and O—H stretching vibration occurred blue shift, hydrogen bonding structures should been destroyed, thus was in agreement with the experimental results.
引 言
金属离子在化学和生物化学等领域的作用日益引起科学工作者的关注, 其在许多生物大分子中充当着关键的功能性作用。 溶剂化的金属离子在高浓度生物有机体中, 其存在或消失将从根本上改变生物的机能, 而且溶剂化层的结构和动力学对任何有金属离子溶液的化学过程都是极为重要的。 近年来, 水溶液中金属离子溶剂化结构和动力学的研究, 主要通过仪器测定和计算机模拟, 涉及到中子散射和X射线散射法[1]、 质谱法[2]、 黑体红外辐射分离(BIRD)[3]、 拉曼光谱、 第一性原理计算等。 Hitoshi等[4]通过X射线散射法证实NaCl(6.8 mol· kg-1)溶液中Na+的平均水化数是4.6, KCl(4.56 mol· kg-1)溶液中K+的平均水化数是5.8。 Qiang S[5]用拉曼光谱研究了NaCl对水溶液结构的影响, 得出NaCl的加入主要破坏了水的四面体氢键和促进氢键供体的形成, 并且轻微地减弱了自由氧氢伸缩振动。 Fei[6]等采用B3LYP/aVDZ方法研究了[Cu(H2O)n]2+水合团簇的结构、 电子吸收光谱等性质, 计算结果表明, 无限稀释的CuCl2溶液中[Cu(H2O)n]2+水合团簇的五配位结构为主要成分。 虽然许多研究者对水溶液中金属离子的团簇构型采取了多种方法验证和预测, 但仍存在分歧。
工作中综合利用质谱、 拉曼光谱研究了Li+和K+在水溶液中[M(H2O)n]+水合团簇及其变化趋势, 得到了其在水溶液中水化作用的线性规律。 通过理论光谱验证了溶液团簇构型, 得到了与实验一致的结论。
氯化锂(优级纯, 国药集团化学试剂有限公司)、 氯化钾(优级纯, 国药集团化学试剂有限公司)、 高纯水, 试剂使用前没有进一步纯化。
质谱仪(美国Thermo Scientific公司, 型号为Q Exactive), 离子源为ESI 2, 流速为3 μ L· min-1。 Evolution型显微共焦激光拉曼光谱仪(法国HORIBA Jobin-Yvon公司), 激发波长为532 nm, 激光功率25 mV, 扫描时间10 s, 扫描次数3次, 狭缝50 nm, 50倍的物镜。
ESI是一种离子化技术, 将溶液中离子转变为气相离子, 进而进行MS分析。 将稀释到~10-5 mol· L-1的LiCl和KCl水溶液送入ESI-MS, 依据质荷比m/z, 得到了[M(H2O)n]+水合团簇离子峰的分布, 如图1(a)和(b)所示。 水溶液中阳离子和水分子结合, 存在着不同构型的[M(H2O)n]+团簇离子。 由于仪器设备的限制, m/z低于50的离子峰检测不到, [Li(H2O)1]+和[Li(H2O)2]+离子峰没有出现。 Li离子n> 12以上的水合团簇和K离子n> 13以上的水合团簇未检测到, 推测[Li(H2O)n]+和[K(H2O)n]+的最大水化数可能为12和13。
分别配置浓度梯度相同的LiCl和KCl水溶液进行拉曼光谱分析。 图2为不同浓度LiCl和KCl水溶液频率在2 800~3 800 cm-1范围O— H伸缩振动拉曼光谱。 从上到下浓度依次为0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5和4.0 mol· L-1。 为了便于研究与比较, 所有谱图进行了归一化处理。
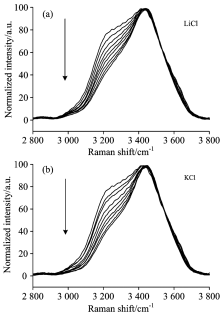 | 图2 纯水和不同浓度氯化盐水溶液体系的拉曼光谱图Fig.2 Raman spectra of pure water and chlorate aqueous solutions with different concentrations (a): LiCl; (b): KCl |
纯水体系中, 水分子之间通过氢键作用形成四面体、 二聚体和多聚体等网络结构, 该网络会被不断地打破和重组, 氢键的键长和强度也发生变化[7]。 随着溶质的加入, 由于M+的水化作用, 水分子会围绕离子形成水化层, 导致水分子间原本氢键网络的破坏。
由LiCl和KCl水溶液的拉曼光谱可知, 随着浓度的增加, ~3 208 cm-1的肩峰逐渐收敛, 当浓度增加到3 mol· L-1时, 肩峰基本消失, 整个OH伸缩振动峰形变窄, 且向高波数移动, 说明盐的加入改变了水原有氢键结构。 为了更好地说明LiCl和KCl的加入对水氢键结构的破坏, 在2 800~3 800 cm-1范围内, 将不同浓度的LiCl和KCl水溶液分别减去纯水的光谱曲线得到差分光谱图3(a)和(b), 按箭头的方向浓度依次增大。
从图3 LiCl和KCl水溶液拉曼差分光谱可以看到, 在2 900~3 425及3 520~3 700 cm-1波数范围内出现了负峰, 随着浓度的增大峰强度减小, 两个峰的中心位置分别位于~3 208和~3 625 cm-1。 在3 425~3 520 cm-1波数范围出现正峰, 随着浓度的增大峰强度增大, 其最大值出现在~3 456 cm-1。
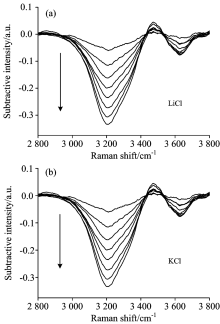 | 图3 不同氯化盐水溶液的拉曼差分光谱 (a): LiCl; (b): KClFig.3 Differential Raman spectra of chlorate aqueous solutions with different concentrations (a): LiCl; (b): KCl |
2 800~3 800 cm-1范围为OH伸缩振动谱带, 3 200 cm-1附近的拉曼峰代表完全氢键化的水分子, 3 400 cm-1附近的拉曼峰代表部分氢键化的水分子, 3 600 cm-1附近的拉曼峰代表自由水分子, 未参与任何氢键网络的形成[8, 9], 其中3 200 cm-1附近的拉曼峰是水结构的代表性指数, 强度越大, 水结构化程度越大[10]。 由此可知上述差分光谱中, ~3 208 cm-1负峰为完全氢键化的水分子比例逐渐减少, 水中氢键结构遭到破坏, 浓度越大破坏越严重, 即水的结构化程度越来越低; ~3 456 cm-1正峰表明有新的微观作用力出现, 但其不同于单纯水分子间的氢键作用力, 强度随浓度的增加变化幅度很小; ~3 625 cm-1负峰表明水溶液中自由水分子的比例减少, 变化趋势也较小。 因此, 氯化盐的加入主要对水结构的代表峰起到了破坏作用。
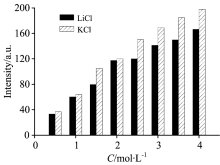
图4是等浓度下LiCl和KCl水溶液O— H伸缩振动拉曼差分光谱。 在同一浓度下两种溶液中~3 456 cm-1正峰和~3 625 cm-1负峰基本重合, ~3 208 cm-1处的水结构代表峰有明显差别。 KCl水溶液中~3 208 cm-1处负峰强度大于LiCl水溶液的强度, 两种水溶液中唯一不同的是阳离子, 因此对水结构代表峰起破坏作用主要是阳离子, 且K+比Li+对水氢键结构的破坏作用更强。 图5是LiCl和KCl溶液O— H伸缩振动拉曼差分光谱中~3 208 cm-1负峰积分强度绝对值随浓度的变化情况, 随着浓度的增加, 两种水溶液负峰积分强度的差值整体为增大趋势。
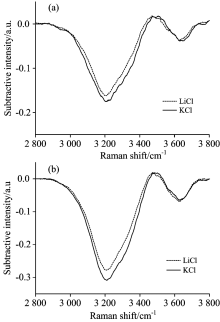 | 图4 同一浓度下LiCl和KCl水溶液O— H 伸缩振动拉曼差分光谱的对比 (a): 1.5 mol· L-1; (b): 3.0 mol· L-1Fig.4 Comparison of difference Raman spectra between LiCl and KCl aqueous solutions (a): 1.5 mol· L-1; (b): 3.0 mol· L-1 |
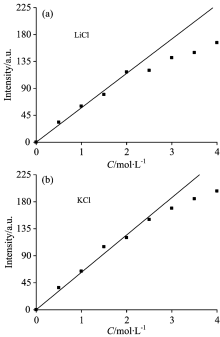
LiCl和KCl水溶液是强电解质水溶液, 一般认为, 强电解质水溶液中仅存在水化和缔合两种行为, 水分子中有两对孤对电子, 而阳离子有空轨道容易与其配对, 因此两种溶液中对氢键结构的破坏主要是因为水化作用的阳离子导致, 与实验结果一致。 进一步对两种溶液不同浓度O— H伸缩振动拉曼差分光谱中~3 208 cm-1负峰积分强度的绝对值进行了线性拟合, 见图6。
由图6可知, LiCl水溶液中, 在浓度小于2 mol· L-1时, 其强度随浓度的增大呈线性增加, 线性相关系数为0.996 1, 浓度大于2 mol· L-1, 逐渐偏离线性关系; 而KCl水溶液中, 在浓度小于2.5 mol· L-1时, 强度随浓度的增大呈线性增加, 线性相关系数为0.995 1, 浓度大于2.5 mol· L-1开始偏离线性关系。 由于~3 208 cm-1负峰积分强度的变化主要是因为M+水化作用形成了水合团簇[M(H2O)n]+, 破坏了原本水的氢键结构, 因此在浓度较低时, 水化作用随浓度的增大呈线性增加, 当浓度较高时, 水化作用减弱[11, 12], 溶液中M+和Cl-以静电作用形成了缔合物, 降低了自由M+的个数[13]。 KCl水溶液在浓度高于2.5 mol· L-1才开始偏离线性关系, 比LiCl水溶液开始偏离的浓度高, 而且偏离的程度较小, 说明K+水化作用更强。
为了进一步了解K+和Li+溶剂层结构对氢键的影响, 采用DFT/B3LYP[14]方法对溶液中[M(H2O)n]+(M=Li, K)水合团簇结构进行了优化和理论拉曼光谱计算。 计算中对Li+, O和H选用6-31G(d, p)基组, K+选用6-311++G(2d, 2p)基组。 [Li(H2O)n]+水合团簇第一水化层有4个水分子, n> 4时水分子开始出现在第二水化层, [K(H2O)n]+水合团簇第一水化层有6个水分子, n> 6水分子开始出现在第二水化层, 这与文献结果一致[15, 16, 17]。 计算得到的[M(H2O)n]+(n=1~6)的优化结构和理论拉曼光谱如图7所示。
 | 图7 [M(H2O)n]+(n=1~6)水合团簇的优化结构和理论拉曼光谱Fig.7 The theoretical Raman spectrum of the optimized [M(H2O)n]+ structure |
与Shimanouchi[18]等得到的水分子O— H对称伸缩振动(ν sym)和非对称伸缩振动(ν asym)峰分别位于3 657和3 756 cm-1相比, 当Li+和K+水化时, O— H伸缩振动峰发生了蓝移。 其中[Li(H2O)n]+水合团簇的第一水化层n=1~4时, O— H对称伸缩振动和非对称伸缩振动峰分别位于3 787和3 868, 3 800和3 884, 3 814和3 906, 3 818和3 915 cm-1, 向高波数移动。 当n=5和6时, 开始第二水化层, O— H伸缩振动峰发生了分裂, [Li(H2O)5]+的ν sym在3 660和3 823 cm-1, ν asym在3 885和3 927 cm-1, [Li(H2O)6]+的ν sym在3 671和3 790 cm-1, ν asym在3 884和3 914 cm-1, O— H伸缩振动峰逐渐向低波数移动。 [K(H2O)n]+水合团簇n=1~6都是第一水化层, O— H伸缩振动峰没有发生分裂, n=1~4时O— H对称伸缩振动和非对称伸缩振动峰分别位于3 793和3 871, 3 798和3 897, 3 802和3 885, 3 806和3 892 cm-1, 一直向高波数移动。 [K(H2O)5]+和[K(H2O)6]+的O— H对称伸缩振动和非对称伸缩振动峰位于3 758和3 894, 3 701和3 879 cm-1, 不再向高波数移动, 而且[K(H2O)5]+的O— H对称伸缩振动峰出现了一个小峰, 这是由于[K(H2O)5]+结构的不完全对称性, 顶点水分子的O— H对称伸缩振动峰。
Zelsmann[19]研究液态水中氢键的振动状态发现, 水中氢键在3 280 cm-1处为对称伸缩振动, 在3 490 cm-1 处为非对称伸缩振动, 这与水分子相比向低波数移动, 表明氢键作用会使O— H伸缩振动峰发生红移。 上述[M(H2O)n]+(n=1~6)理论拉曼光谱的O— H伸缩振动和水分子相比均发生了蓝移, 说明Li+和K+水合团簇对水的氢键结构起到了破坏作用。 当n> 4时, Li+周围的水分子开始第二水化层时, 两层水分子间会有氢键形成, O— H伸缩振动峰与第一水化层相比发生了红移, 而且对称伸缩振动和非对称伸缩振动峰都发生了分裂, 分裂的低波数峰是第一层水分子和第二层水分子间的氢键作用, 这比纯水中氢键作用要弱。 HOMO-LUMO能隙值越小说明电子跃迁越容易发生, 结构越不稳定。 [K(H2O)5]+和[K(H2O)6]+水合团簇的HOMO-LUMO能隙值在K+第一水化层中是最小的两个, 结构不稳定以及键长最大, K+和水分子间的作用比较弱, 而且水合团簇周围水分子比较集中于一处, 氧氢键作用会较强一些, 因此, 理论拉曼光谱的O— H伸缩振动峰不再蓝移。
通过质谱和拉曼光谱实验以及理论计算的研究发现, 当LiCl和KCl加入水溶剂中, 破坏了水溶剂的氢键结构, 生成了[M(H2O)n]+水合团簇, 推测[Li(H2O)n]+和[K(H2O)n]+最大水化数分别是12和13, 其中[Li(H2O)n]+的第一层水化数是4, [K(H2O)n]+的第一层水化数是6。 由于K+水化作用较强, 同一浓度下, KCl水溶液~3 208 cm-1负峰积分强度绝对值大于LiCl水溶液, 而且LiCl和KCl浓度分别在小于2.0和2.5 mol· L-1时, ~3 208 cm-1负峰积分强度绝对值随浓度的增大呈线性增加, 水化作用逐渐增强, 当浓度大于2.0和2.5 mol· L-1时, 线性关系开始偏离, 水化作用减弱。 [M(H2O)n]+理论拉曼光谱图, O— H伸缩振动频率发生了蓝移, 削弱了氢键结构, 证实了[M(H2O)n]+团簇的存在。
致谢: 非常感谢日本福冈大学理学院Toshio Yamaguchi教授在实验和计算过程中给予的建议和帮助。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|