作者简介: 王一鸣, 1993年生, 沈阳师范大学物理科学与技术学院硕士生 e-mail: 18640553363@163.com
卵母细胞及早期胚胎在体外提取时难免受到可见光照明的刺激。 但光照明对其体外发育质量的影响仍不明确。 结合体外培养技术、 无损成像技术(全场光学相干层析系统)及三维重构技术, 在光强与曝光时间一致的条件下, 首次实时原位地, 从形态学角度, 分析了不同可见光谱对小鼠卵母细胞及早期胚胎发育质量的影响。 发现(1)与白光照明相比, 蓝紫光显著降低卵母细胞生发泡破裂及第一极体排出比率, 而在绿光及红光照明下, 生发泡破裂及第一极体排出比率明显提高。 (2)与白光组相比, 蓝紫光组囊胚发生率明显下降, 凋亡程度明显加大, 而绿光及红光组囊胚发生率显著上调, 凋亡程度明显减弱。 这表明蓝紫光对小鼠卵母细胞及早期胚胎发育的损伤最大, 而绿光和红光几乎无损伤。
During the process of in-vitro extraction, oocytes or early embryos can’t avoid the visible light stimulation. However, the effects of light exposure on the development quality in vitro are still unclear. This work used three technologies of in-vitro culture, noninvasive imaging (full-field optical coherence system) and three-dimensional reconstruction. Under the prerequisite of ensuring the same light intensity and the same exposure time, we were the first to use the real-time and in-situ method to study the effects of different visible spectra on the development quality of mouse oocytes and embryos based on the morphology. It was found that (1) compared with the white light illumination, the blue-violet light significantly reduced the rates of the germinal vesicle breakdown and the first polar body extrusion of mouse oocytes. While under the green and red light illumination, these two rates greatly increased. (2) Compared with the white light group, the blastocyst rate reduced and apoptosis increased greatly in the blue-violet light group, while the opposite was true for the green and red light groups. It indicated that blue-violet light was harmful to the development of mouse oocytes and early embryos, while the green light and red light showed little damage.
体外培养是临床及基础研究中非常重要的技术手段。 体外培养可实现卵母细胞或早期胚胎由体内转移至体外发育, 在此过程中, 卵母细胞或胚胎无法避免地将面临多种发育环境的改变, 如pH值、 温度、 氧分压、 光照明等, 这些改变可影响卵母细胞或胚胎的成熟质量[1]。 然而良好的体外成熟质量是众多临床应用及基础研究的必要条件。
目前, 体外培养过程中照明条件的探索是研究热点, 其中照明主要来自太阳光、 室内灯光、 体视显微镜下灯光。 太阳光可通过选择无窗暗室环境排除掉。 实验室照明灯光对卵母细胞或早期胚胎的影响甚微, 因为其在室内灯光下的曝光时间很短, 且有卵巢或输卵管的防护。 卵母细胞或早期胚胎受到的主要光照刺激来自于体视显微镜下的光照明。 已有很多工作研究曝光时间、 光照强度及光谱成分对囊胚发生率、 卵裂球计数、 DNA结构、 活性氧簇(reactive oxygen species, ROS)含量及热休克蛋白70(heat-shock protein 70, Hsp70)的影响[2, 3, 4, 5, 6]。 普遍认为对于早期胚胎, < 500 nm的蓝紫光是可见光谱中的有害成分[3, 4, 5, 6]。 然而现有研究结果仍有瑕疵[3, 4, 5, 6]: 所研究的曝光时间与实际体视显微镜下操作时间不一致。 研究光谱成分对胚胎发育的影响时, 不同光谱的光强不一致且谱宽太大。 研究光照明对囊胚中卵裂球数目的影响时, 卵裂球计数主要通过Hoechst核区染色结合普通荧光显微镜成像实现, 该方法不具备纵向分辨能力, 因此计数不够精准。 目前尚缺少无损且三维原位地研究光照明对囊胚发育质量影响的工作。 再有, 光照明与卵母细胞发育质量间的研究工作也很少见。 可见, 现有的研究结果对认识体外培养过程中光照明对卵母细胞或胚胎发育质量的影响仍不充分。
鉴于此, 本文采用全场光学相干层析成像系统(full-field optical coherence tomography, FF-OCT)记录卵母细胞及早期胚胎的形态发育情况, 结合三维重构技术, 在相同光强与曝光时间的条件下, 分析体外提取过程中, 不同可见光谱成分对卵母细胞的生发泡破裂、 第一极体排出、 囊胚发生率、 卵裂球计数及囊胚凋亡等发育指标的影响。 FF-OCT具有无损非标记且三维高分辨等特点, 可同时采集透明带、 胞质、 核区等结构, 非常适合于卵母细胞及早期胚胎的形态评估研究[7, 8]。 本研究结果可为进一步规范体外培养操作提供重要的参考。
实验动物: ICR雌(雄)性小鼠8(10)周龄(中国医科大学实验动物部)。
卵母细胞: 脱颈椎处死小鼠, 摘取完整卵巢, 置于人输卵管培养液(human tubular fluid, HTF, Millipore)中。 剔除卵巢周围脂肪组织, 清洗后, 无菌针头刺扎卵泡, 释放裸卵。 选择生发泡(germinal vesicle, GV)完整、 形态好的GV期裸卵, 经清洗后, 移入石蜡油(Sigma)覆盖的添加10%胎牛血清(foetal bovine serum, FBS, PAA Laboratories Gmbh)的HTF 微滴中, 并于CO2培养箱内培养16 h。
二细胞期胚胎: 雌雄小鼠合笼, 将可见阴道栓的雌鼠饲养24 h后, 脱颈椎处死, 摘取卵巢及输卵管。 分离卵巢与输卵管, 将玻璃针插入输卵管伞端, 挤出针内F12 (Invitrogen), 冲出二细胞期胚胎。 清洗后, 将形态好的胚胎移入添加20%FBS的HTF微滴中, 石蜡油覆盖后, 于CO2培养箱内培养60 h。
体视显微镜经安装调光器及多组滤光片后, 可使卤素灯(白光)变为蓝紫光(ET430/24X)、 绿光(ET550/15X)及红光(ET630/20X)。 本实验分组为白光组(对照组)、 蓝紫光组、 绿光组和红光组(光谱见图1)。 调节调光器, 使各组样品处光强约为3 mW· m-2。 各组曝光时间均为5 min。 对照组与实验组的样品取自同一只小鼠(排除个体差异的影响): 每只小鼠左侧(右侧)卵巢或输卵管在对照组(实验组)照明条件下完成样品采集。
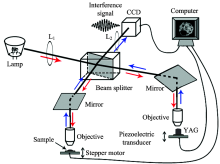
三维图像由FF-OCT(建立于Linnik干涉显微结构基础上, 图2)采集。 光源为250 W卤素灯, 经分束后, 分别射入样品臂和参考臂, 两臂上显微物镜及透镜L1实现柯勒照明。 两臂的反射光干涉, CCD探测干涉信号。 PZT调制参考臂, 步进电机实现样品臂纵向扫描。 横向分辨率为0.7 μ m。 纵向步长为1.1 μ m。
囊胚腔体积占囊胚总体积20%~50%的为早期囊胚。 卵裂球数目由FF-OCT采集的早期囊胚中核区数目确定(图3)。 早期囊胚的凋亡程度以凋亡的卵裂球数目来衡量。 细胞凋亡时, 其体积及细胞核都将收缩[9]。 定义若某卵裂球的细胞核体积小于平均细胞核体积的15%时, 视为凋亡(图3)。
实验数据表示为平均值± 标准误。 卡方检验分析数据间显著差异(SPSS 16.0)。 p< 0.05代表差异显著。
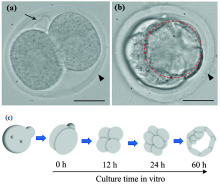
卵母细胞的体外发育过程(图4): GV期卵母细胞, 体外孵育4 h左右, 生发泡破裂(germinal vesicle breakdown, GVBD), 继续孵育12 h左右, 排出第一极体(first polar body extrusion, PB1), 发育为成熟的卵母细胞。 实验检测了卵母细胞的GVBD和PB1情况。 发现(表1), 白光组GVBD比率达82%远多于蓝紫光组74%, 但少于绿光组和红光组(均为88%, p< 0.05)。 白光组PB1比率约为63%, 明显大于蓝紫光组53%, 但小于绿光组75%和红光组74%(p< 0.05)。 体外提取时, 为满足实验员的视觉观察, 体视显微镜必须使用可见光(400~700 nm)为光源。 基于形态学的研究结果表明, 可见光中蓝紫光成分对卵母细胞体外成熟是有害的。
| 表1 体外培养卵母细胞成熟质量的形态评估 Table 1 Assessment of maturation quality of cultured oocytes based on morphology |
早期胚胎体外发育过程(图5): 合子经历二细胞期、 四细胞期、 八细胞期发育至囊胚。 为避免二细胞阻滞的影响, 统计了二细胞发育至早期囊胚的比率, 并通过卵裂球数目及凋亡程度评估早期囊胚质量。 发现(表2), 白光组早期囊胚发生率为83.7%, 远多于蓝紫光组74.5%, 但小于绿光组91.7%和红光组90.2%(p< 0.05)。 白光组早期囊胚中卵裂球数目约为45.6± 3.0, 与蓝紫光组43.1± 3.3、 绿光组46.0± 2.9和红光组47.1± 2.9无显著差别。 白光组早期囊胚中凋亡卵裂球数目约为2.7± 0.7, 明显少于蓝紫光组4.6± 0.9, 但多于绿光组0.9± 0.6和红光组1.3± 0.7(p< 0.05)。
| 表2 体外培养早期胚胎发育质量的形态评估 Table 2 Assessment of development quality of cultured embryos based on morphology |
可见光可诱发细胞内ROS增多, 损伤DNA结构, 这将引起胚胎发育迟缓、 停滞、 卵裂球凋亡、 坏死等现象[10, 11]。 不同波长可见光对胚胎损伤性也不同。 通常认为蓝紫光对胚胎损伤最大, 因为蓝紫光靠近DNA吸收峰, 诱导卵裂球产生H2O2, 破坏线粒体能量代谢[10, 11, 12]。 这可能是蓝紫光组囊胚发生率下降, 凋亡程度增大的原因。 可能由于绿光及红光的光子能量低, 波长远离DNA吸收峰, 对胚胎发育的损伤小, 所以绿光组及红光组中囊胚发生率高, 凋亡程度低。
可见光中蓝紫光成分不利于小鼠卵母细胞及早期胚胎发育, 影响卵母细胞核成熟质量(GVBD及PB1比率下降)及早期囊胚质量(囊胚发生率下降, 凋亡程度增加)。 而绿光及红光对小鼠卵母细胞及早期胚胎体外发育影响较小。 因此, 可参考将体视显微镜的白光改为绿或红光照明, 这将有利于完善体外培养技术。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|