作者简介: 刘叶, 1993年生, 宝鸡文理学院化学化工学院硕士研究生 e-mail: liuyevip@163.com; yiliuthem@whu.edu.cn
DNA是生物体遗传信息的载体, 研究药物与DNA的相互作用对探讨其作用机理及新药的设计合成具有重要意义。 利用紫外吸收光谱技术, 微量量热法, 等温滴定量热法以及分子模拟技术研究了乌头碱在水溶液中的溶解行为, 探讨了乌头碱与粘虫DNA、 鲑鱼精DNA、 小牛胸腺DNA的相互作用。 实验发现, 乌头碱在水溶液中的溶解过程为准一级反应, 半衰期( t1/2)为0.691 h。 乌头碱分别与三种DNA作用均为体现出沟槽和表面两种结合形式: 沟槽结合时, 结合常数Ka1为105, 结合位点数为0.40~0.60, 且反应为焓驱动的自发过程; 表面结合时, 乌头碱分子仅与DNA表面发生作用而并未嵌到DNA分子的疏水部分, 结合常数Ka2为103, 结合位点较大。 分子模拟显示, 乌头碱均以氢键作用力结合在三种DNA分子的沟槽区, 且乌头碱分子中C8上的酯基对粘虫DNA, 鲑鱼精DNA和小牛胸腺DNA链上的碱基有特异性识别, 依次为T33, T34和G16, C9, C8。 模拟计算获得反应的结合能与实验测定所得Δ G值接近, 同时, 依据实验数据判定的作用力类型在分子模拟中得到印证, 即理论计算与实验基本吻合。
DNA is a vector for the genetic information of organisms. It is important to study the interaction between drugs and DNA and to explore its reaction mechanism, the design and synthesis of new drugs. The dissolution behavior of aconitine in water was studied for the first time by microcalorimetry. By using isothermal titration calorimetry, UV-Vis Absorption Spectroscopy and molecular simulation, the interaction between aconitine and armyworm DNA, salmon sperm DNA and calf thymus DNA was discussed. The results showed that the dissolution process of aconitine in aqueous solution was a simple first-order reaction and t1/2=0.691 h. There were two types of combinations during interactions between aconitine and the three different DNAs. The type Ⅰ combination was found to bean enthalpy-driven process. The equilibrium constant of combination (Ka1) was larger with the value of about 105. The number of binding sites ( n1) was 0.40~0.60. The reaction took place in the groove areas. With regard to type II combination, the values of Ka2 was 103, and n2 was larger than n1. Lower equilibrium constant of combination demonstrated that the drug ligands just reacted with DNA on the surface instead of entering into the interior of macromolecules. Molecular simulation studies showed that the combination of aconitine and three DNAs occurred in the groove areas. The hydrogen bondwas mainly interactions during interactions between aconitine and the three different DNAs, and the ester groups on the C8 of the aconitine molecule were related to the armyworm DNA, the salmon sperm DNA and the calf thymus DNA respectively. Their bases were specifically identified by T33, T34 and G16, C9, C8. The similarity between the calculated binding energy and the measured Δ G demonstrated that the theoretical calculations were consistent with the experimental results. It can be seen that there is good agreement between the theoretical calculations and experimental results in this work.
DNA是生物体内最重要的生物大分子之一, 是绝大多数生物遗传信息的载体, 对生物的遗传进化起着重要的作用。 许多外源性的小分子可以与DNA结合, 这种相互作用能引起DNA的断裂, 或者改变DNA的结构, 破坏其作为核酸模板的功能, 影响DNA复制和转录等功能, 导致机体畸形或是癌变。 国际癌症研究中心证明, 杀虫剂二甲胂酸可以导致小鼠的皮肤和肺以及大鼠的肝、 肾、 胸腺和膀胱产生肿瘤[1]。 Cabello等[2]分别向SD雌性大鼠腹腔注射毒扁豆碱、 对硫磷、 阿托品, 发现以上药物造成大鼠乳腺终端小芽细胞增生, 在大约28个月后大鼠乳腺癌发病率分别为8.6%, 14.3%和24.3%。 另有据报道, 异丙威和三唑磷与小牛胸腺DNA以嵌插作用结合, 产生DNA加合物使DNA损伤, 最终导致基因突变[3, 4]; 因此, 探讨药物与DNA的相互作用, 可在分子水平上提前进行药物筛选或是分子设计改性, 以此来预防基因受损后对生命环境造成的恶果。
毛莨科植物乌头(Aconitum)富含具有杀虫效果的生物碱[5, 6, 7, 8, 9], 以杀虫效果最强的乌头碱(Aconitine)为代表。 近来年关于乌头碱的研究主要集中在分离方法、 临床医学实验、 杀虫活性等的探讨中。 许勇华等[10]对川乌生物碱的提取以及杀虫活性进行了系统的研究, 探究了乌头生物碱对甜菜夜蛾的胃毒、 拒食、 触杀、 熏杀作用以及对幼虫的生长抑制作用, 分别得到乌头碱, 次乌头碱和中乌头碱的毒杀致死中浓度。 然而, 乌头碱若要发展为农用杀虫剂, 其是否对周围环境中的有益生物安全无害, 对生物基因是否产生破坏理应成为关注的重点。
据此, 应用紫外吸收光谱法, 等温滴定量热法, 微量量热法和分子模拟技术, 测定乌头碱的溶解半衰期, 探讨乌头碱与三种DNA相互作用机理, 得出等温条件下乌头碱与DNA作用过程的各种热力学函数(Δ H, Δ S, Δ G), 动力学参数, 作用方式以及反应的驱动力。 以此评价乌头碱用作杀虫剂的可能性, 为天然产物的合理开发提供理论依据。
UV-2550紫外-可见分光光度计(日本岛津)、 Nano ITC等温滴定微量热仪(美国TA公司)、 C80微量量热仪(法国Setaram)。
粘虫DNA(按照酚-氯仿抽提法提取[11])、 鲑鱼DNA、 小牛胸腺DNA(Sigma-Aldrich公司, 生物试剂)、 HPLC98%乌头碱(辰光生物科技有限公司)、 Tris-HCl缓冲溶液(pH7.4), 超纯水(ULUP-I-5/10/20T超纯水处理系统)。
1.2.1 微量量热法
乌头碱在水中的半衰期通过微量热法测定[12, 13], 采用动力学方程描述乌头碱在甲醇溶剂中的溶解速率。 根据下列动力学方程
其中α =H/H0, 由式(1)和式(2)可得式(3)
该系统的反应级数(n)为斜率, 该系统的截距为lnk。 由此获得动力学方程(4), 乌头碱的半衰期由式(5)得到
式(5)适用于一级反应, k为反应速率常数。
1.2.2 紫外吸收光谱法
DNA浓度的测定: 取一定粘虫DNA经Tris-HCl缓冲溶液(pH 7.4)稀释后进行紫外吸收测量, 参比为同体积的缓冲溶液。 小牛胸腺DNA和鲑鱼精DNA浓度测定同上。
乌头碱和DNA的相互作用测定: 取一定量DNA, 将浓度为1.07× 10-3 mol· L-1的乌头碱按一定量逐次滴加, 待反应5 min后进行紫外吸收测量。
1.2.3 等温滴定量热法
采用等温滴定量热技术, 确定反应的结合常数Ka、 结合位点数n、 反应焓变Δ H、 熵变Δ S, 用来表征分子间的相互作用[14, 15, 16, 17, 18, 19]。 试剂均由脱气设备处理后使用。 25 ℃时, 样池中加入一定量DNA, 注射器中装有100 μ L乌头碱溶液; 参比池中加入同样池中等量的缓冲溶液。 经滴定量热实验可分别得到乌头碱与粘虫DNA、 鲑鱼精DNA、 小牛胸腺DNA的作用曲线。 使用NanoAnalyze软件将实验所得数据进行分析, 得到乌头碱滴定DNA的热力学参数。
1.2.4 分子模拟技术
使用Auto Dock Tools软件对小牛胸腺DNA晶体结构添加氢原子以及Gasteiger(电荷小牛胸腺DNA的晶体结构由RSCB Protein Data Bank获得)。
伪粘虫DNA和鲑鱼精DNA的构建如下: 由Sybyl 8.1软件的Biopolymer Build程序按照标准B型双链DNA结构进行构建[20]。
伪粘虫DNA序列(由NCBI数据库获得):
ATGCCCCAACTCAACCCCGCCCCCTGATTTGCTATTTTAGTATTCTCATGACT
GGTTTTCCTAACTGTTATTCCTCCTAAAGTACTCGGCCACACCTTCACAAAT
GAGCCTACTTCACAAAGCACTGAAAAAGCTAAACCTGAACCCTGAAACTG
ACCAT GACACTAA
鲑鱼精DNA序列(由NCBI数据库获得):
ATGCCCCAACTCAACCCCGCCCCCTGATTTGCTATTTTAGTATTCTCATGACT
GGTTTTCCTAACTGTTATTCCTCCTAAAGTACTCGGCCACACCTTCACAAAT
GAGCCTACTTCACAAAGCACTGAAAAAGCTAAACCTGAACCCTGAAACTG
ACCAT GACACTAA
使用Powell方法, 分别对DNA添加电荷并进行能量最小化, 得到伪粘虫和鲑鱼精的DNA晶体图, 最终DNA的能量分别为-5.906× 103和-6.358× 103 kJ· mol-1。
使用Auto Dock Tools软件对所构建的DNA晶体结构添加氢原子以及Gasteiger电荷。 乌头碱的结构由Sybyl 8.1软件进行构建, 添加Gasteiger Marsili电荷, 使用Tripos力场对结构进行最小化能量优化, 优化结构总能量为378.65 kJ· mol-1, 使用AutoDock Tools软件对乌头碱分子的可旋转建进行分配。
分子对接[21, 22, 23, 24, 25], 使用AutoDock4.2软件对乌头碱分子与小牛胸腺DNA、 伪粘虫DNA、 鲑鱼精DNA分别进行分子对接, 分子对接位点的活性区域包含整个DNA分子, 活性区域大小为40× 40× 160 Å 3, 格点步长为0.375 Å 。 采用初始种群数为1 500的GA-LS算法, 进行50次运算, 最大传代数及能量收敛值分别为2.7× 104和2.5× 106。 通过基于小分子非氢原子的均方根偏差值(RMSD)对所得的50个聚类模式进行聚类分析, 分析所得个体数最大、 能量最低的结合模式作为乌头碱分子的结合位点。
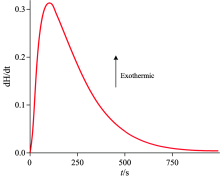
采用实验方法1.2.1, 用C80微量量热仪(Setaram)得到实验数据如图1及表1所示。 其中, 反应池中依次加入30, 40, 50, 60 μ L浓度为8.55× 10-6 mol· L-1乌头碱的甲醇溶液和1.5 mL的纯水; 参比池中依次加入30, 40, 50和60 μ L甲醇与1.5 mL纯水。
从表1可知, 乌头碱在纯水中的焓变不随乌头碱的量变而变, 因此其反应的摩尔焓变可用平均摩尔焓变替代, 即Δ Hm, 纯水为3.647× 103 kJ· mol-1。
| 表1 乌头碱反应的焓变 Table 1 Enthalpy variation of aconitine in the entire reaction process |
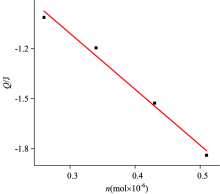
使用表1中的数据, 将物质n的量相对于热Q绘制, 并且所得图表示于图2中。
图2显示了n和Q之间良好的线性关系, 反应的热释放随物质量的增加而增加。 将实验数据(dH/dt)i和(H/H0)i写入式(1), 然后将ln[(1/H0(dH/dt)i]对ln[1-(H/H0)i]作图, 该反应级数n斜率, 截距为lnk, 最后反应级数(n)和k及其结果如表2所示。 k, n的平均值被写入动力学方程(4)。 得到乌头碱在水(pH 7.4) 中的反应动力学方程(6)
动力学方程(4)为准一级反应, 乌头碱的半衰期可以通过式(3)得到, 其值为t1/2=0.691 h。
| 表2 20 ℃, 常压下乌头碱反应的动力学数据 Table 2 Kinetic data of the reaction of aconitine at 20 ℃ under atmospheric pressure |
2.2.1 DNA的浓度测法
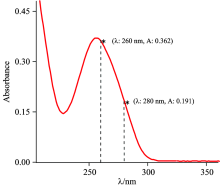
(1) 常温下, 采用1.2.2之方法, 使用pH 7.4的Tris-HCl缓冲溶液, 将提取的粘虫DNA稀释至一定浓度, 使用UV-2550紫外可见分光光度计测量溶液在260和280 nm处的吸光度值(图3), 二者比值在1.8~1.9之间, 说明DNA的纯度达到实验要求; 用260 nm处的吸光度值(DNA在260 nm的摩尔吸光系数为6 600 mol-1· cm-1), 根据朗伯-比尔定律, 计算得到粘虫DNA的浓度。
从图3可知, 粘虫DNA在260和280 nm处的吸光度分别为0.362和0.191, 则A260/A280=1.895此比值介于1.8和1.9之间, 说明粘虫DNA的纯度符合实验要求。 同时, 用260 nm处的吸光度计算得粘虫DNA浓度为5.17× 10-5 mol· L-1。
(2)鲑鱼精DNA、 小牛胸腺DNA的纯度及浓度测定
考虑到乌头碱对周围其他有益生物的影响, 在探究乌头碱对粘虫DNA的作用时, 也运用相同的方法分别探讨了乌头碱对鲑鱼精DNA, 小牛胸腺DNA的作用。 用紫外光谱法扫描鲑鱼精DNA储备液和小牛胸腺DNA储备液在 260 nm 处的吸光度值, 计算得到DNA的浓度: c鲑鱼精DNA=5.17× 10-5 mol· L-1, c小牛胸腺DNA=5.36× 10-3 mol· L-1。
2.2.2 紫外光谱法确定乌头碱与DNA作用类型
常温下, 利用1.2.2方法, 配制浓度为1.07× 10-3 mol· L-1的乌头碱溶液备用。 在样品池中分别加入上述三种DNA溶液各3 mL, 且依次加入5 μ L配制好的乌头碱溶液, 混合均匀并反应5 min测其紫外吸收变化, 参比池内为3 mL Tris-HCl缓冲溶液。 结果如图4所示。
 | 图4 乌头碱与DNA反应的紫外吸收谱图 (a): 粘虫DNA; (b): 鲑鱼精DNA; (c): 小牛胸腺DNAFig.4 UV-Vis absorption spectra of aconitine into DNA (a): DNA of Pseuo armyworm; (b): DNA of salmn sperm; (c): DNA of calfthymus |
从图4可知, 随着乌头碱溶液浓度的增大, 粘虫DNA的紫外吸收图谱发生增色蓝移的现象, 同时发现, 鲑鱼精DNA、 小牛胸腺DNA的紫外吸收也发生了相同的变化, 即增色蓝移, 说明乌头碱与三种DNA的作用方式均为非经典嵌插。
2.2.3 ITC法乌头碱与DNA作用动力学
采用ITC法进行实验, 25 ℃下, 将4.50× 10-4 mol· L-1的乌头碱溶液取100 μ L置于注射器中, 样池中加入1 mL DNA溶液, 用乌头碱溶液滴定DNA, 每次滴加5 μ L共25次, 每次间隔400 s, 参比池中同样加1 mL Tris-HCl缓冲溶液(pH 7.4)。 采用上述同样的方法用乌头碱溶液滴定缓冲溶液作为对照试验, 扣除稀释热。 结果如图5, 表3。
 | 图5 乌头碱滴定DNA的反应曲线 (a): 粘虫DNA; (b): 鲑鱼精DNA; (c): 小牛胸腺DNAFig.5 ITC data for aconitine into DNA (Tris-HCl, pH 7.40) at 25 ℃ (a): DNA of Pseuoarmyworm; (b): DNA of salmn sperm; (c): DNA of calf thymus |
| 表3 乌头碱和DNA反应的动力学参数 Table 3 Thermodynamic parameters of Aconitine-DNA System |
表3显示了一个有趣现象: 乌头碱对粘虫DNA、 鲑鱼精DNA、 小牛胸腺DNA作用时, 均呈现结合位点n2大于n1, Ka1大于Ka2的倾向。 说明第1类结合要比第2类结合稳定牢靠。 这是因为, 在第2类结合中, 药物分子仅与DNA表面发生作用而并未嵌到DNA分子的疏水部分, 由于作用物之间相互作用于表面, 容易形成较大的结合位点数, 但作用力分散亲合力较弱。 然而当药物小分子以非经典嵌入到DNA双螺旋结构并与碱基对相结合时, 则能成为较稳定的第1类结合。
对于第一类结合, Δ H1< 0, Δ S1< 0, Δ G1< 0是一个放热明显的过程, 且结合平衡常数较大, 约为105, 这可能是因为药物小分子和ctDNA的相互作用发生在沟槽区域, 表2中给出的两者反应的热动力学参数与文献报道的胡椒碱和ctDNA的相互作用的热动力学参数类似[26], 因此可推测乌头碱结合在DNA的沟槽区, 且表现为焓驱动过程。
对于第二类结合, Δ H2> 0, Δ S2> 0 是吸热且熵增明显的过程, 结合平衡常数较小, 表明药物配体小分子只与DNA表面发生作用而未进入大分子内部, 故表现为熵驱动过程。
2.2.4 分子计算
采用1.2.4分子对接方法分别进行三种DNA和乌头碱分子的对接计算, 结果如图6、 表4所示。
 | 图6 乌头碱分子与DNA的分子对接 (a): 伪粘虫DNA和乌头碱; (b): 鲑鱼精DNA和乌头碱; (c): 小牛胸腺DNA和乌头碱Fig.6 Docking results between Aconitine and DNA (a): DNA of Pseuo armyworm; (b): DNA of salmnsperm; (c): DNA of calfthymus |
| 表4 DNA和乌头碱的分子对接参数 Table 4 The molecular simulation results of Aconitine-DNA System |
将2.2.2和2.2.3实验结论对照图6、 表4的分子计算结果, 发现模拟计算获得反应的结合能与实验测定所得的Δ G接近, 同时, 依据实验数据判定的作用力类型在分子模拟中得到印证, 即理论计算与实验基本吻合。
经紫外吸收光谱法、 等温滴定量热法以及分子模拟技术, 获得大量有用数据和佐证, 归纳如下: (1)从图6可以看出, 乌头碱与DNA分子的结合发生在大沟槽当中, 而DNA的骨架结构基本不变, 与紫外法得到的结论完全一致; (2)从图6、 表4给出的计算结果可见, 乌头碱分子与DNA结合的主要贡献来源于氢键、 范德华力作用。 同时三种DNA分别与乌头碱作用时, 静电作用几乎可以忽略, 这与表3数据分析结果基本一致; (3)计算获得的结合能与实验测定所得的Δ G接近, 即理论计算与实验基本吻合; (4)乌头碱易被水解, 对环境相对友好, 符合杀虫剂选项。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|