作者简介: 王 欢, 1991年生, 宝鸡文理学院化学化工学院硕士研究生 e-mail: 15829499347@163.com
利用荧光光谱法, 紫外可见光谱法, 红外光谱法, 圆二色谱法和等温滴定量热法等手段, 对抗癌药物盐酸阿霉素 (DOX) 与DNA的作用过程进行研究, 测得了它们的结合常数 Ka、 结合位点数 n、 反应焓变Δ H、 熵变Δ S及Δ G, 且在结合过程中, B型DNA的螺旋结构在一定程度发生改变。 荧光光谱的数据显示出显著的猝灭效应, 表明DNA是一个DOX荧光的很好的猝灭剂。 红外光谱表明阳离子DOX+通过静电吸引与 DNA 的磷酸基团相互作用, 且DOX的碳氢链通过疏水缔合与DNA作用。 ITC测定了DOX和DNA相互作用的焓变和熵变, 表明DOX的烃链和DNA的碱基之间的疏水性相互作用提供了结合的驱动力。
The interaction processing of anti-cancer drug doxorubicin hydrochloride (DOX) with DNA was systematically investigated using fluorescence spectroscopy, ultraviolet-visible spectroscopy, infrared spectroscopy,circular dichroism and isothermal titration calorimetry measurements. The binding constant Ka, the binding-site number n, the reaction enthalpy Δ H and the reaction entropy Δ S of the interaction were obtained. In the binding process, the helix of B-DNA can have a certain degree of structural variations. The data of fluorescence spectrum indicated that DNA was a good quencher for the fluorescence of DOX. IR data certified the cation DOX+ binding with the phosphate groups of DNA through strong electrostatic attraction, while the C—H bonds of DOX may be associated with the bases of DNA by hydrophobic interaction. The Changes of enthalpy and entropy of the binding process were determined by ITC, which indicated that the process was driven by the hydrophobic interactions between the hydrocarbon chain of DOX and the bases of DNA.
引 言
人体所有的生命活动几乎离不开生物体内的大分子蛋白质、 核酸等的参与[1, 2, 3], 其中DNA是绝大多数生物遗传信息的载体, 对生物的遗传进化起着重要的作用, 是许多具有抗癌活性的药物的靶分子。 抗癌药物通过插入、 沟面结合等模式与癌细胞结合, 使DNA的物理化学性质发生改变, 从而破坏其作为核酸模板的功能, 导致癌细胞、 突变或者死亡[4, 5, 6, 7, 8]。 利用化学、 药理学、 药代动力学及生物化学等科学领域的基础理论, 研究药物分子与生物大分子DNA之间相互作用的方法和规律已经成为科研工作者热衷的方向。 Tomoki Nishimura[9]应用核磁共振氢谱和量热法研究了替洛隆与DNA的相互作用; Ding[10]研究了离子液体与DNA的结合机理; Cristina Pé rez-Arnaiz[11]研究了阿霉素与DNA的两种结合产物。
盐酸阿霉素(DOX)是一种蒽环广谱抗肿瘤药物, 插入DNA而抑制核酸的生成, 这种作用机制最终可以导致癌细胞的死亡, 对多种癌细胞具有杀灭作用[12, 13, 14]。 尽管有大量关于其前体和衍生物的研究, 但其与DNA的作用机理尚不明确[15]。 因而, 使用研究DNA与DOX的作用机理, 具有重要意义。
UV-2550型紫外-可见分光光度仪(日本, Shimadzu公司), 圆二色谱仪(英国, Applied photophysics公司), Fluromax-4 荧光光谱仪(英国, Horiba公司), Nano ITC(美国, TA 公司), 傅里叶红外光谱仪(美国, PerkinElmer公司)。
盐酸阿霉素(AR)、 小牛胸腺DNA, 简称DNA(AR), 三羟甲基氨基甲烷(AR), 盐酸(AR), 所有溶液均由超纯水配制, 所有储液均在4 ℃低温保存。
紫外-可见光谱实验用UV-2550型紫外-可见分光光度计。 以0.05 mol· L-1 Tris-HCl缓冲溶液控制pH为7.4, 固定DOX浓度为7.8× 10-3 mol· L-1, 逐渐增加固定浓度小牛胸腺 DNA 溶液(0~30 μ L)。
粘度实验在25 ℃的水浴中用乌氏粘度计完成, Tris-HCl缓冲溶液、 DNA溶液和不同比例的DOX+DNA溶液的流出时间通过秒表测量, 平行测三次求其平均值。
圆二色光谱实验在Applied photophysics公司的圆二色谱仪上进行, 测量使用1 mm光程的石英比色皿, 在温度25 ℃进行, 体系的测定通过滴加微量的DOX到已知浓度和体积的DNA溶液中进行。
荧光光谱实验在Fluromax-4荧光光谱仪上进行。 激发波长为467 nm; 固定DOX浓度为1× 10-5 mol· L-1; 用0.05 mol· L-1 Tris-HCl缓冲溶液稀释配制不同浓度的DNA溶液, 测定发射波长在480~780 nm范围内DOX与不同浓度的DNA 结合的荧光发射光谱。
等温滴定量热实验在25 ℃下Nano ITC上进行。 为避免溶液中气泡影响滴定体积, 所有溶液要事先脱气。 DOX溶液装入250 μ L的注射器中, DNA溶液装入样品池中, 设定滴定时间间隔为300 s/5 μ L, 在持续搅拌的情况下滴加DOX药物于样品池中, 共滴50次。 对比实验通过测定DNA+缓冲溶液以及DOX+缓冲溶液的稀释热, 通过校正稀释热, 得到结合等温线, 所有的数据使用NanoAnalyze软件分析。
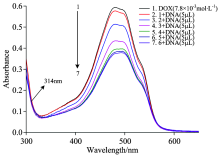
在pH 7.4的Tris-HCl缓冲溶液中, 扫描并记录DNA滴定DOX的紫外可见吸收图谱, 我们观察到依次加入DNA后, DOX在314 nm 出现等吸光点, 并在480 nm处显示电荷转移带, 如图1。
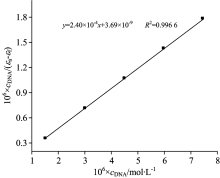
根据公式[16]
式中: cDNA为DNA的浓度, ε f, ε a和ε b分别代表自由态、 与DNA完全结合和部分结合化合物的摩尔消光系数, 以cDNA/(ε a-ε f)对cDNA作图(图2), 截距可得DOX与DNA体系的结合常数Ka为6.50× 104 mol-1· L。
通常我们可以依据粘度变化确定DNA与药物的结合方式。 实验于超级恒温水浴中恒温25 ℃进行, 以Tris-HCl缓冲液作空白测定t0, DNA溶液测定tcontrol, 不同比例DNA+DOX测定tcomplex, 每个样品连续测定三次取其平均值, 计算η 'sp(DOX存在) 和η sp(DOX不存在) 时的增比粘度。 利用方程[17]
DNA/DOX体系的粘度关系经由(η 'sp/η sp)1/3对cDOX/cDNA作图[11]得图3。
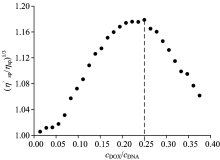 | 图3 DNA/DOX体系的相对粘度与cDOX/cDNA浓度比关系Fig.3 Relationship between the concentration ratio of DNA/DOX and relative viscosity |
图3显示出两个不同的效果, cDOX/cDNA比率在0~0.25, 复合物粘度增大, 在此过程中DOX嵌插进DNA的碱基, 促使复合物的粘度增大; 当cDOX/cDNA大于0.25, 相对粘度下降, 揭示了第二种类型的DOX/DNA络合物的形成。 这种现象表明了形成不同类型的DOX/DNA复合物, 其形成以第一种复合物为前提。 在这个模式中, DOX是部分地嵌插并且形成聚集的复合物。
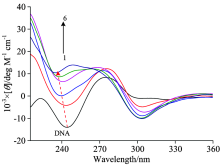
控制cDNA=7.2× 10-4 mol· L-1, pH 7.4和t=25 ℃, 逐渐滴加微量的DOX溶液, 利用圆二色谱仪得到DNA溶液与DNA+DOX溶液的CD光谱(图4)。
DNA的CD光谱包括一个由于碱基堆积出现在275 nm的正峰和一个由于DNA的螺旋性出现在245 nm的负峰。 随着药物浓度的增加, 245 nm处负峰强度减小, 275 nm处的正峰增加, 并且发生红移现象, 说明DNA的结构趋于紧密, 发生B-DNA向着A-DNA转变的趋势。 当DOX与DNA发生嵌插结合作用时, 使其双螺旋结构变得更加紧凑, 其构象了也发生了改变, 因而使DNA的CD谱中负峰强度大大增加。 这与粘度法得出的反应有嵌插结合的结论是一致的。
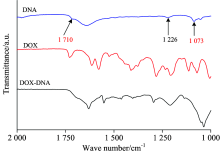
为了弄清反应驱动力的来源, 采用红外光谱仪测得了DNA和DOX及反应物的红外光谱如图5。
图5为DNA, DOX和DOX-DNA复合物的傅立叶红外光谱。 根据文献[18]知B-型DNA特有的吸收谱带分别为1 073, 1 226和1 710 cm-1; 1 073和1 226 cm-1为DNA磷酸骨架对称伸缩振动和非对称伸缩振动的特征峰, 1 710 cm-1是碱基的面C=O和C=N的伸缩振动。 当DOX加入到DNA中, 磷酸骨架1 073 cm-1的对称伸缩振动消失, 1 226 cm-1处的非对称伸缩振动几乎不受影响。 这显示阳离子DOX+与DNA的磷酸骨架发生结合, 它们之间存在静电吸引, 而1 226 cm-1的非对称伸缩振动未发生改变, 表示DOX+与DNA的磷酸骨架的静电相互作用是有限的, 并且反应在特定的程度改变DNA的螺旋结构。 在1 710 cm-1吸收谱带表明碱基反应消失, DNA双螺旋部分变性; 同时说明DOX的碳氢键与DNA的碱基通过疏水作用结合。 因此, 在DOX与DNA的结合过程中DOX+与DNA的磷酸骨架的静电作用是基础的, 在DOX的碳氢键与DNA的疏水性碱基之间的疏水作用可能作为驱动力[10]。
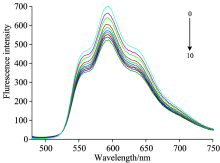
图6为发射波长在480-780 nm范围内DOX与不同浓度的DNA结合的荧光发射光谱。
由图6可见, 随着DNA浓度的增加, 荧光强度也不断降低。 说明DNA对DOX荧光强度具有明显的猝灭作用, 是DOX荧光的良好的猝灭剂。 图7揭示了两种不同的效应, 当cDOX/cDNA< 0.25时, 荧光减弱很快, DNA/DOX体系的荧光显著猝灭; 当cDOX/cDNA> 0.25时, 荧光减弱趋于平缓, 几乎不发生变化, 也说明DNA与DOX之间发生了相互作用, 形成新的稳定复合物。
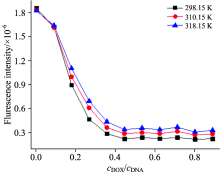 | 图7 DNA/DOX体系的荧光强度与cDOX/cDNA比值的关系Fig.7 Relationship between fluorescence intensity and concentration ratio of cDOX/cDNA |
为了弄清DOX与DNA的猝灭机制, 采用Stern-Volmer方程[19]
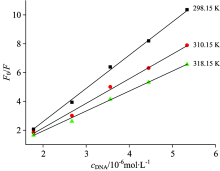
考察不同温度下荧光强度与DNA浓度间的变化规律, 以F0/F对cDNA作图(图8), 可求出猝灭速率常数Kq和Sterm-Volmer 猝灭常数KSV, 结果见表1。
| 表1 不同温度下DOX与DNA的猝灭常数 Table 1 Quenching constants of DOX and DNA at different temperatures |
由表1可以看出, 猝灭常数KSV的值随温度的升高而降低, 表明该猝灭过程不受扩散控制。 不同温度下的Kq均远远大于2.0× 1010 L· (mol· s)-1(扩散控制的各类猝灭剂对生物大分子的最大碰撞猝灭常数), 这进一步表明DOX与DNA体系的荧光猝灭过程是静态猝灭过程, 而不是动态碰撞猝灭[20]。
为此, 采用修正后的荧光静态猝灭方程[21]
用
| 表2 不同温度下DOX与DNA的结合常数与结合位点数 Table 2 Binding constant and binding-site numbers of DOX and DNA at different temperatures |
利用Van’ t Hoff方程 , 计算DOX与DNA相互作用的焓变和熵变, 结合热力学公式得出反应的吉布斯自由能变化, 结果列于表3。
| 表3 不同温度下DOX/DNA体系的热力学参数 Table 3 Thermodynamic parameters of DOX/DNA at different temperatures |
从表中可看出, DOX与DNA结合过程中Δ H< 0, Δ S> 0, 表明该过程的主要驱动力为静电作用力[22, 23]。 同时由于过程放热而降低了DOX与DNA复合物的能量, 有助于稳定复合物。
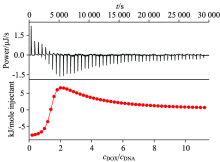
DOX与DNA作用的等温滴定量热曲线见图9, 采用NanoAnalyze软件分析得到的热力学参数列于表4。
| 表4 25 ℃下DOX结合DNA的热力学参数 Table 4 Thermodynamic parameters of the binding of DOX and DNA |
对于第一类结合, Δ H1< 0, Δ S1> 0是一个稍有放热而熵增明显的过程, 且结合平衡常数较大, 这两种情况都会引起过程放热, 所以第一类结合表现为焓-熵协同驱动过程, 驱动作用力主要为静电作用。
对于第二类结合, Δ H2> 0, Δ S2> 0 是吸热且熵增明显的过程, 结合平衡常数较小, 这可能是因为DOX的疏水平面部分较深地嵌插至DNA分子的疏水部分, 并且DOX进入之后又会使原来处于较深层疏水空腔的全部或部分溶剂水分子进入溶液本体, 转变为自由水分子, 使混乱度增加, 故表现为疏水作用为主的熵驱动过程。
一定的温度和压力下, 两类结合的Δ G值均为负值, 说明两类结合过程均可以自发地进行, 且生成的产物分子结构比较稳定。
通过不同的分析技术研究DNA与DOX的结合特征和机理。 研究表明, DOX可嵌入DNA的双螺旋结构中形成两种复合物, 取决于cDOX/cDNA的比值, 且其能诱使DNA的微环境与构象发生变化。 DOX与DNA相互作用存在的驱动作用力主要为静电作用和疏水效应的两种模式。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|