作者简介: 谢志勇, 1995年生, 九江学院药学与生命科学学院本科生 e-mail: 2633967902@qq.com; 谢丽琴, 女, 1976年生, 九江学院药学与生命科学学院讲师 e-mail: 173493982@qq.com; 谢志勇, 谢丽琴: 并列第一作者
低密度脂蛋白(LDL)非酶糖基化和氧化修饰均是导致动脉粥样硬化(AS)的关键因素。 前人发现, 丁香可有效抑制牛血清白蛋白(BSA)、 高密度脂蛋白(HDL)糖基化修饰, 丁香乙酸乙酯相(EAEC)和丁香油(CBO)均具有很强的抗氧化活性。 为了确定丁香抑制LDL糖基化及氧化所对应的最有效成分, 在前人研究基础上采用光谱学技术对EAEC和CBO抑制LDL糖基化及氧化功能进行了比较。 首先建立LDL-葡萄糖糖基化孵育体系, 通过测定糖基化早期、 中期和末期产物及三维荧光光谱的变化比较CBO和EAEC抑制LDL糖基化修饰的效果。 其次, 建立LDL-CuSO4氧化孵育体系, 通过测定荧光指标和三维荧光光谱、 紫外可见波长扫描来比较两者抑制LDL氧化修饰效果。 结果发现, EAEC和CBO对LDL糖基化修饰过程中产生的早期产物(Amadori产物)、 中期产物(二羰基化合物)及终末期产物(戊糖素和AGEs)均具有很强的抑制效果, 且EAEC的抑制效果均强于CBO; 三维荧光光谱表征得到相同的结果。 在LDL氧化修饰比较中, CBO对色氨酸(Trp)荧光猝灭、 总荧光产物及脂褐素的生成、 赖氨酸(Lys)修饰的抑制效果均显著强于非油成分的EAEC; 三维荧光光谱表征也得到相同的结果; 紫外、 可见全波长扫描反映CBO比EAEC对共轭二烯(CD)生成及光谱红移的抑制效果更强。 研究结果为后续锁定重点成分分离、 纯化及研发丁香抗LDL糖基化及氧化功能食品提供参考。
XIE Zhi-yong and XIE Li-qin: joint first authors
Non-enzymatic glycosylation and oxidation of low density lipoprotein (LDL) both have been crucial factors leading to atherosclerosis (AS). It was found in previous studies that clove had inhibitory effects on the glycosylationof bovine serum albumin (BSA) and high-density lipoprotein (HDL), while ethyl acetate extracts of clove (EAEC) and clove bud oil (CBO) had strong antioxidant activity. In order to determine the most effective components of clove to inhibit LDL from glycosylation and oxidation, the comparisons of inhibition between EAEC and CBO on LDLglycosylation and oxidation were studied in this paper on the basis of the previous studies based on spectroscopy technology. The glycosylation incubation system of LDL-glucose was firstly established in this experiment. The inhibition between EAEC and CBO on LDL glycosylation was compared by the determination of the products during the early, middle and the end periods of glycosylation, and the spectra variations of the three-dimensional fluorescence. Secondly, LDL-CuSO4 as oxidation incubation system was established, and the inhibition between EAEC and CBO on LDL oxidation was compared by the determinations of fluorescence indicators and three-dimensional fluorescence spectroscopy, UV-Visible spectra. The results indicated that EAEC and CBO both have inhibition of the formation of Amadori, dicarbonyl compounds, AGEs and pentosidines which are products during the early, middle and the end period of LDL glycosylation respectively, and the inhibition effects of EAEC were stronger than those of CBO; three-dimensional fluorescence spectroscopy showed the same results as above. During LDL oxidation, the inhibition of CBO on tryptophan (Trp) fluorescence quenching, the formation of total fluorescence products and lipofuscin, lysine (Lys) modification were significantly better than those of EAEC; three-dimensional fluorescence spectroscopy showed the same results; CBO had stronger inhibitory effect than EAEC on conjugated diene (CD) generated and spectrum redshift in UV-Visible scanning spectra. This study provides a reference for further separation and purification of the key components, research anddevelopment of functional foods inhibiting LDL glycosylationand oxidation ofclove.
引 言
据世界卫生组织报道, 全球约3.47亿、 我国约1亿人患有不同程度的高血糖或糖尿病[1]。 血糖过高会造成血浆蛋白(如LDL)及其他生物大分子发生糖基化修饰[2], 导致主要器官产生病变并诱发各种并发症[3]。 非酶糖基化, 即还原糖(如葡萄糖)和蛋白质侧链氨基发生缩合反应(也称为美拉德反应)[4]。 在糖基化早期阶段, 缩合生成可逆的Schiff碱, 其经重新排列生成更稳定的Amadori产物(如果糖胺)[5]。 中期阶段, Amadori产物经过氧化、 水解反应降解成二羰基化合物[6]。 末期阶段, 二羰基化合物继续与游离氨基经氧化、 水解和环化反应形成不可逆的具有荧光特性的糖基化终末端产物(advanced glycationendproducts, AGEs)[7]。 据报道, AGEs与阿尔茨海默氏症、 终末期肾病、 类风湿关节炎以及糖尿病并发症等疾病有关[8]。
低密度脂蛋白(low density lipoprotein, LDL)是血液中胆固醇的主要运输载体[9]。 大量研究表明, 高血糖可促进LDL糖基化修饰, 最终导致动脉粥样硬化(atherosclerosis, AS)和神经退化[10]。 血液中的葡萄糖和LDL中的apoB赖氨酸残基发生非酶糖基化反应先后产生Amadori产物及二羰基化合物并最终形成AGEs[11]。 糖基化LDL不能被LDL受体识别, 转而被清道夫受体识别导致AS形成[10]。
研究表明, LDL在糖基化过程中不可避免地会发生氧化修饰[11]。 LDL在体内容易被氧化, 其氧化主要包括两个阶段。 第一阶段为氧化初始阶段。 LDL含有的大量PUFA受氧自由基攻击后形成脂质过氧化物(如MDA、 活性醛等)[12]。 第二阶段为LDL氧化深入阶段。 随后, LDL脂质进一步氧化, LDL蛋白质也被修饰, 导致其无法被LDL受体识别, 转而被清道夫受体(氧化LDL受体)识别, 形成泡沫细胞[12, 13]。 LDL氧化修饰是导致AS和心血管疾病的关键因素之一[13, 14]。
丁香是桃金娘科番樱桃属植物丁香的干燥花蕾, 又名公丁香, 富含黄酮、 多酚类化合物, 其中油脂含量高达20%[15], 被国家列入第一批药食两用名单[16]。 传统医学中可用于治疗呼吸系统和消化系统疾病[8], 具有抗炎、 抗菌、 抗真菌、 抗氧化[16, 17]和抗糖基化活性[8]。
Jin等[18]发现, 丁香油可显著抑制高密度脂蛋白(high-density lipoprotein, HDL)非酶糖基化修饰。 而Suantawee等[8]研究发现, 丁香提取物能有效抑制牛血清白蛋白(bovine serum albumin, BSA)糖基化修饰。 但是, 丁香对LDL糖基化修饰抑制效果如何, 目前尚不清楚。
大量研究表明, 丁香具有极强的抗氧化活性[16, 17, 19, 20], 实验室前期研究结果发现, 丁香对LDL氧化修饰也具有很强的抑制效果, 而乙酸乙酯相(ethyl acetate extract of clove, EAEC)在丁香非油成分中总多酚及总黄酮含量最高[20]、 抑制LDL氧化修饰能力最强, 为有效部位[16, 19]。 前人发现丁香不但含油量高达20%[15], 并且丁香油(clove bud oil, CBO)也具有极强的抗氧化性[21], 其主要活性成分丁香酚含量高达70.6%[22]。
以上研究发现, EAEC为丁香非油类成分中抗氧化活性的有效部分[16, 19], 能有效抑制BSA糖基化修饰[8]; 而CBO不但是丁香中含量最高的有效成分, 其抗氧化活性及抑制HDL糖基化修饰能力也非常强[18, 21]。 但是, 丁香中这两种主要成分对LDL糖基化及氧化的抑制效果哪种成分更强? 目前也尚未确定, 从而无法确定功能活性所对应的有效成分进行后续分离、 纯化及深入研究, 从而极大地限制了丁香抗AS功能食品的研发进程。
据此, 实验首先通过测定糖基化早期、 中期和后期产物比较EAEC和CBO抑制LDL糖基化修饰效果; 其次通过荧光技术比较两者抑制LDL氧化修饰效果, 从而确定丁香抗LDL糖基化及氧化活性主要成分, 为后续分离、 纯化及研发抗AS功能食品提供依据。
丁香(江西樟树天齐堂中药饮片有限公司, 产地广西, 批号: 1511008, 生产日期: 2015年11月20号), 粉碎、 过40目筛后置冰箱中备用; LDL(从健康人血浆中分离得到)。
相关试剂均购自上海阿拉丁生化科技股份有限公司, 其余试剂均为国产分析纯或优级纯。
LS-55荧光磷光分光光度计(美国Perkin Elmer公司); TU-1901双光束紫外可见分光光度计(北京谱析通用仪器有限责任公司)。
1.2.1 索式提取丁香油
称取丁香粉末50.00 g, 用400 mL正己烷连续索氏提取6 h, 提取液浓缩、 无水硫酸钠除水、 过滤得到丁香油。
1.2.2 丁香有效成分提取
采用文献[16, 19]等方法提取得到EAEC粉末。
1.2.3 LDL制备
根据文献[16, 19, 23]、 采用肝素钠沉淀法制备得到。 以BSA为标准品, 采用Lowry’ s测定蛋白浓度, 以蛋白浓度确定LDL溶液浓度。 用高盐PBS(pH 7.4)稀释即可获得各种LDL所需浓度。
1.2.4 EAEC与CBO抑制LDL非酶糖基化修饰能力的比较
1.2.4.1 建立体外LDL-葡萄糖非酶糖基化修饰体系
以高盐PBS(pH 7.4)作为缓冲体系, 含1 mg· mL-1 LDL、 500 mmol· L-1葡萄糖和不同浓度样液(EAEC, CBO或阳性对照或试剂空白), 并含0.02%叠氮化钠(NaN3)防止细菌生长, 0.5 mmol· L-1 EDTA和充入N2抑制LDL氧化, 避光在50 ℃恒温孵育1~21 d。 以上溶液浓度都为孵育体系终浓度。
1.2.4.2 EAEC与CBO抑制LDL糖基化早期产物产生的比较
采用Ahmad等[4]、 Li等[24]、 Zhang等[25]方法稍加修改。 取500μ L孵育混合液加入到pH 10.35, 100 mmol· L-1 NaHCO3-Na2CO3缓冲体系中, 加入2 mL 0.3 mmol· L-1 NBT试剂后置于37 ℃水浴15 min, 加入200 μ L反应终止剂(10%冰醋酸)终止反应, 通过530 nm吸光度值测定糖基化初始产物— Amadori产物产生量。
1.2.4.3 EAEC与CBO抑制LDL糖基化中期产物产生的比较
采用Zhang等[25]方法, 取400 μ L孵育体系、 加入200 μ L 500 mmol· L-1 Girard-T试剂, 再加入3.4 mL 500 mmol· L-1 pH 2.9甲酸钠缓冲液, 然后置于37 ℃水浴1 h, 于294 nm下测定吸光度值。
1.2.4.4 EAEC与CBO抑制LDL糖基化末期产生的比较
(1)戊糖素荧光测定
采用Joglekar等[26]方法, 稍加修改。 取2 mL孵育体系、 加入2.5 mL高盐PBS (pH 7.4)稀释, 在Ex335 nm, Em385 nm测定戊糖素特征荧光强度。
(2)AGEs荧光测定
采用Ahmad等[4]方法。 取2 mL孵育体系、 加入2.5 mL高盐PBS(pH 7.4)稀释, 在Ex370 nm, Em440 nm测定AGEs荧光强度。
1.2.4.5 EAEC与CBO抑制LDL糖基化修饰三维荧光光谱的比较
根据文献[27, 28, 29]方法, 固定Ex从200 nm开始, 每10 nm激发一次, 直到440 nm终止; Em在260~550 nm范围内扫描得到LDL糖基化修饰3D荧光光谱。
1.2.5 采用荧光技术对EAEC与CBO抑制LDL氧化修饰能力的比较
建立LDL氧化修饰孵育体系: 取4.9 mL LDL溶液(500 μ g· mL-1)加50 μ L CuSO4(1.25 μ mol· L-1)或去离子水, 加50μ L不同浓度丁香样液(EAEC或CBO), 37 ℃孵育氧化48 h。
(1)Trp荧光猝灭
采用Chen等[30]方法, 稍加修改, 固定Ex280 nm, 于Em300~450 nm范围内扫描得到荧光光谱, 直观反映丁香样液抑制LDL氧化修饰过程中Trp荧光猝灭程度。 在Ex295 nm, Em330 nm测定荧光强度。
(2)脂褐素荧光测定
采用王等[31]和Yang等[16]方法, 在Ex350 nm, Em460 nm测定脂褐素荧光强度。
(3)LDL氧化修饰的总荧光产物的荧光测定
采用Mclean等[29]方法, 在Ex360 nm, Em430 nm测定总荧光产物荧光强度。
(4)活性醛和MDA修饰Lys残基荧光扫描
采用Picard等[32]方法, 稍加修改。 分别固定Ex350 nm, Em在400~550 nm范围内扫描; 以及固定Ex390 nm, Em在400~550 nm范围内扫描, 得到荧光光谱, 直观反映丁香样液抑制氧化产物活性醛和MDA修饰Lys残基的效果。
(5)丁香样液抑制LDL氧化修饰三维荧光光谱
根据1.2.4.5方法Ex从200 nm开始420 nm终止, 每10 nm激发一次。 Em在260~500 nm范围内扫描得到三维荧光光谱。
(6)紫外可见全波长范围扫描
为了从整体反映抑制LDL氧化修饰程度, 采用Esterbauer等[33]方法, 在紫外、 可见光波长200~750 nm范围内扫描。
2.1.1 EAEC和CBO对LDL糖基化早期产物— Amadori产物抑制效果的比较
在糖基化反应早期阶段, 还原糖羰基容易与载脂蛋白apoB氨基反应形成不稳定的早期脂质过氧化产物(Schiff碱), 这种高度不稳定的产物进一步发生重排, 形成更稳定的Amadori脂类产物(酮胺, 如果糖胺), 是LDL糖基化的重要特征[4], 可通过测定Amadori产物的含量确定EAEC和CBO在LDL糖基化过程中对Amadori产物生成的抑制作用。 在碱性条件下, Amadori产物能还原NBT形成在530nm处有最大吸收峰的蓝紫色化合物。
根据1.2.4.2方法, EAEC和CBO的比较结果如图1所示结果。 从图1可看出, EAEC和CBO的Amadori产物含量都显著低于gly-LDL(p< 0.01), EAEC的抑制效果显著低于同浓度的CBO(p< 0.01)。 且EAEC及CBO的抑制效果均呈现出量效关系。 表明EAEC和CBO对LDL糖基化过程中Amadori产物生成都有抑制作用, 而EAEC的抑制效果强于CBO。 前人研究结果表明, EAEC及CBO均富含多酚和黄酮类化合物[15, 20], 可能是因这些多酚和黄酮具有阻止脂质过氧化产物(Schiff碱)生成和清除自由基的功效, 抑制氨基糖基化, 从而抑制Amadori产物形成[24]。 前人研究发现富含芦丁和槲皮素的苦荞麦也对Amadori产物生成有相同的抑制作用[34]。
 | 图1 EAEC和CBO对LDL糖基化修饰中Amadori阐物抑制效果的比较2.1.2 EAEC和CBO对LDL糖基化中期产物— 二羰基化合物抑制效果的比较Fig.1 The comparison of inhibition on Amadori products between EAEC and CBO during glycation of LDL |
在糖基化中期, 早期Amadori产物通过氧化、 水解反应生成二羰基化合物[24], 抑制二羰基化合物的形成可减少AGEs形成, 进而减少糖尿病并发症[7]。
在温和的酸性条件下, Girard-T试剂可与二羰基基团的醛酮反应生成在294nm处有最大吸收的加合物, 通过该吸光度评价EAEC和CBO对二羰基化合物的抑制作用[6]。 采用1.2.4.3方法, 设置终浓度为50, 100和200 μ g· mL-1的EAEC和CBO, 得到结果如图2。 EAEC及CBO对二羰基化合物的产生均呈现出显著的抑制效果(p< 0.01), 其浓度越高, 抑制效果越强。 同浓度时EAEC比CBO的抑制效果更强(p< 0.01)。 主要原因是EAEC和CBO均含有较多酚类和黄酮类化合物, 具有清除自由基和螯合金属离子的能力[8]。 前人也发现丁香粗提物能有效地抑制BSA糖基化过程中羰基化合物的生成, 与本实验结果类似[8]。
 | 图2 EAEC和CBO对LDL糖基化修饰中二羰基化合物抑制效果的比较2.1.3 EAEC和CBO对LDL糖基化末期产物— 戊糖素和AGEs抑制效果的比较Fig.2 The comparison of inhibition on dicarbonyl compounds between EAEC and CBO during glycation of LDL |
在糖基化反应末期, 二羰基化合物与游离氨基反应, 通过氧化、 水解和环化反应形成不可逆的荧光产物AGEs, 在Ex370 nm/Em440 nm荧光强度有最大峰值[7]。 戊糖素是特殊的AGEs, 为Lys和精氨酸交联形成的荧光性交联化合物, 在Ex335 nm/Em385 nm有特征荧光[35]。
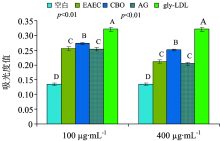
根据1.2.4.4(1)方法, 戊糖素荧光强度的测定结果如图3所示。 gly-LDL荧光强度最大, 表明LDL糖基化修饰生成大量的戊糖素。 200 μ g· mL-1 EAEC和CBO的荧光强度都显著低于gly-LDL(p< 0.01)。 表明EAEC和CBO对戊糖素生成都有具有显著的抑制作用, 且EAEC抑制效果强于CBO。
 | 图3 EAEC和CBO对LDL糖基化修饰中戊糖素抑制效果的比较Fig.3 The comparison of inhibition on pentosidine between EAEC and CBO during glycation of LDL |
为进一步研究EAEC和CBO对AGEs生成的影响, 根据方法1.2.4.4(2), 定量测定AGEs的荧光强度, 从图4可以看出, 在终浓度为200 μ g· mL-1, EAEC和CBO的荧光强度显著低于gly-LDL(p< 0.01), 与CBO相比, EAEC的荧光强度更低。 表明EAEC和CBO都有抑制AGEs生成的效果, EAEC的抑制效果更强。 Chompoo等发现, 艳山姜根茎能有效抑制AGEs生成, 与本实验结果类似[7]。 前人发现抑制Amadori产物和二羰基化合物的生成可有效抑制AGEs的生成[7], 2.1.1和 2.1.2结果发现EAEC和CBO能有效地抑制LDL糖基化中Amadori产物和二羰基化合物生成, 进而抑制AGEs的产生, 而且EAEC抑制AGEs生成的效果更强。
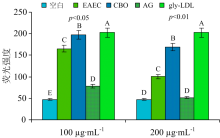 | 图4 EAEC和CBO对LDL糖基化修饰中AGEs抑制效果的比较Fig.4 The comparison of inhibition on AGEs formaion between EAEC and CBO during glycation of LDL |
2.1.4 三维等高线荧光光谱表征EAEC和CBO对LDL糖基化抑制效果的比较
为了进一步直观表征丁香样液EAEC和CBO抑制LDL糖基化修饰作用, 根据Horiuchi等[27, 28, 29]方法, 采用1.2.4.5方法扫描得三维等高线荧光光谱如图5所示。
图5(a)为空白组, 含有一个明显的荧光发色团, 即在Peak A处(Ex280 nm/Em330 nm), 为Trp的内源荧光[28, 30]。 并且Peak A有最大荧光强度(991.72), 表征未被糖基化修饰的LDL。 gly-LDL如图5(b)所示, 与空白组相比, Peak A消失, 且在Peak B(Ex370 nm/Em440 nm)处出现新的荧光发色团, 其荧光强度高达276.03。 Peak A消失表明LDL发生糖基化修饰后, Trp荧光完全猝灭, 而Peak B为AGEs的荧光信号[7, 27], 表征糖基化修饰的LDL[7]。 图5(c), (d)和(e)分别代表EAEC, CBO和AG组, 与空白相比, 其Peak A都消失, 说明都发生一定程度的糖基化修饰导致Trp荧光猝灭。 但是, 与gly-LDL相比, Peak B荧光信号都有明显衰减。 其中, EAEC在Peak B处的荧光强度(175.89)显著低于CBO对应的荧光强度(200.0), 表明EAEC, CBO和AG对LDL糖基化修饰都有显著的抑制作用, 进一步验证了2.1.3研究结果。 前人发现黄酮类化合物通过金属螯合或捕获活性氨基实现有效抑制荧光产物AGEs形成[7], 可能EAEC黄酮含量较高[16, 19, 20], 是对LDL糖基化修饰具有较强的抑制效果的原因。
2.2.1 EAEC和CBO对LDL氧化修饰中的Trp荧光猝灭抑制效果的比较
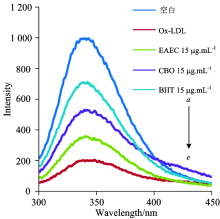
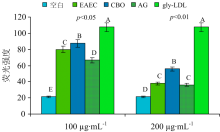
研究发现, LDL氧化修饰过程中, 载脂蛋白apoB中的Trp很容易被氧化修饰, 导致其在Ex295 nm/Em330 nm处发生荧光猝灭[30]。 为研究EAEC和CBO对Trp荧光猝灭的抑制效果, 根据1.2.5(1)方法, 设置终浓度为5和15 μ g· mL-1的EAEC和CBO, 固定Ex280 nm, Em300~450 nm得到荧光光谱如图6所示。 各组均在Em330 nm左右达到最高峰, 均高于ox-LDL, 并且CBO的抑制效果明显高于相同浓度的EAEC。
为进一步验证Trp荧光猝灭结果, 在Ex295/Em330 nm下定量测定的结果如图7所示。 所有EAEC和CBO样液组都显著高于ox-LDL(p< 0.01), 且CBO的抑制效果仍显著高于同浓度的EAEC(p< 0.01), 与扫描结果一致, 两者相互印证。 表明EAEC和CBO均能很好地抑制LDL氧化修饰中Trp荧光猝灭, CBO 的抑制效果明显强于相同浓度的EAEC。 研究发现杏仁皮因含大量多酚和黄酮, 通过清除自由基或螯合过渡金属离子抑制Trp降解[30]。 CBO也可能是因富含多酚类化合物[15, 21], 导致其抑制Trp荧光猝灭的能力更强。
 | 图7 荧光定量比较EAEC和CBO对 Trp荧光猝灭的抑制效果2.2.2 EAEC和CBO对抑制LDL氧化修饰中脂褐素和总荧光产物生成的比较Fig.7 The comparison of inhibition efficiency between EAEC and CBO on Trp fluorescence quenching by quantitative determination |
据报道, 脂褐素是脂质和与LDL的蛋白过氧化形成的复合产物, 在体内堆积是机体明显衰老的指标, 它反映细胞被自由基损伤的程度[16, 31]。 除此之外, LDL在氧化修饰过程中其脂质过氧化物(如HNE, 4-羟基-2-壬烯醛))和LDL中apoB的Lysε -氨基共价结合形成的ox-LDL在Ex360 nm/Em430 nm有特征荧光, 该荧光广泛作为定量检测LDL氧化修饰程度[36]。
本试验采用1.2.5(2)(3)的方法测定脂褐素和总荧光产物的结果分别如图8和图9所示, 可看出, ox-LDL的荧光强度显著高于空白组(p< 0.01), 表明ox-LDL产生大量的脂褐素和荧光产物。 加入丁香样液EAEC和CBO的荧光强度显著低于ox-LDL(p< 0.01), 表明EAEC和CBO都有抑制脂褐素和荧光产物形成的作用。 CBO的荧光强度显著低于同浓度EAEC(p< 0.01), 其抑制效果更强, 可能因CBO的总多酚含量高于EAEC的缘故。 研究发现贰香叶提取物也有抑制脂褐素等氧化产物产生的作用[31]。
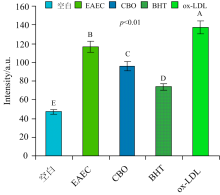 | 图8 比较EAEC和CBO对LDL氧化修饰中脂褐素的抑制效果Fig.8 The comparison of inhibition efficiency between EAEC and CBO on lipofuscin generated during oxidation of LDL |
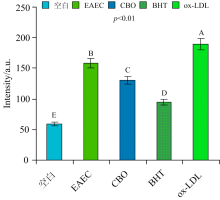 | 图9 比较EAEC和CBO对LDL氧化修饰中荧光产物的抑制效果2.2.3 EAEC和CBO对抑制活性醛和MDA修饰Lys残基的比较Fig.9 The comparison of inhibition efficiency between EAEC and CBO on fluorescent products generated during oxidation of LDL |
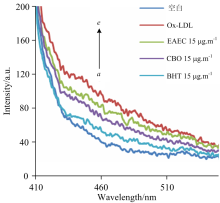
LDL含有的大量PUFA在氧化修饰过程中容易被氧化脂质过氧化产物(如活性醛和MDA等)。 活性醛和MDA都会与apoB中Lys游离氨基结合形成在Ex350 nm/Em420 nm, Ex390/Em460有较强的荧光强度的Schiff碱[16, 32]。 为进一步从荧光角度评价EAEC和CBO对LDL氧化修饰中脂质与蛋白结合的抑制效果, 根据1.2.5(4)方法扫描得到荧光光谱如图10、 图11所示。 两幅图的结果都一致, 各组荧光光谱走势基本相同, ox-LDL荧光强度最高, 显著高于最低的空白组, 是因为脂质氧化产物与Lys游离氨基结合形成Schiff碱, 荧光强度显著增加[32]。 EAEC和CBO的荧光强度位于ox-LDL与空白样之间, 表明EAEC和CBO对活性醛和MDA与Lys游离氨基结合具有抑制作用, 且CBO的抑制效果强于EAEC。
为了进一步直观表征EAEC和CBO抑制LDL氧化修饰作用, 采用Koller[28]和Mclean[29]等的方法, 根据1.2.5(5)方法扫描得出三维等高线荧光光谱如图12所示。
图12(a)为空白组, 含有一个明显的荧光发色团, 即在Peak A处(Ex280 nm/Em330 nm), 为Trp的内源荧光[28, 30]。 并且Peak A有最大荧光强度(966.16), 表征未被氧化的LDL。 ox-LDL如图12(b)所示, 与空白组相比, Peak A荧光强度(256.97)显著降低, 而且在Peak B(Ex360 nm/Em430 nm)处出现新的荧光发色团, 其荧光强度高于256.97。 Peak A处表明LDL氧化修饰Trp发生荧光猝灭, 而Peak B为荧光产物的荧光信号, 表明 LDL 氧化修饰产生的脂质氧化产物与Lys残基共价结合形成Schiff碱, 增加了该处的荧光强度[36]。
图12(c), (d), (e)分别代表EAEC, CBO和BHT组, 其Peak A的荧光强度都显著高于ox-LDL, 而且Peak B荧光都有明显的衰减, 其中, CBO在Peak A处的荧光强度(732.95)显著高于EAEC对应的荧光强度(488.12), 在Peak B处与荧光强度为104.49的EAEC相比, 同浓度的CBO几乎没有荧光信号。 表明EAEC, CBO和BHT对LDL氧化修饰都具有显著的抑制作用, 而且再一次验证了CBO的抑制效果强于EAEC。 前人也发现, 丁香抑制脂质过氧化物的产生, 能有效减少荧光产物, 本文与Mclean等结果类似[29]。
2.2.5 紫外、 可见全波长范围内扫描结果
研究发现, LDL氧化修饰会形成共轭二烯(CD), 其产生新发色团, 并且在234 nm处有最大吸收[33]。 为进一步从整体反映EAEC和CBO抑制LDL氧化修饰的程度, 根据1.2.5(6)方法, 在紫外可见全波长范围内扫描得到如图13的光谱。 从图中可以看出ox-LDL在234 nm处有最高峰, 相比空白组, 吸光度值急剧上升, 表明LDL氧化修饰后产生大量的CD产物, 而且最大吸收峰明显发生红移, 与Esterbauer等研究结果一致[33]。 EAEC和CBO的最大吸收峰的吸光度值小于ox-LDL, 其中CBO显著低于EAEC, 且能明显看出有抑制光谱红移的效果。 表明CBO抑制LDL氧化修饰的效果显著高于EAEC, 与以上结论一致。
利用荧光光谱法及紫外可见光谱法比较了EAEC和CBO对LDL糖基化和氧化修饰的抑制效果。 结果表明, EAEC和CBO对LDL糖基化修饰过程中产生的早期产物(Amadori产物)、 中期产物(二羰基化合物)及终末期产物(戊糖素和AGEs)均具有很强的抑制效果, EAEC的抑制效果均强于CBO; 且三维荧光光谱表征了相同的结果。 CBO对色氨酸(Trp)荧光猝灭、 总荧光产物及脂褐素的生成、 赖氨酸(Lys)修饰的抑制效果均显著强于非油成分的EAEC; 且三维荧光光谱表征相同的结果。 CBO比EAEC对共轭二烯(CD)生成及光谱红移的抑制效果更强。
致谢: 感谢九江学院分析测试中心及李东霖老师在荧光测定及分析等方面提供的指导和帮助。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|