作者简介: 王 燕, 女, 1992年生, 浙江农林大学工程学院硕士研究生 e-mail: wy2625380616@126.com
全氟辛酸(PFOA)与血清蛋白(SA)分子间作用分析法的建立及理论模建研究。 荧光光谱结合紫外光谱法研究PFOA与血清蛋白(HSA)分子间作用, 获得PFOA-HSA分子间作用的紫外-荧光特征谱, 紫外-荧光特征谱表明PFOA规律性降低了HSA紫外吸收和荧光强度, HSA最大发射波长明显发生蓝移, 表明PFOA与HSA发生了分子间作用, 根据双对数回归曲线方程得到结合常数, 定量说明PFOA与HSA之间存在中等强度的分子间作用力。 Van’t Hoff方程分析光谱数据得到 HSA与PFOA分子间作用的热力学参数Δ H>0, Δ S>0, Δ G<0, 依据Ross理论分析PFOA与HSA分子间作用, 表明二者主要通过疏水作用力和氢键发生分子间作用, 并且HSA与PFOA之间的分子间作用是自发过程。 同步荧光光谱解析出PFOA与HSA的分子间作用导致血清蛋白分子的微区构象发生改变, 使色氨酸残基位域构象发生改变。 建议偏振因子 M, 通过荧光偏振光谱, 定量表征PFOA与HSA分子间作用。 基于光谱数据分析, 建立了PFOA 与HSA分子间作用的理论模型, 模建结果说明PFOA与HSA的分子间作用主要发生在HSA活性位点Sudlow’s sites I, HSA与PFOA分子间作用是自发过程。 光谱实验与理论模建结果基本一致, 可为全面了解生物大分子与全氟化合物之间的分子间作用以及研究微观毒理机制提供有益参考。
Study on the establishment of intermolecular interaction between perfluorooctanoic acid (PFOA) and human serum protein (HSA) and its theoretical modeling. Fluorescence spectrums combined with ultraviolet spectrum have been studied the intermolecular interaction between PFOA and HSA to obtain PFOA-HSA ultraviolet-fluorescence spectrum features. The UV-fluorescence characteristic spectra showed that PFOA regularly decreased the UV absorption and fluorescence intensity of HSA, and the maximum emission wavelength of HSA caused obvious blue shift, which indicated that there was intermolecular interaction between PFOA and HSA. The binding constants between PFOA and HSA were obtained by analyzing spectrum experiments data, which indicated the medium intermolecular interaction between PFOA and HSA. On the basis of Van’t Hoff equation to analyze spectrum experiments datas to attain the thermodynamic parameters of the intermolecular interaction between PFOA and HSA. The obtained thermodynamic parameters were Δ H>0, Δ S>0, Δ G<0, which indicated that the main forces between HSA and PFOA were hydrophobic force and hydrogen bond by Ross theories, and the intermolecular interaction between HSA and PFOA was spontaneous process. Synchronous fluorescence spectrum revealed that the intermolecular interaction of PFOA and HSA resulted in a change in the microdomain conformation of the serum protein molecule, which changed the conformational domain of the tryptophan residue. In this paper, the polarizing factor M was proposed to quantitatively characterize the interaction between PFOA and HSA by fluorescence polarization spectroscopy. Based on spectral data analysis, the theoretical model of the interaction between PFOA and HSA was established, The theoretical model results showed that the intermolecular interaction of PFOA and HSA occured mainly in the HSA active site Ⅰ region and the intermolecular interaction between HSA and PFOA was a spontaneous process. The results of spectral experiments were basically consistent with the theoretical modeling results. These data can provide a useful reference for a comprehensive understanding of the intermolecular interactions between biological macromolecules and perfluorinated compounds and the study of microscopic toxicological mechanisms.
引 言
目前, 分子间作用是物理学、 生物物理学等领域的研究重点, 分子间作用力是分子间作用的热点。 分子间作用不仅涉及到小分子之间的分子间作用[1, 2], 还存在许多小分子和生物大分子之间的分子间作用, 小分子进入生物体会与生物体内的生物大分子发生分子间作用, 进而产生药理和毒理作用。 对于生物大分子与小分子的分子间作用体系而言, 由于生物大分子微观结构比较复杂, 因此研究生物大分子与小分子的分子间作用有一定难度, 采用的研究方法主要有光谱法、 色谱法、 电化学法等[3, 4, 5], 由于紫外-荧光光谱法灵敏度高、 选择性好、 待测样品用量少和实验方法简单等诸多优点, 使其成为研究生物大分子与小分子的分子间作用的有效手段。
研究中考察全氟辛酸(pentadecafluorooctanoic acid, PFOA, C8HF15O2)与血清蛋白(human serum albumin, HSA)分子间作用。 PFOA是聚四氟乙烯类化合物的典型代表, 是广泛存在于工农业产品及生活用品中的一种功能材料。 PFOA具有疏水和疏油的特性, 化学结构远较其他同类化合物稳定, 且耐高温和耐强氧化剂。 目前, 随着PFOA多年来的大量使用, 其在环境中的积累量不断升高, 成为生态环境的危害物及新的环境污染毒物。 PFOA具有生物累积性, 随着食物链的富集作用而聚集于人体中[8], 会与HSA发生分子间作用, 进而产生一系列的毒性, 严重危害人体健康。
研究PFOA与HSA分子间作用可以通过辅助评判PFOA与HSA分子间作用参数进一步了解PFOA的毒理, 此为从生物物理学角度开展的研究, 利用光谱技术从生物学角度开展PFOA与HSA分子间作用少有报道。 从文献报道[6, 7]看, PFOA的研究大多集中在环境污染分布、 生物累计、 宏观整体水平的毒理效应等方面, 生物物理角度探究PFOA的微观毒理作用还需要深入的探究, 也没有成熟可借鉴的分析方法。 因此研究PFOA与HSA分子间作用的分析方法并构建PFOA与HSA分子间作用研究体系模型极为必要, 可为全面了解生物大分子与全氟化合物之间的分子间作用以及研究微观毒理机制提供有益参考。
全氟辛酸(PFOA, C8HF15O2, 纯度90%, 上海阿拉丁生化科技股份有限公司); 磷酸二氢钠(NaH2PO4· 2H2O, 湖试化学试剂有限公司); 磷酸氢二钠(Na2HPO4· 12H2O, 国药集团化学试剂有限公司); 人血清白蛋白(HSA, 纯度96%~99%, 美国Sigma公司)。
紫外分光光度计(UV2550) (日本岛津公司); 荧光分光光度计(F-7000) (日本Hitachi公司); ZD-2自动电位滴定计(上海精密科学仪器有限公司); ChemDraw软件(美国CambridgeSoft公司); AutoDock 4.02软件(美国斯克利普斯研究所); Discovery Studio 2.5 软件(美国 BIOVIA公司)。
1.3.1 缓冲溶液配制
称取71.6 g Na2HPO4· 12H2O与31.2 g NaH2PO4· 2H2O, 蒸馏水溶解并定容1 000 mL得A与B母液, 81 mL A液与19 mL B液混合定容至1 000 mL, 调整pH得到(0.02 mol· L-1, pH 7.4 )PBS缓冲溶液。
1.3.2 反应溶液的配制
取PBS缓冲溶液配制5× 10-5 mol· L-1 HSA和10× 10-5 mol· L-1的PFOA溶液。 然后配制PFOA-HSA系列混合溶液体系。 在溶液体系中, 固定HSA溶液浓度为5× 10-5 mol· L-1, 在HSA溶液中逐次加入PFOA溶液, PFOA的浓度梯次升高为(0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10)× 10-5 mol· L-1。
1.4.1 PFOA-HSA分子间作用体系紫外光谱测定
基线校准并调零, 在1 cm比色皿中依次加入梯度浓度的PFOA-HSA溶液[cPFOA: (0.0, 0.5, 1, 4, 5, 6, 7, 8)× 10-5 mol· L-1-cHSA: 5× 10-5 mol· L-1]。 狭缝宽度2.5 nm, 中速扫描, 波长范围800~200 nm, 测得紫外吸收光谱。
1.4.2 PFOA-HSA分子间作用体系荧光发射光谱测定5× 10-5 mol· L-1 HSA溶液为空白对照组, PFOA[(0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10)× 10-5 mol· L-1]与HSA(5× 10-5 mol· L-1)混合液体系为实验组。 检测时荧光激发与发射狭缝宽度均为5 nm, 扫描速度240 nm· min-1, 激发波长λ ex=280 nm, 发射波长范围λ em=300~500 nm, 分别在298和310 K测定PFOA-HSA分子间作用体系荧光发射谱。
1.4.3 PFOA-HSA分子间作用体系同步荧光光谱测定
荧光光谱仪扫描激发波长和发射波长之间波长差(Δ λ )分别为15 nm(λ em=279~290 nm)和60 nm(λ ex=264~230 nm)的PFOA-HSA分子间作用体系, 其余测量条件及空白组和实验组溶液配制、 浓度梯度设置与1.4.2实验一致。
1.4.4 PFOA-HSA分子间作用体系荧光偏振光谱测定
激发波长(λ ex)为280 nm时, 测定垂直偏振光激发下的垂直偏振的发射光强度IVV和水平偏振的发射光强度IVH; 再测定水平偏振光激发下的垂直偏振的发射光强度IVV和水平偏振的发射光强度IVH, 获取300~500 nm的荧光偏振发射谱, 其余测量条件及空白组和实验组溶液配制、 浓度梯度设置与1.4.2荧光发射光谱实验一致。
1.4.5 PFOA与HSA分子间作用理论模型构建
1.4.5.1 HSA和PFOA文件的制备
PDB数据库下载HSA晶体结构文件4e99.pdb(ID: 4e99)。 运行Discovery Studio 2.5软件将小分子、 水分子去除, 保存为PDB文件。 再运行AutoDock 4.2软件, 加极性氢原子和Gasteiger电荷, 添加AD4原子类型, 保存为HSA.pdbqt文件。 NCBI数据库下载全氟辛酸(PFOA)文件, ChemDraw软件对PFOA进行MM能量优化, 保存为PDB文件。 运行AutoDock 4.02软件, 设定PFOA可动键数目, 加氢, 添加电荷及原子类型, 保存为PFOA.pdbqt文件。
1.4.5.2 Grid parameter file (GPF)文件和Docking parameter file (DPF)文件的制备
AutoDock 4.2软件打开HSA和PFOA的pdbqt文件, 利用Grid模块制作格点图, HSA活性位点设定为格点图中心, 格点图边界为受体活性口袋区域, 格子大小设置为X, Y, Z: 60, 60, 60, 格点间隔为0.375 Å , 保存为HSA-PFOA.gpf文件。 利用Docking模块进行参数设定, 选择Lamarckian genetic algorithm (LGA)算法搜索参数, 种群数设为150, 能量最大评价数设为2 500 000, 格点间距为0.375 Å , 保存文件为HSA-PFOA .dpf文件。
1.4.5.4 PFOA与HSA分子间作用模建
通过Autodock软件自带的模建规则和python脚本, 建立HSA-PFOA分子间作用模型, 采用不同类型的原子作为探针进行扫描和构象搜索, 根据PFOA不同构象、 位置和方向进行评分和排序, 获得合理的PFOA与HSA分子间作用模型, 再根据光谱实验数据评估PFOA与HSA分子间作用模建的合理性。
2.1.1 PFOA-HSA分子间作用紫外吸收光谱特征
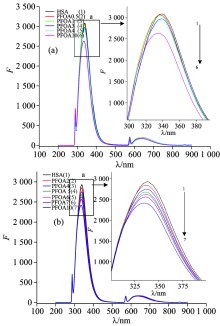
紫外光激发下HSA产生紫外吸收。 HSA与PFOA发生分子间作用的紫外谱如图1所示, HSA和PFOA-HSA紫外吸收特征列于表1。
 | 图1 PFOA-HSA分子间作用紫外吸收图谱Fig.1 The ultraviolet absorption spectrums of PFOA-HAS cPFOA(1~6)=(0.0, 0.5, 1.0, 4.0, 6.0, 8.0)× 10-5 mol· L-1, cHSA=5× 10-5mol· L-1, T=298 K, pH 7.4 |
| 表1 HSA, PFOA-HSA紫外吸收特征 Table 1 The characteristics ultraviolet absorption of HSA and PFOA-HSA |
Δ λ =λ max(i)-λ m(HSA); λ max(i): 加入不同浓度的PFOA, PFOA-HSA体系最大紫外吸收波长。 λ max(HSA): 未加入PFOA时, HSA最大紫外吸收波长。
根据表1可知, HSA在280 nm有一特征吸收峰, 固定蛋白质浓度, 加入梯度浓度的PFOA后, 吸光值随着PFOA浓度的升高规律性的降低, 最大吸收峰出现轻微蓝移现象, 表明PFOA与HSA发生了分子间作用。
2.1.2 PFOA-HSA分子间作用的荧光发射光谱特征
HSA产生内源性荧光的氨基酸残基主要是色氨酸、 酪氨酸和苯丙氨酸, 298和310 K在280 nm激发波长下, 分别在348, 303和282 nm产生最大荧光发射。 PFOA与HSA分子间作用的荧光发射谱如图2所示, PFOA与HSA分子间作用荧光发射谱特征列于表2、 表3。
| 表2 HSA, PFOA-HSA荧光发射谱特征(298 K) Table 2 The characteristics fluorescence emission spectra of HSA and PFOA-HSA(298 K) |
Δ λ =λ max(i)-λ max(HSA); λ max(i): 加入不同浓度的PFOA, PFOA-HSA体系最大荧光强度波长; λ max(HSA): 未加入PFOA时, HSA最大荧光强度波长。
| 表3 HSA, PFOA-HSA荧光发射谱特征(310 K) Table 3 The characteristics fluorescence emission spectra of HSA and PFOA-HSA(310 K) |
Δ λ =λ max(i)-λ max(HSA); λ max(i): 加入不同浓度的PFOA, PFOA-HSA体系最大荧光强度波长。 λ max(HSA): 未加入PFOA时, HSA最大荧光强度波长。
由表2和表3可知, HSA的荧光发射峰在340 nm附近, 说明在荧光发射谱中做出主要贡献的是色氨酸残基。 由于PFOA不具有荧光活性基团, 因此不会产生与HSA相互干扰的荧光。 随着PFOA浓度增加, HSA荧光强度呈规律性降低, 荧光最大发射峰位置出现蓝移, 说明PFOA和HSA存在分子间作用, HSA色氨酸残基荧光因PFOA使荧光强度降低, HSA与POFA分子间作用导致HSA的氨基酸残基的微区环境发生一定变化。 随着温度的升高, HSA, HSA-PFOA分子间作用的荧光强度相应减弱。
2.1.3 PFOA- HSA紫外-荧光重叠图分析
由图3可知, 随着PFOA浓度增加, HSA最大荧光波长发生蓝移, 紫外吸收降低, 说明PFOA加入使HSA微环境发生变化, 验证了PFOA与HSA分子间作用。
小分子与生物大分子分子间相互作用过程中, 常常存在以下几种作用力: 氢键、 范德华力、 静电作用力和疏水作用力, Ross等[9]经过实验验证得到判断生物大分子与小分子之间作用性质的热力学规律: Δ S< 0时为氢键和范德华力; Δ S> 0时为疏水和静电作用力; Δ H< 0, Δ S< 0时为氢键和范德华力; Δ H> 0, Δ S> 0时为疏水作用力; Δ H≈ 0或者较小、 Δ S> 0为静电作用力; Δ H< 0为静电作用为主要作用力。 由实验所获得的热力学参数可以判断PFOA与HSA分子间作用力。 根据Van’ t Hoff方程[9, 10, 11]
式(1)和式(2)中: K1和K2为绝对温度T1和T2下的平衡常数, R为气体常数, Δ H为标准焓变。 其中K1, K2, T1和T2是根据荧光发射光谱的双对数回归曲线方程(3)获得[10]
式(3)中: F0与F分别为小分子不存在与存在时HSA荧光强度, K为结合常数, n是结合位点数。 因为加入的PFOA溶液体积远小于比色皿中溶液体积, 可以合理采用小分子总浓度[D]代替[Df]。 以lg[D]对lg[(F0-F)/F]得到线性方程, 求得K和n, 将K值代入式(1)和式(2)可得到体系反应焓变Δ H, 自由能变Δ G。 根据Gibbs-Helmholtz方程式(4), 计算获得体系熵变Δ S, 结果列与表4。
| 表4 PFOA-HSA分子间作用参数 Table 4 The binding parameters of PFOA-HSA intermolecular interaction system |
根据表4可知, PFOA-HSA之间存在中等强度分子间作用力。 在T1=298 K, T2=310 K温度下, 结合常数K1=0.538 7× 104 L· mol-1, K2=1.864 2× 104 L· mol-1(数量级103~104 L· mol-1), n(结合位点数)值约为1, 表明PFOA与HSA发生分子间作用后形成比较稳定的1∶ 1结合物。 Δ G< 0, Δ H> 0, PFOA与HSA分子间作用是自发进行的吸热反应, Δ H> 0, Δ S> 0, 表明疏水作用力和氢键是PFOA与HSA之间的主要分子间作用力。 随着温度升高(298 K升至310 K), Δ G值降低, 表明HSA-PFOA分子间作用随着温度升高分子间作用更容易进行。
对于有一定柔性的生物大分子而言, 分子间作用会影响分子构型与构象, 采用同步荧光光谱可以考察PFOA与HSA分子间作用对HSA分子构象的影响。
2.3.1 同步荧光光谱特征
在PFOA-HSA体系中, Δ λ =15 nm与Δ λ =60 nm代表酪氨酸残基与色氨酸残基的荧光特征光谱[10]。 酪氨酸残基与色氨酸残基最大发射峰波长会因为基团微环境极性变化而受到相应的影响, 并且色氨酸残基和酪氨酸残基分别位于HSA活性位点Sudlow’ s sites I和Sudlow’ s sites II区域, 因此, 色氨酸残基和酪氨酸残基荧光特征能够在一定程度上反映PFOA与HSA之间的分子间作用对HSA微观结构的影响以及确定PFOA与HSA分子间作用的活性位点。 PFOA与HSA分子间作用体系的同步荧光光谱见图4。
由图4可知, HSA 荧光效应主要由色氨酸残基所贡献, 随着体系中PFOA浓度增加, 酪氨酸残基最大发射波长保持不变, 色氨酸残基最大发射波长出现蓝移现象。 分析原因可能为, PFOA主要是与HSA活性位点Sudlow’ s sites I上的色氨酸残基发生分子间作用, 从而导致HSA的色氨酸残基最大发射波长发生蓝移, 产生蓝移的主要原因可能是由于在HSA体系内加入PFOA后, PFOA分子嵌合到HSA亚基结构域, 从而造成结构域中肽链延展, 相邻结构域的肽链则会受到一定的挤压而收缩。 即组成疏水腔的肽链呈现紧缩状态, 进而引起结构域内的色氨酸残基所在环境的极性降低, 疏水性加强, 这种级联作用引起HSA的微观结构发生改变, 进一步验证PFOA与HSA之间发生了分子间作用。
2.3.2 偏振荧光光谱分析PFOA与HSA分子间作用
偏振荧光光谱能够比较详尽的获取有关分子偏转弛豫能力与空间取向变化方面的相关信息。 在PFOA-HSA分子间作用体系中, 通过偏振荧光光谱能够获取P(偏振度)、 r(各向异性)和M(偏振因子)等数据, 定量说明PFOA与HSA之间的分子间作用。
偏振度P是光束中偏振部分的光强度PM和整个体系光强度PI之比值。 依据式(6)测算[10]
式(6)中G是校正因子(G=IHV/IHH), PM=IVV-GIVH, PI=IVV+GIVH, 在垂直偏振光激发条件下, 垂直偏振的发射光强度与水平偏振的发射光强度为IVV和IVH, 在水平偏振光激发条件下, 垂直偏振发射光强度和水平偏振发射光强度为IHV和IHH。 各向异性r测算公式[12]如式(7)。
式(7)中G, IHV, IVH, IVV, IHH与偏振度P计算公式中含义相同。 固定HSA浓度, 加入浓度梯度PFOA后, 测得偏振荧光数据并按式(6)和式(7)计算PFOA-HSA体系的P及r, 结果列于表5。
| 表5 PFOA-HSA分子间作用体系荧光偏振参数 Table 5 The fluorescence polarization parameters of PFOA-HSA systems |
由表5可知, 体系中仅含有HSA时, P与r值较低, 随着PFOA加入, HSA与PFOA分子间作用形成结合物, 体积增大, 旋转驰豫时间变长, 导致P与r值均增大。 为了量化阐述PFOA与HSA分子间作用, 提出了一个参数-偏振因子M。
式(8)中PM为光束中偏振部分的光强度, PI为整个光强度。 根据式(8)可以得到M值, 结果列于表6。
| 表6 PFOA-HSA分子间作用体系的M值 Table 6 The polarization factors of PFOA-HSA systems |
随着PFOA的加入, PFOA-HSA分子间作用增加, 形成非共价结合物, 旋转速度变慢, 则PM增大, 导致PFOA-HSA的M值逐渐减小, 定量说明PFOA与HSA分子间发生了作用。 因此, 偏振因子M的数据能够定量证实HSA和POFA发生分子间作用。
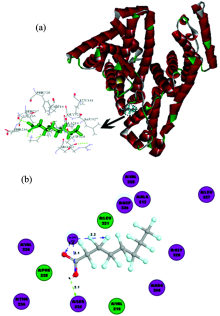
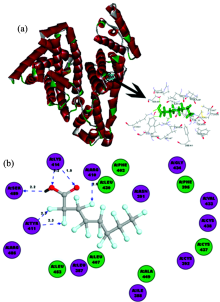
HSA有585个氨基酸残基, 主要有三个结构域(Domain Ⅰ , Ⅱ 和Ⅲ )[11], 每个结构域含有两个子结构域(Subdomain A和B)。 其中, HSA主要有两个小分子结合位点Sudlow’ s sites Ⅰ 和Sudlow’ s sites Ⅱ , 分别位于Domain Ⅱ 和Domain Ⅲ [11]。 采用Docking方法将PFOA与HSA两个活性位点进行对接来判断PFOA与HSA分子间作用。 利用拉马氏遗传算法[12]进行构象搜索找出所有可能分子间作用构象, 运用半经验自由能评价函数[12]研究PFOA-HSA分子间作用过程以获取分子间作用相关信息。 并利用打分函数, 得出HSA不同活性位点与PFOA分子间作用的能量值。 PFOA分别与HSA活性位点Sudlow’ s sites Ⅰ 和Sudlow’ s sites Ⅱ 进行分子对接, 得到最优能量PFOA-HSA分子间作用结果, 如图5, 图6所示。
图5显示PFOA-HSA(Ⅰ )分子间作用最优能量构象及分子间作用部位残基分布, 可以看出PFOA周围氨基酸残基包括Arg209, Lys212, Ala213, Val216, Phe228, Ser232, Val235, Thr236, Asp324, Val325, Leu327, Gly328和Leu331, 其中疏水氨基酸残基有Ala213, Val216, Phe228, Val235, Val325, Leu327和Leu331, 亲水氨基酸残基有Arg209, Lys212, Ser232, Thr236, Asp324和Gly328, HSA(Ⅰ )-PFOA分子间作用体系中Lys212与PFOA形成氢键, Lys212的氨基氢原子作为氢键供体, 与PFOA的氧原子和氟原子结合形成3个氢键, PFOA的羟基氢原子作为氢键供体, 与HSA的Ser232残基的羰基氧原子形成氢键, HSA与PFOA共形成了4个氢键, 模建结果说明PFOA与HSA分子间作用主要是疏水作用力和氢键, 这与光谱实验分析结果一致。
图6显示PFOA-HSA(Ⅱ )分子间作用最优能量构象及分子间作用部位残基分布, 可以看出PFOA周围氨基酸残基包括Leu387, Ile388, Asn391, Cys392, Phe395, Phe403, Leu407, Arg410, Tyr411, Lys414, Leu430, Val433, Gly434, Cys437, Cys438, Ala449, Leu453, Arg487和Ser489, 其中疏水氨基酸残基有Leu387, Ile388, Phe395, Phe403, Leu407, Leu430, Val433, Ala449和Leu453, 亲水氨基酸残基有Asn391, Cys392, Arg410, Tyr411, Lys414, Gly434, Cys437, Cys438, Arg487和Ser489, HSA-PFOA分子间作用体系中Lys414与PFOA形成氢键, Lys414的氨基氢原子作为氢键供体, 与PFOA的氧原子和氟原子结合形成5个氢键, PFOA羟基氢原子作为氢键供体, 与HSA中的Ser489残基中的羰基氧原子形成氢键, PFOA与HSA之间共有6个氢键, 模建结果说明PFOA与HSA分子间作用主要是疏水作用力和氢键, 这与光谱实验分析结果一致。
将20个PFOA与HSA分子间作用模型以tolerance(RMS值公差)2.0进行聚类, 得到PFOA-HSA构象聚类图, 如图7所示。
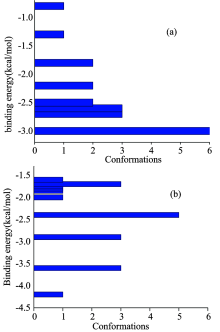 | 图7 PFOA-HSA (Ⅰ )构象聚类图(a)和PFOA-HSA (Ⅱ ) 分子构象聚类图(b)Fig.7 The conformational clusters of PFOA-HSA(Ⅰ ) in tolerance 2.0 (a) and the conformational clusters of PFOA-HSA(Ⅱ ) in tolerance 2.0 (b) |
由于在实际中对接能量最好的小分子构象不一定是与蛋白结合最紧密的, 结合能量最低的几个构象中的其中一个构象往往是结合物的最优结合模式, 表7、 表8是PFOA-HSA分子间作用体系以最低结合能量柱的6个构象为依据所得到的PFOA与HSA分子间的作用的对接能量值。
| 表7 PFOA与HSA(Ⅰ )分子间作用低能构象的对接能量值(kcal· mol-1) Table 7 The docking energy of the intermolecular interactions between PFOA and HSA(Ⅰ ) (kcal· mol-1) |
| 表8 PFOA与HSA(Ⅱ )分子间作用低能构象的对接能量值(kcal· mol-1) Table 8 The docking energy of the intermolecular interactions between PFOA and HSA(Ⅱ )(kcal· mol-1) |
aEbinding=Evdw-desol+Eele+Einternal+Etorsional-Eunbond
由表7可知, 结合物3的总能量值最优, 其中PFOA与HSA(Ⅰ )分子间作用力主要来自于分子作用力, 其中范德华作用力起主导作用。
由表8可知, 化合物1的总能量值最优, 其中PFOA与HSA(Ⅱ )分子间作用力主要来自于分子作用力, 其中范德华作用力起主导作用。
根据表7、 表8可知, PFOA结合在HSA活性位点Sudlow site Ⅱ 的最优对接模型的能量值为-11.71 kcal· mol-1(-49.03 kJ· mol-1), PFOA结合在HSA活性位点Sudlow site Ⅰ 最优对接模型的能量值为-9.18 kcal· mol-1(-38.44 kJ· mol-1), 由于诸多因素影响, 对接得到的结合能与实验数据有一定差距(-21.24 kJ· mol-1), PFOA结合在HSA活性位点Sudlow site Ⅰ 最优对接能量值为-9.18 kcal· mol-1(-38.44 kJ· mol-1)接近于实验值(-21.24 kJ· mol-1), 所以理论上推测PFOA是结合在HSA活性位点Sudlow site Ⅰ 上的, 并且说明反应是自发进行的。 总之, 理论模建得到的分子间作用结果说明PFOA与HSA的键和模式主要是疏水作用, 兼有氢键存在, PFOA与HSA分子间作用是自发进行的, 进一步验证了光谱实验结果。
采用光谱技术在分子水平上深入研究PFOA与HSA分子间作用。 除了通过紫外-荧光光谱进行测定外, 还做了一定的理论模型探索工作。 通过荧光特征谱分析, 说明PFOA与HSA之间存在分子间作用, 根据Van’ t Hoff方程和Ross理论分析光谱数据, 说明HSA与PFOA分子间作用力主要是疏水作用力和氢键, HSA与PFOA分子间作用是自发过程。 为了量化阐述PFOA与HSA分子间作用, 通过测量荧光偏振相关数据, 提出了偏振因子, 以M值定量说明PFOA与HSA分子间作用, 取得了较好结果。 其次建立PFOA与HSA分子间作用理论模型, 阐述了PFOA在HSA分子间作用部位、 分子间作用力种类及特点, 理论模建结果与光谱实验结果基本一致, 同样说明体系内存在中等强度的分子间作用, 作用力主要由疏水作用力和氢键承载。 通过理论模型图形显示, 可以更加直观了解体系内分子间作用过程。 基于光谱实验与理论模型建立, 可以从PFOA与HSA分子间作用的角度获悉PFOA毒性的机理。 PFOA导致HSA蛋白质分子微区结构改变, 最终都会使得HSA活性发生改变, 影响其生理功能发挥。 本工作为研究全氟类化合物与蛋白质分子间作用提供了有益参考, 有益于分子水平上进一步深入了解全氟类化合物对生物类大分子的分子间作用机制, 有助于理解全氟类化合物的毒理效应的作用机理。
致谢: 感谢浙江大学邹建卫教授提供的AutoDock 4.02软件和Discovery Studio 2.5 软件条件支持。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|