作者简介: 虞江萍, 1991年生, 南京林业大学信息科学技术学院硕士研究生 e-mail: 605581296@qq.com
采用可调温太赫兹时域光谱(TDS-THz)系统, 测量了脂肪族L-天冬酰胺、 L-半胱氨酸、 L-丙氨酸和芳香族L-酪氨酸四种氨基酸在低温下的温度特性, 实验中, 分别在降温和升温过程中选取了以下温度节点: 常温, 250, 200, 150, 100, 70, 40, 10以及4.5 K等, 观察样品对太赫兹吸收光谱的异同; 结合傅里叶变换红外光谱仪(FTIR)对室温下上述四种氨基酸在低频段(0.5~2 THz)范围内的吸收峰进行了验证, 同时采用拉曼光谱仪测试了高频段(3~6 THz)范围内的这四种氨基酸在常温下的拉曼强度, 以此来验证了实验的准确性。 结果表明: 脂肪族和芳香族氨基酸太赫兹光谱对温度变化的响应存在差异, 随着温度降低, 两类氨基酸的吸收峰位置均发生蓝移现象, 同时部分氨基酸出现新的吸收峰, 但是吸收峰线宽的变化略有不同。 最后, 采用量子化学Gaussian 09软件包, 分别选取一种脂肪族氨基酸和一种芳香族氨基酸, 通过密度泛函理论对其单分子和晶胞结构进行了计算, 对比测试结果可以得出两种氨基酸的振动模式是由分子间作用力形成的。
We employed terahertz time domain spectra (THz-TDS) to measure the spectra of L-Asparagine, L-Cysteine, L-Alanine and L-Tyrosine in the frequency range of 0.5~2 THz at different temperatures. We measured the terahertz absorption spectra of amino acids at room temperature, 250, 200, 150, 100, 70, 40, 10 and 4.5 K by cooling the samples. The absorption peaks of the four amino acids in the low frequency range (0.5~2 THz) were demonstrated by Fourier transform infrared spectroscopy (FTIR) at room temperature, and the range of high frequency band (3~6 THz) was measured by Raman strength of these four amino acids at room temperature using Raman spectroscopy. Measurement results indicated that the temperature variation had an important effect on the absorption spectra. When the temperature falled, the absorption peak shifted to higher frequencies, and several new absorption peaks appeared. Aliphatic and aromatic amino acid displayed different responses in the line width and the absorption strength. Furthermore, we used the quantum chemistry Gaussian 09 software package to calculate the THz spectra of one molecule and unit cell of L-Asparagine and L-Tyrosine at room temperature by density functional theory. The calculation results indicate that intermolecular vibration and rotation strongly influence the absorption in THz frequencies for L-Asparagine and L-Tyrosine.
引 言
太赫兹波是一种介于微波和红外之间的电磁波, 频率范围在0.1~10 THz之间, 具有很强的穿透性。 利用这一特点, 太赫兹光谱技术在生物医学、 环境检测、 安全检查、 通信领域及天文学领域均得到广泛应用[1, 2, 3, 4], 因为当前经常被使用在安检领域的金属探测法、 共振法、 中子法以及X射线法对人体都会造成一定的伤害, 故这些方法只能应用在货品和行李的检测上; 而太赫兹脉冲能量较低, 不会致使生物分子产生光电离现象, 这让它成为一种有效的无损检测方法, 也逐步被应用在生物分子领域的研究中。
Yi等[5]利用太赫兹时域光谱技术(THz-TDS), 在室温下对20种氨基酸进行了光谱测试分析, 得出氨基酸在0~6 THz宽频谱范围内的特征指纹谱。 Williams等[6]报道了多晶缬氨酸样品的实验和计算的太赫兹光谱。 使用太赫兹时域光谱在室温和低温(78 K)条件下对L-缬氨酸进行光谱测量, 实验发现随着温度升高, 吸收峰发生红移现象。 Michael等[7]利用太赫兹时域光谱技术分别对DL-亮氨酸和DL-缬氨酸进行了测试, 当温度由常温降低到80 K时, DL-亮氨酸三个吸收峰由1.37, 1.87和2.25 THz偏移到了1.47, 1.97和2.54 THz, DL-缬氨酸的吸收峰由1.70 THz偏移到了1.73 THz; 同时吸收峰线宽随温度降低而变窄。 以上研究均表明氨基酸在太赫兹频段具有强烈的温度相关性, 但前人的研究仅限于两个温度的结果对比, 且所选氨基酸均属于脂肪族氨基酸, 因此本文将选取多个温度节点对三种脂肪族氨基酸和一种芳香族氨基酸进行以上研究, 结合拉曼光谱, 并分别对其单分子和晶胞结构进行理论计算, 以研究不同类别氨基酸的太赫兹光谱与温度的相关性。
本实验利用THz-TDS技术, 对脂肪族L-天冬酰胺、 L-半胱氨酸、 L-丙氨酸和芳香族L-酪氨酸四种氨基酸, 选取常温, 250, 200, 150, 100, 70, 40, 10以及4.5 K等温度节点进行THz光谱测量, 测试其吸收峰。 由于样品分子及结构的振动能级等信息均能通过拉曼散射光谱和红外吸收光谱得到, 因此这两种方法称为研究分子结构的有利工具。 因二者选择定则的区别, 拉曼散射光谱可以作为红外光谱在研究分子结构方面互为补充的一种方法[8]。 因而在常温下, 我们结合了拉曼光谱仪对上述四种氨基酸样品在高频段(3~6 THz)范围内进行测试, 并将测试结果与本实验测试结果进行对比, 得出吸收峰位置的一致性, 验证了实验的准确性。 研究发现, 随着温度降低, 氨基酸的吸收峰位置发生蓝移, 同时脂肪族氨基酸的吸收峰线宽变窄, 且L-天冬酰胺和L-半胱氨酸的吸收强度增加, 芳香族氨基酸L-酪氨酸吸收线宽及强度不变, 部分氨基酸在低频段有新的吸收峰出现。 采用密度泛函理论计算了L-天冬酰胺和L-酪氨酸单分子和晶胞分子的太赫兹光谱, 通过与实验结果对比发现这两种氨基酸存在较强的分子间作用力, 对太赫兹吸收峰影响较大。
实验测量的样品均购于上海西格玛奥德里奇化学试剂公司, 纯度高于99%且不经进一步提纯使用。 L-天冬酰胺(L-Asparagine), 脂肪族氨基酸, 分子式: C4H8N2O3, 分子量: 132.12。 L-半胱氨酸(L-Cysteine), 脂肪族氨基酸, 分子式: C3H7NO2S, 分子量: 121.15。 L-丙氨酸(L-Alanine), 脂肪族氨基酸, 分子式: C3H7NO2, 分子量: 89.09。 呈无色斜方结晶或结晶性粉末, 溶于水、 乙醇, 不溶于乙醚和丙酮。 L-酪氨酸(L-Tyrosine), 芳香族氨基酸, 分子式: C9H11NO3, 分子量: 181.19。 呈结晶性粉末。
氨基酸固体样品重量在8~12.5 mg之间变化, 为了确保样品粒径远小于太赫兹波长, 从而减少非共振光散射而产生的较高频率处的基线偏移, 我们在研钵中将材料研磨来制备样品[9]。 为了将纯样品对THz波的吸收强度降低到适当的水平, 考虑到聚乙烯在太赫兹波段基本透明的这一特点, 我们将纯样品分别与100 mg聚乙烯混合后, 在13 mm直径的真空模具中压制成大约1 mm厚度的薄片, 压力为30 MPa, 保持两表面平行无裂痕, 同时将100 mg的聚乙烯粉末按照相同的方法压制成同样规格的薄片, 将其作为参考背景。
氨基酸太赫兹光谱的温度相关性实验采用南京大学的可调温太赫兹时域光谱系统(THz-TDS), 其太赫兹透射光谱的测量范围在0.5~2 THz, 系统的频率分辨率低于10 GHz。 飞秒激光器为钛宝石自锁模激光器, 可以产生800 nm的中心波长、 82 MHz的重复频率以及小于100 fs的持续时间飞秒激光脉冲。 仪器连接的Mercury iTC温度控制器测量和控制温度可低至250 mK, 可以通过添加卡扩展控制器功能。 实验过程中, 为了测量低温下不同温度节点氨基酸对THz光谱的吸收谱图, 我们将液氦充入配有光学窗口的杜瓦外腔, 利用温度控制器控制需要测量的温度, 通过向杜瓦内腔充入氦气使得内外腔温度平衡, 此时样品与氦气通过接触式降温以达到测量温度。 样品温度最低可达到4.5 K。
我们还采用了Advantest公司TAS7500SP型太赫兹时域光谱仪[10], 用于测量氨基酸样品在0.5~4 THz范围内的常温特性。 系统分辨率7.6 GHz, 动态范围高于60 dB, 仪器自带样品腔, 测量时对空气进行干燥以减少空气中的水汽对THz波吸收的影响。
拉曼光谱仪采用美国Thermo公司的DXR532型激光拉曼光谱仪。 仪器配有两种激光器系统: 532和780 nm, 本文选用780 nm激光器。 样品点激光功率控制精度达0.1 mW; 拉曼频移范围为3~99 THz; 空间分辨率高于1 μ m; 光谱重复性不高于± 0.2 cm-1。 使用拉曼光谱仪测试仅需将纯样品放置于一块载玻片上, 再在上面盖另一块干净的载玻片, 将样品压平后置于拉曼显微镜下, 调整焦距以寻找最佳测试点便可完成拉曼光谱测试。
FTIR采用Bruker公司的Vertex80V型傅里叶变换红外光谱仪[11], 系统分辨率优于13.5 GHz, 信噪比高于50 000∶ 1, 仪器自带样品腔, 测量时通过抽真空来减少空气中的水分, 从而提高信噪比。 仪器在远红外波段具有针对不同波束范围的分束器: 6 μ m Mylar膜(680~30 cm-1)、 25 μ m Mylar膜(120~20 cm-1), 50 μ m Mylar膜(60~10 cm-1)、 125 μ m Mylar膜(20~5 cm-1), 因其在各频段范围内精度不同, 可对样品进行有选择性的缩小或扩大频段范围, 便于研究, 本文选择的是6 μ m Mylar膜和25 μ m Mylar膜, 主要进行0.6~10 THz范围的测量。
要进行各项研究, 首先要对物质的宏观光学性质有一个了解, 实折射率和消光系数就是用来表征它的物理量, 而太赫兹波段材料的光学常数数据少。 通过太赫兹时域光谱技术(THz-TDS)可以很方便地提取出该波段内的光学常数。 太赫兹时域光谱系统的响应函数与时间无关, 测量样品时, 要保证样品两表面光滑平行、 结构均匀。
复折射率
对背景信号和样品的时域信号同时作傅里叶变换, 可得到频域信号R(ω )和S(ω )。
样品的幅度ρ (ω )和相位φ (ω )可以由式(2)
得到。
折射率
吸收系数
采用可调温太赫兹时域光谱系统(THz-TDS)测试了四种氨基酸在不同温度下的太赫兹光谱。
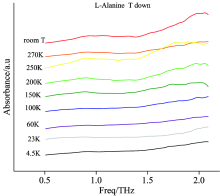
图1是10 mg L-天冬酰胺与100 mg聚乙烯混合均匀后制成的样片在降温和升温过程中的吸收谱图(图中实验的结果在原纵坐标基础上随着温度变化分别向上平移0.1n个单位, 便于区分多次结果), 观察图1可以得出: L-天冬酰胺在常温下有三个较强的吸收峰: 0.92, 1.63和1.86 THz。 随着温度变化, 吸收峰的位置变化如表1所示。
 | 图1 L-天冬酰胺在降温(a)和升温(b)过程中的吸收谱图Fig.1 Absorption spectra of L-Asparagine during cooling (a) and warming (b) |
| 表1 L-天冬酰胺在降温和升温过程中吸收峰位置变化 Table 1 Changes in the absorption peak position of L-Asparagine during cooling and warming |
观察表1中的数据可以得出, 当温度由室温降低到4.5 K时, 0.92, 1.63和1.86THz处的吸收峰分别偏移到0.95, 1.70和1.95 THz; 当温度由4.5 K升高到室温时, 对应位置的吸收峰又由0.95, 1.70和1.95 THz偏移到0.92, 1.64和1.86 THz。 随着温度升高, 吸收峰位置偏移在0.1 THz左右, 由于仪器的分辨率为10 GHz, 因此认为蓝移现象不是由设备误差引起的, 同时从图1可以观察到在4.5 K时吸收峰线宽最窄。 对比升温和降温过程中的同一温度发现, 吸收峰位置变化也在误差范围内, 没有受到温度影响而发生变化, 说明在温度变化过程中氨基酸的生物特性并没有发生改变。
图2是10 mg L-半胱氨酸与100 mg聚乙烯混合均匀后制成的样片在降温和升温过程中的吸收谱图, 观察图2可以得出: L-半胱氨酸在常温下有5个较强的吸收峰: 0.60, 1.38, 1.66, 1.79和1.91 THz。 吸收峰位置变化如表2所示。 当温度由室温降低到4.5 K时, 吸收峰相应地偏移到0.61, 1.48, 1.72和1.92 THz, 由于仪器测量范围为0.5~2 THz, 因此1.91 THz处的吸收峰在温度降低到4.5 K时可能偏移到2 THz以上频率, 因此该吸收峰没有检测到, 观察光谱图可以发现4.5 K时的吸收峰线宽更窄; 同时0.77和1.60 THz处有新的吸收峰出现。 当温度由4.5 K再次升温回到室温时, 吸收峰由0.61, 1.48, 1.72和1.92 THz分别偏移到了0.60, 1.38, 1.67和1.79 THz, 且随着温度升高, 吸收峰的强度也逐渐减弱。
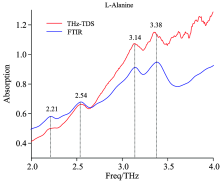
图3是10 mg L-丙氨酸与100 mg聚乙烯混合均匀后制成的样片在降温过程中的吸收谱图, 在0.5~2 THz频率范围内, 没有发现明显的吸收峰。 因此采用频率范围更宽的FTIR光谱仪和TAS7500SP常温时域光谱仪测试其高频特性, 如图4所示, 在2.21, 2.54, 3.14和3.38 THz处有明显的吸收峰, 且FTIR和THz-TDS两台仪器测得的吸收峰位置基本一致, 验证了实验的准确性。 由于TAS7500SP常温时域光谱仪在3.5 THz以上的信噪比急剧下降, 导致实验结果不准确。
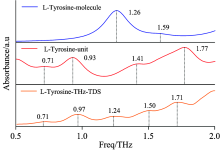
图5是12.5 mg L-酪氨酸与100 mg聚乙烯混合均匀后制成的样片在降温和升温过程中的吸收谱图, 观察图5可以得出: L-酪氨酸在常温下有六个较强的吸收峰: 0.71, 0.97, 1.24, 1.50, 1.71和1.97 THz。 当温度由室温降低到4.5 K时, 对应的吸收峰分别偏移到0.77, 1.04, 1.31, 1.60, 1.78和1.99 THz; 当温度由4.5 K升高到270 K时, 对应的吸收峰由0.77, 1.04, 1.31, 1.60, 1.78和1.99 THz又分别偏移到了0.71, 0.97, 1.25, 1.50, 1.72和1.97 THz。 由此可以得出随着温度降低, 酪氨酸对太赫兹光谱的吸收峰有蓝移的规律, 但吸收峰线宽和强度在温度降低过程中没有明显变化。
| 表2 L-半胱氨酸在降温和升温过程中的吸收峰位置变化 Table 2 Changes in the absorption peak position of L-Cysteine during cooling and warming |
| 表3 L-酪氨酸在降温和升温过程中吸收峰的位置变化 Table 3 Changes in the absorption peak position of L-Tyrosine during cooling and warming |
图6是采用可调温THz-TDS、 FTIR及拉曼光谱仪三种仪器测试结果的比较, 样品温度均为常温, 其中FTIR的测试结果是综合6 μ m Mylar膜和25 μ m Mylar膜两种分束器的测试结果, 0.5~2 THz范围是由25 μ m Mylar膜分束器测得, 3~6 THz范围是由6 μ m Mylar膜测得。
 | 图6(a) L-天冬酰胺的拉曼光谱与THz-TDS和FTIR测得的太赫兹光谱测试结果的比较Fig.6(a) Comparison of Raman spectra of L-Asparagine with THz-TDS and FTIR measured terahertz spectroscopy results |
 | 图6(b) L-半胱氨酸的拉曼光谱与THz-TDS和FTIR测得的太赫兹光谱测试结果的比较Fig.6(b) Comparison of Raman spectra of L-Cysteine with THz-TDS and FTIR measured terahertz spectroscopy results |
 | 图6(c) L-丙氨酸的拉曼光谱与THz-TDS和FTIR测得的太赫兹光谱测试结果的比较Fig.6(c) Comparison of Raman spectra of L-Alanine with THz-TDS and FTIR measured terahertz spectroscopy results |
 | 图6(d) L-酪氨酸的拉曼光谱与THz-TDS和FTIR测得的太赫兹光谱测试结果的比较Fig.6(d) Comparison of Raman spectra of L-Tyrosine with THz-TDS and FTIR measured terahertz spectroscopy results |
在0.5~2 THz范围内, 对比FTIR和可调温THz-TDS两台仪器的测试结果, 观察图6(a)— (d)四图中的左图可以发现, 两种仪器能够测出一致的吸收峰, 且可调温THz-TDS更为精确, 能够测出更多的吸收峰, 特别是能检测出简并峰。
在3~6 THz范围内, 对比FTIR和拉曼光谱仪的测试结果, 可以发现样品吸收峰所在频率与拉曼强度相对应, 进一步验证了实验的准确性。
本论文采用量子化学Gaussian09软件包[12], 分别选取一种脂肪族氨基酸L-天冬酰胺和一种芳香族氨基酸L-酪氨酸, 对其分子结构进行计算, 分子结构来自于剑桥晶体结构中心(cambridge crystallographic data centre, CCDC), 两种氨基酸的分子结构如图7所示。 计算过程中选用密度泛函理论, 采用B3LYP/6-31G(d)方法分别对这两种氨基酸的单分子结构和晶胞进行了计算。
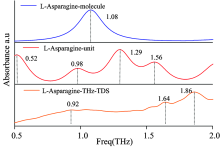
图8是脂肪族氨基酸L-天冬酰胺和芳香族氨基酸L-酪氨酸单分子结构和晶胞结构的计算结果与常温下测试结果的对比, 观察图8可以发现晶胞结构计算结果与实验所得吸收峰位置基本能一一对应, 也进一步验证了实验的准确性, 同时说明单分子的振动模式主要是由分子内作用力决定的, 而晶胞的振动模式由分子内作用力和分子间作用力共同决定, 与实验所处的环境更为吻合。
利用可调温太赫兹时域光谱仪, 对三种脂肪族氨基酸L-天冬酰胺、 L-半胱氨酸、 L-丙氨酸和一种芳香族氨基酸L-酪氨酸在0.5~2.0 THz频带范围内进行了光谱特性与温度相关性的研究, 结合傅里叶变换红外光谱技术拓展了频率测量范围, 验证了太赫兹时域光谱的准确性, 利用拉曼光谱进一步验证了常温下太赫兹时域光谱的测试结果。
实验发现随着温度降低, 脂肪族L-天冬酰胺、 L-半胱氨酸的吸收峰均有蓝移的现象, 在低温下吸收峰线宽更窄, 强度更强, 更容易辨别, 当温度降低到40 K时, 发现L-半胱氨酸在0.75和1.60 THz处有新的吸收峰出现; 芳香族L-酪氨酸在温度降低过程中吸收峰有蓝移现象, 但吸收强度和线宽基本没变化。
利用Gaussian软件对脂肪族L-天冬酰胺和芳香族L-酪氨酸分子的晶胞结构进行计算, 得出与测试相一致的吸收峰, 预测分子间的作用力对氨基酸类分子的太赫兹光谱吸收影响较大。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|