作者简介: 刘宏伟, 1969年生, 湖南工学院材料与化学工程学院教授 e-mail: hwl0466@163.com
研究应用电感耦合等离子体串联质谱(ICP-MS/MS)技术建立准确测定野生藜蒿中12个微量元素的分析方法。 采用MS/MS模式, 以O2为反应气, 元素As和Se与O2发生质量转移反应生成AsO和SeO, 通过测定AsO和SeO消除质谱干扰; 以NH3/He为反应气, 元素Cr, Mn, Fe, Co, Ni, Cu, Zn与NH3/He发生质量转移反应形成团簇离子, 通过测定团簇离子消除质谱干扰。 元素Cd, Hg和Pb采用标准模式进行测定。 12个待测元素的校准曲线在0~200 μg·L-1范围内具有良好的线性关系, 各元素的检出限为0.64~49.61 ng·L-1。 通过测定国家标准物质芹菜(GBW10048), 采用t检验法进行差异性检验表明, 测定值与标准值之间无显著性差异, 验证了方法的准确可靠性。 各元素的加标回收率在92.0%~106.1%之间, 相对标准偏差(RSD)为1.6%~4.9%。 分析了来自国内不同地区的4个野生藜蒿样品, 结果显示, 不同来源样品中12个元素的含量各有差异, Mn, Fe, Zn的含量远高于其余九种元素, 毒理性元素As, Cd, Hg和Pb的含量处于极低水平。 方法能准确测定野生藜蒿中的多种微量元素, 为野生藜蒿的食用营养和安全提供科学的理论依据。
An analytical method for the accurate determination of 12 kinds of trace elements in wild Artemisia Selengensis by inductively coupled plasma tandem mass spectrometry (ICP-MS/MS) was established. In the MS/MS mode, AsO and SeO were formed by mass shift reaction of As and Se with O2, and AsO and SeO were used to eliminate mass spectral interferences. Using NH3/He as the reaction gas, Cr, Mn, Fe, Co, Ni, Cu, and Zn were reacted with NH3/He to form clusters ions, by measuring the cluster ions to eliminate mass spectral interferences. Cd, Hg and Pb were measured using standard mode. The calibration curves of analytes in the 0~200 μg·L-1 range has a good linear relationship, and the detection limit is 0.64~49.61 ng·L-1. By analyzing the national standard material celery (GBW 10048), the difference test was carried out by t test, and the results showed that there was no significant difference between the measured value and the certified value, and the method was proved to be accurate and reliable. The spike recovery was 92.0%~106.1%, and the RSD was 1.6%~4.9% for twelve elements. Analyzing from 4 samples of wild Artemisia Selengensis in different areas of China, according to the results, different sources of 12 elements content in the samples vary, the contents of Mn, Fe, Zn are much higher than the rest of the 9 kinds of elements, and poison rational elements of As, Cd, Hg, Pb content are very low. The method can accurately determine a variety of trace elements in the wild Artemisia Selengensis, and provide scientific theoretical basis for the edible nutrition and safety of the wild Artemisia Selengensis.
藜蒿(Artemisia selengensis)又名萎蒿、 芦蒿, 属菊科蒿属多年生草本植物, 其可食用部分为幼苗嫩茎和地下肉茎[1]。 藜蒿味道清香独特, 肉质脆嫩爽口, 富含膳食纤维、 蛋白质、 硫胺素、 胡萝卜素和抗坏血酸等多类营养成分, 具有极高的食用价值[2]。 藜蒿还富含护肝消炎的三萜化合物和抗氧化黄酮类化合物, 具有止血消炎、 镇咳化痰、 开胃健脾、 散寒除湿等药用价值[3, 4], 在我国现存最早的中药名著《神农本草》和《本草纲目》中均有详细记载。 因此, 藜蒿既是营养丰富的风味蔬菜, 又具有防治疾病的效果。
藜蒿作为一种野生植物资源, 具有强大的抗逆性, 喜湿耐热, 生命力旺盛, 是典型的无病毒、 无害虫绿色蔬菜, 但藜蒿对其生长环境中的重金属元素具有较强的富集能力[5], 影响其食用安全性, 准确掌握藜蒿中微量元素的组成和含量对于正确理解人体微量元素的补充以及重金属元素的毒理性均具有极其重要的作用。 目前, 有关植物资源中无机微量元素的分析采用的主要方法有原子吸收(AAS)法、 电感耦合等离子体发射光谱(ICP-OES)法和电感耦合等离子体质谱(ICP-MS)法[6, 7, 8], 其中, ICP-MS法所具有的高灵敏度、 低检出限以及多元素快速测定的特点, 非常适合微量及痕量元素元素的测定[9, 10, 11], 但所面临的质谱干扰仍然是影响ICP-MS准确测定的致命弱点, 虽然发展了一系列消除干扰技术, 在一定程度上也减弱或消除了质谱干扰, 然而这些技术仍然缺乏通用性或灵敏度受损严重[12, 13]。 本实验利用电感耦合等离子体串联质谱(ICP-MS/MS)对来自不同地区的藜蒿样品中的12个微量元素进行测定, 针对测定过程中的质谱干扰, 选择碰撞反应池(CRC)的反应模式, 通过两个质量过滤器的双质量数选择, 精准控制进入CRC中的目标离子, 几乎消除了测定过程中的所有质谱干扰, 为藜蒿中微量元素的准确测定提供了一种高通量分析方法。
藜蒿采自湖南岳阳、 江西九江、 湖北黄石和安徽肥东, 经湖南中医药研究院黄建华博士鉴定为菊科蒿属多年生草本植物根茎部位。
1 000 mg· L-1的Cr, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Cd, Hg和Pb标准贮备溶液, 国家有色金属及电子材料分析测试中心; 10 mg· L-1的Li, Sc, Ge, Y, In, Tb和Bi内标溶液(编号: p/n 5183-4681) 美国Agilent公司; 65%(w/w)硝酸和35%(w/w)双氧水, 德国默克; Milli超纯水。
Agilent 8800 ICP-MS/MS仪, 美国Agilent公司; Milli-Q超纯水机, 美国Millipore公司; CEM Mars5微波消解仪, 美国培安公司。 ICP-MS/MS优化后的质谱调谐条件为: RF功率, 1 600 W; 等离子气流速, 15.0 L· min-1; 补偿气流速, 0.4 L· min-1; 载气流速, 0.8 L· min-1; 采样深度, 8.0 mm; 反应气, O2和NH3/He; 八极杆偏置电压, -8 V(O2), -18 V(NH3/He); 动能歧视电压, -6 V(O2), -8 V(NH3/He); 反应气流速, 0.2 mL· min-1(O2), 3.0 mL· min-1(NH3/He)。
将采集的新鲜藜蒿幼苗嫩茎用自来水冲洗干净, 再用超纯水清洗5次, 沥干水分后置入预设温度为90 ℃烘箱中, 定时烘干时间为8 h, 样品烘干水分后粉碎过筛。 准确称取约0.25 g粉末样品于微波消解罐内, 加入少量超纯水润湿, 依次加入5 mL硝酸和2 mL双氧水, 拧紧螺帽采用温度爬升模式进行消解。 设置微波消解仪功率为1 600 W, 5 min内升温至120 ℃后继续在3 min内升温至150 ℃, 保持5 min, 继续在3 min内升温至180 ℃, 保持10 min。 消解完成后用超纯水转移消解溶液至250 mL容量瓶中定容, 得到样品溶液。
采用2%(v/v)的硝酸介质配制浓度分别为0.0, 2.0, 10.0, 50.0和200.0 μ g· L-1的系列混合标准溶液, 分别对空白溶液、 样品溶液和系列混合标准溶液进行测定, 并通过在线内标混合接头将内标溶液加入到样品溶液中, 以待测元素与内标元素的分析信号比值对标准溶液所对应的浓度建立校准曲线, 从而计算出样品溶液中各待测元素的浓度。
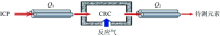
藜蒿富含C, Ca, Mg, P和S等基质元素, 所形成的多原子离子与同量异位素、 双电荷、 二聚体等离子构成了复杂的质谱干扰。 目前常采用带CRC的ICP-MS, 利用He碰撞气或不同的反应气消除干扰。 He碰撞模式不能消除同量异位素和双电荷干扰, As和Se等难电离元素的测定会大幅降低灵敏度; 反应模式虽然比碰撞模式消除干扰的能力强, 但在CRC内由于未知副反应的发生易形成新干扰限制了其应用, 通常在碰撞模式无法消除干扰时才采用反应模式。 ICP-MS/MS是在CRC的前后均配置一个四极杆质量过滤器(见图1), 干扰离子在进入CRC之前, 利用配置在CRC前的第一级四极杆质量过滤器(Q1)去除大量干扰离子, 仅允许与待测离子具有相同质荷比(m/z)的离子进入CRC, 由于能准确控制进入CRC中的离子, 防止未知副反应的发生, 进入CRC的待测离子或干扰离子与反应气发生质量转移反应, 利用配置在CRC后的第二级四极杆质量过滤器(Q2), 设置Q2的m/z来消除Q1没能消除的质谱干扰, 从而实现待测元素的无干扰测定[14, 15, 16]。
12个待测元素存在的潜在质谱干扰见表1, 食品中Mo, W和Os含量极低, 形成的氧化物离子对Cd, Hg和Pb的干扰可以忽略, 其余9个元素所受干扰复杂严重不容忽视。 CRC消除干扰常用的反应气有H2, O2和NH3/He, 其中, NH3/He混合气中, NH3为反应气, He起缓冲作用。 H2是一种弱反应气, 其消除干扰的能力远低于O2和NH3/He, H2作为反应气不足以消除大多数质谱干扰, 限制了H2的应用; O2作为反应气能与基质组分、 待测元素以及多原子物质发生反应, 形成氧化物, 在CRC中的应用已经非常成熟, 作为最强大也是应用最广泛的质谱反应气, 非常适合非金属元素的测定, 对于本实验中As和Se的测定, 采用O2为反应气, As和Se均能与O2反应生成氧化物, 而干扰As和Se测定的所有干扰物均不能与O2反应, 因此, 通过O2质量转移, 将As和Se转移为AsO和SeO进行测定; NH3/He作为强反应气, 很难与非金属元素发生反应, 但易与金属离子发生配位反应形成团簇离子, 因此, NH3/He非常适合金属元素的测定, 本实验中, 对于测定Cr, Mn, Fe, Co, Ni, Cu和Zn时所存在的质谱干扰, 选择NH3/He为反应气进行消除, 所形成的产物离子见表1。 元素Cd, Hg和Pb所受质谱干扰可忽略, 无需启用CRC, 本实验中选用无气模式便能进行准确测定。
在MS/MS模式下(同时启动Q1和Q2), 设置Q1=75, 阻止m/z≠ 75的所有干扰离子通过Q1, 允许75As+及m/z=75的干扰离子40Ar35Cl+, 36Ar38Ar1H+, 150Nd++, 150Sm++通过Q1进入CRC, 在CRC中加入O2, 75As+与O2发生反应(Δ Hr< 0), 能自发生成75As16O+, 而干扰离子40Ar35Cl+, 36Ar38Ar1H+, 150Nd++, 150Sm++不与O2发生反应, 设置Q2=91, 仅75As16O+能通过Q2而干扰离子40Ar35Cl+, 36Ar38Ar1H+, 150Nd++, 150Sm++被Q2阻止在外, 通过Q1和Q2的双四极杆质量过滤器作用, 从而消除As测定过程中的所有质谱干扰。 78Se+与O2不能自发反应, 实验通过设置八极杆偏置电压为较小的负值促使78Se+与O2反应生成78Se16O+, 而78Kr+, 40Ar38Ar+, 156Gd++不与O2发生反应, 设置Q1=78/Q2=94, 从而消除Se测定过程中的所有质谱干扰。
采用NH3/He为反应气, 在MS/MS模式下, 设置Q1=52, 52Cr+及其干扰离子40Ar12C+, 36Ar16O+, 38Ar14N+通过Q1后进入充满NH3/He的CRC中, 52Cr+与NH3/He发生反应, 能生成52Cr(14NH)+, 52Cr(14NH2)+, 52Cr(14NH3)+, 52Cr(14NH3
| 表1 待测元素潜在的质谱干扰 Table 1 Potential mass spectral interference of analytes |
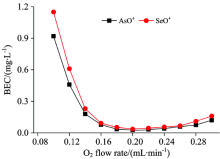
在CRC中, 反应气作为一种反应物与干扰离子或待测离子发生反应, 反应气的浓度决定反应速度和反应产物, 而反应气流速决定反应气浓度, 因此, 反应气流速的大小影响消除质谱干扰的效果。 实验考察了不同反应气流速下各待测离子背景等效浓度(BEC)的变化, 图2所示为不同O2流速下, 75As16O+和78Se16O+的BEC变化情况, 随着O2流速的增大, 75As16O+和78Se16O+的BEC迅速变小, 当O2流速分别达到0.18和0.20 mL· min-1时, 75As16O+和78Se16O+的BEC处于最小值, 随后随着O2流速的增大逐渐变大, 因此, 本实验选择O2流速为0.20 mL· min-1, 此时, 75As16O+的BEC均处于较小值, 而78Se16O+的BEC处于最小值。
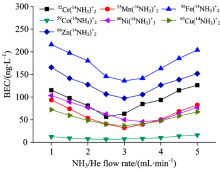
图3为NH3/He流速对52Cr, 55Mn, 56Fe, 59Co, 60Ni, 63Cu, 66Zn形成团簇离子的影响情况, 随着NH3/He流速的增大, 52Cr(14NH3
针对藜蒿中复杂基质所形成的基体效应, 本实验采用内标元素法进行校正, 采用仪器专用的“ T” 型内标混合接头, 将1 mg· L-1的Li, Sc, Ge, Y, In, Tb, Bi内标溶液在线加入到待测溶液中, 在MS/MS模式下, 内标元素与反应气发生反应, 生成相应的氧化物和团簇离子, 各待测元素内标的分配见表2。 以内标元素为参考点对待测元素进行校准表明, 各元素在0~200 μ g· L-1范围内的线性相关系数≥ 0.999 8, 具有良好的线性关系。 采用空白溶液重复测定11次, 所对应的3 倍标准偏差所获得各元素仪器的检出限为0.64~49.61 ng· L-1。
| 表2 内标元素的分配与检出限 Table 2 The allocation of internal standard (ISTD) element and the detection limit (DL) |
采用所建立的方法对国家标准物质芹菜(GBW10048)重复测定11次, 利用t检验法对测定结果与标准值进行统计学比较, 所有测定元素的p> 0.05, 表3结果表明, 测定结果与标准值无显著性差异; 为进一步考察方法的准确度与精密度, 选取来自湖南的一个野生藜蒿样品进行加标回收实验, 加标样品重复测定11次, 表4结果表明, 所有元素的加标回收率在92.0%~106.1%之间, 相对标准偏差(RSD)在1.6%~4.9%之间。 表明所建立的分析方法具有良好的准确性和精密度。
| 表3 方法的准确性 Table 3 Accuracy of the method |
| 表4 实际样品的加标回收率和精密度 Table 4 Spike recovery and precision of the practical sample |
采用本法分别对来自湖南, 江西, 湖北和安徽的4个野生藜蒿样品(样品编号分别为1, 2, 3, 4)进行测定, 每个样品重复测定11次, 结果见表5。 4个藜蒿样品中Mn, Fe, Zn的含量处于较高水平, 参照GB 2762— 2017《食品安全国家标准食品中污染物限量》, 毒理性元素除As, Cd, Hg, Pb的含量远低于限量标准(As< 0.5 μ g· g-1, Cd< 0.1 μ g· g-1, Hg< 0.01 μ g· g-1, Pb< 1.0 μ g· g-1), 处于极低水平。 藜蒿样品虽然对重金属元素具有较强的富集能力, 但通过本实验结果可以间接反映4个藜蒿样品的生存环境良好, 无食用风险。
| 表5 样品分析结果 Table 5 Analytical results of samples |
建立了ICP-MS/MS法测定藜蒿中Cr, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Cd, Hg, Pb等12种微量元素的分析方法。 在MS/MS模式下, 采用O2和NH3/He为反应气, 利用质量转移法消除了测定过程中的质谱干扰。 方法的检出限为0.64~49.61 ng· L-1, 各元素的加标回收率在92.0%~106.1%之间, RSD在1.6%~4.9%之间。 藜蒿中富含大量Mn, Fe, Zn, 而毒理性元素As, Cd, Hg, Pb的含量极低, 藜蒿具有较高的食用价值, 是典型的纯天然绿色无污染食品。 方法具有无干扰, 灵敏度和准确度高, 精密好的特点, 适合野生藜蒿中的多种微量元素的快速分析, 为正确评价野生藜蒿的食用营养和安全提供了一种新的分析方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|