作者简介: 李 红, 1992年生, 烟台大学硕士研究生 e-mail: 1830319858@qq.com
立体化学是影响外源性药物与生物功能大分子相互作用的关键结构因素。 人参皂苷Rh2具有抗肿瘤等生理活性, 已发现其中的C-20立体化学与多种生物学效应有关, 但其与体内重要药物载体血清白蛋白(SA)相互作用的立体选择性研究鲜见报道。 为此, 采用紫外吸收光谱、 荧光光谱、 同步荧光光谱和分子对接技术, 研究人参皂苷Rh2的C-20差向异构体在模拟生理条件下与SA相互作用的立体选择性特点及其机制。 20S-和20R-Rh2均能与SA按摩尔比1∶1自发形成稳定的复合物, 主要通过氢键和疏水相互作用, 使SA的相关发光基团疏水性增强, 同时改变Trp, Tyr等氨基酸残基周围微环境, 从而影响紫外光谱特征吸收峰的位置和强度, 并引起内源荧光的静态猝灭。 二者与SA的相互作用特征及结合模式均存在显著差异, 突出表现为结合区域以及参与氢键和疏水相互作用的基团和氨基酸残基数目及类别明显不同, 20S-Rh2具有相对更高的结合常数和结合自由能。 人参皂苷Rh2与血清白蛋白的相互作用具有立体选择性, C-20立体化学差异是其中的重要机制。
Stereochemistry plays an important role in the interactions between functional bio-macromolecules and exogenous small-molecule drugs. Ginsenoside Rh2 is an effective constituent of ginseng with chirality of hydroxyl group at carbon-20, which has been found closely related to its multiple biological effects such as anti-tumor activity. However, the stereoselectivity of ginsenoside Rh2 interacting with serum albumin (SA), a vital drug carrier in the body, has been rarely reported. In the present study, interactions between SA and the C-20 eipmers of ginsenoside Rh2 were investigated under simulative physiological condition by molecular docking method and spectroscopic analyses, including UV absorption, fluorescence and synchronous fluorescence spectroscopy. Results showed that both 20S- and 20R-Rh2 could form 1∶1 type non-covalent complex with SA mainly via hydrogen bond and hydrophobic forces. According to the influence on spectra of SA, both epimers led to some increase in hydrophobicity for the light emitting residues of SA, as well as the change in micro-environment around some residues (including tyrosine and tryptophan) responsible for intrinsic fluorescence of SA, and fluorescence quenching mainly by a static mode. However, 20S-Rh2 displayed relatively larger binding constant and free energy in contrast with 20R-Rh2, suggesting stereoselective characteristics of the eipmers. The stereo-selectivity of ginsenoside Rh2 interacted with serum albumin may be related with stereochemistry of C-20.
手性现象普遍存在于生物功能大分子和药物小分子中, 并显著影响外源性药物与机体相互作用效果。 一方面, 生物大分子对于小分子配体的识别和处置可能具有立体选择性[1, 2]; 另一方面, 外源性小分子药物也可能立体选择性地发挥生物学效应, 一个典型的例证就是抗凝血药华法令[5]。 在生理浓度下, R-华法令可通过与孕烷X受体(PXR)相互作用, 显著诱导CYP3A4和CYP2C9的mRNA表达, S-华法令则无类似作用[3, 4]。 手性药物分子与生物大分子间相互作用的立体选择性, 已成为临床前和临床药物研发中备受关注的研究内容[5]。
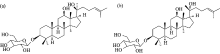
传统滋补中药人参为五加科植物Panax ginseng CA Mey.的干燥根和根茎, 具有大补元气、 复脉固脱、 补益脾肺、 生津养血、 安神益智的功效, 人参皂苷是主要有效成分, 在化学结构上, 绝大多数人参皂苷属于达玛烷型四环三萜, 并在分子骨架上有多个手性碳原子, 尤其是C20-OH的立体化学特征, 极大影响人参皂苷差向异构体生物学效应的程度和方向[6]。 作为原人参二醇(PPD)衍生的一种单糖皂苷, 人参皂苷Rh2(图1)是红参的特有成分, 具有抗肿瘤、 抗炎、 增强免疫、 耐缺氧等药理活性, C-20的手性导致其在多种生物学效应上表现出立体选择性[7]。 已有研究表明, C-20构型和C-3糖基数一样, 是影响人参皂苷Rh2及其衍生物细胞毒活性的关键结构因素; 对于雄激素依赖和非依赖型前列腺癌细胞的体外增殖, 20S-Rh2而非20R-Rh2能够产生显著的抑制活性[8, 9, 10]。 人参皂苷Rh2的差向异构体在细胞膜透过性、 口服吸收、 肠道转化、 对药物代谢酶影响等药动学特征上亦存在立体选择性[11, 12, 13], 但相关机制研究还十分有限。
血清白蛋白SA(serum albumin)是血浆中含量最丰富的一种蛋白质(~50%~60%), 参与许多重要生理功能, 不仅维持正常的血液pH值和血浆胶体渗透压, 也是诸多内源和外源性物质在体内结合、 运输的重要载体, 因此, 药物分子与SA的相互作用研究广泛应用于阐明药物的体内药理作用和生物处置特征[14]。 本工作以人参皂苷Rh2的C-20差向异构体(图1)为对象, 综合应用紫外吸收光谱、 荧光和同步荧光光谱, 分析二者与SA相互作用的立体选择性, 并利用分子对接技术研究结合位点和结合模式的差异, 为理解人参皂苷类成分的立体选择性作用机制提供新的实验依据。
F-7000荧光分光光度计(日本日立高新技术公司); UV-2550紫外-可见分光光度计(日本日立高新技术公司); DC-4006型高精度恒温水浴槽(上海维菱科学仪器有限公司); 牛血清白蛋白(BSA, Sigma公司), 用Tris-HCl缓冲液配成2.0× 10-5 mol· L-1的储备液, 4 ℃避光保存; 人参皂苷20S-Rh2, 20R-Rh2(本实验室自制, 纯度> 98%), 均用二甲基亚砜(DMSO)配成10 mmol· L-1标准溶液, 4 ℃避光保存。 其余试剂均为国产分析纯, 实验用水为超纯水。
1.2.1 紫外吸收光谱测定
精密量取人参皂苷20S-Rh2, 20R-Rh2标准溶液0, 0.01, 0.02, 0.05, 0.1, 0.2和0.3 mL, 分别置10 mL容量瓶中, 加入BSA溶液(2.0× 10-5 mol· L-1)0.05 mL, Tris-HCl缓冲液(pH 7.40)定容, 于310 K恒温水浴中作用20 min, 以相同条件下的空白试剂为参比, 在200~400 nm范围内扫描测定各溶液的紫外吸收光谱。
1.2.2 荧光光谱和恒波长同步荧光光谱测定
精密量取人参皂苷20S-Rh2, 20R-Rh2标准溶液0, 0.02, 0.05, 0.1, 0.2, 0.3, 0.4 mL分别置于10 mL容量瓶中, 加BSA溶液(2.0× 10-5 mol· L-1)0.5 mL, 用Tris-HCl缓冲液(pH 7.40)定容, 于310 K恒温水浴中作用20 min, 以相同条件下的空白试剂为参比, 扫描测定各溶液在290~450 nm 区间的荧光光谱, 仪器参数: 激发波长280 nm, 激发与发射狭缝宽度均为5 nm, 电压250 V。
同时测定各溶液的恒波长同步荧光光谱, 精密量取人参皂苷20S-Rh2和20R-Rh2标准溶液0, 0.01, 0.02, 0.05, 0.1, 0.3 mL分别置10 mL容量瓶中, 加BSA溶液(2.0× 10-5 mol· L-1)0.5 mL, Tris-HCl缓冲液(pH 7.40)定容, 分别设置Δ λ =15 nm、 起始发射波长255 nm和Δ λ =60 nm、 起始发射波长300 nm, 扫描激发波长范围均为240~340 nm。
1.2.3 分子对接
分子对接研究采用包含丰富功能模块的Schrö dinger药物发现软件包(Schrö dinger, LLC, New York, NY, 2015)完成[15, 16, 17]。 目标蛋白选择与BSA在氨基酸序列、 高级结构及生理功能上均高度相似的人血清白蛋白(human serum albumin, HSA), 其三维结构信息取自蛋白质晶体结构数据库(PDB, http://www.rscb.org/pdb/, PDB ID: 4IW1)。 在对接前, 分别针对大分子蛋白和配体小分子结构进行优化处理[18]。 其中, 由蛋白质准备向导模块(protein preparation wizard)完成蛋白质准备, 包括添加缺失的氢原子和氨基酸残基, 对氢键和氨基酸残基取向进行优化, 对质子化状态进行调整, 删除所有异组分和水分子, 并进行整体结构优化; 配体准备使用Mastro10.1辅助设计平台绘制分子的三维结构, 分子能量通过Macro Model模块的液体模拟全原子力场方法(OPLS-2005)优化, 采用Epik模块预测pKa值、 多种互变异构体及可能在特殊条件下存在的离子化状态, 通过GB/SA(generalized-born/surface-area)模块模拟溶剂效应。 经处理的蛋白质和配体分子, 采用网格对接模块(glide docking)在标准精度(standard precision, SP)下进行对接。 根据对接得分筛选关键氨基酸残基, 分析相关作用力类型, 并使用Amber力场的MM-GBSA方法(molecular mechanics/generalized born surface area)计算总结合能Δ Gbind, 其中, 溶剂化模型设置为VSGB(溶剂为水), 力场选择为OPLS-2005, 其他参数设置为默认。
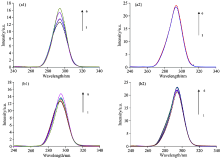
鉴于紫外吸收光谱具有针对性反映蛋白质二级结构变化的能力, 首先测定BSA与人参皂苷20S-Rh2和20R-Rh2相互作用体系在模拟生理条件下(pH 7.40, 310 K)的紫外吸收光谱。 如图2所示, 在模拟的生理条件下, BSA的特征紫外最大吸收出现在280 nm附近, 该波长处吸光度随外源人参皂苷Rh2浓度增大(0~300 μ mol· L-1)呈明显增加趋势, 且伴随一定程度的波长红移(~5 nm), 表明20S-和20R-Rh2均与BSA发生了显著的相互作用, 导致BSA上相关氨基酸残基疏水性增强。 进一步对比图2(a)和(b)发现, 两个差向异构体在引起BSA二级结构变化的量-效关系上存在明显差异。 对于BSA在280 nm附近的特征紫外吸收强度, 低浓度(< 100 μ mol· L-1)的20S-Rh2几乎没有影响, 当达到中等浓度(100~300 μ mol· L-1), 可见显著的增强效应, 且效应强度较等浓度的20R-Rh2大; 但随浓度进一步升高(> 300 μ mol· L-1), 二者的作用强度发生反转, 20R-Rh2较等浓度20S-Rh2显示更大的增幅。
血清白蛋白的内源性荧光与分子中具有芳香共轭结构的氨基酸残基有关, 包括色氨酸(Trp)、 酪氨酸(Tyr)和苯丙氨酸(Phe), 以具有较高荧光量子产率的色氨酸残基为主[15]。 如图3所示, 模拟生理条件下的BSA在342 nm附近有特征的荧光发射, 且荧光强度随外源人参皂苷Rh2浓度增大(0~400 μ mol· L-1)呈明显减弱趋势, 同时伴随一定程度的波长蓝移, 进一步表明20S-和20R-Rh2均与BSA发生了显著的相互作用, 导致相关氨基酸残基周围微环境极性增强, 从而引起内源荧光猝灭和波长蓝移[15]。 对比图3(a)和(b)发现, 两个差向异构体在引起BSA内源性荧光猝灭的量-效关系上同样存在显著性差异。 在试验浓度范围内, 20S-Rh2较20R-Rh2的荧光猝灭效应更强, 高浓度下(400 μ mol· L-1)下可使BSA的荧光强度降低超过50%, 且蓝移程度更大(14 nm vs. 7 nm)。 结果表明, 20S-Rh2与BSA的相互作用程度可能较20R-Rh2更强。
蛋白质分子中氨基酸残基的荧光发射与其所处环境的疏水性有关, 因此荧光光谱可以反映残基所处微环境的变化及其所引起的蛋白质构象的改变。 然而, 内源性Trp和Tyr的荧光光谱严重重叠, 常需采用选择性进一步改善的同步荧光光谱进行蛋白质构象研究。 同步荧光信号的观测结果受激发与发射波长差Δ λ 影响, Δ λ ≤ 15 nm和Δ λ ≥ 60 nm(斯托克斯位移)的同步荧光能够分别选择性地呈现Tyr和Trp的光谱特征[14]。 因此, 针对BSA在模拟生理环境中的同步荧光光谱特征及人参皂苷Rh2的影响, 分别在Δ λ =15和60 nm条件下进行测定, 所得光谱如图4所示。 结果表明, 同步荧光光谱能够更为直观、 清晰地反映人参皂苷Rh2与BSA相互作用的立体选择性特征。
对比图4(a)和(b)发现, 尽管20S-和20R-Rh2对BSA同步荧光光谱的峰值位置均没有明显的影响, 但对峰值强度的影响有且明显不同。 在试验浓度范围内, 20S-Rh2对Δ λ =60 nm的BSA同步荧光光谱峰值强度几乎不产生影响, 但Δ λ =15 nm的同步荧光光谱峰值强度随浓度增加显著提高[图4(a)1], 表明其与BSA相互作用可能主要涉及对Tyr残基附近微环境的影响, 对Trp影响甚微; 随外源20R-Rh2浓度增大, 对两种BSA同步荧光光谱均会引起峰值强度提高, 且效应强度相近[图4(b)], 表明其可能同时影响BSA的Tyr和Trp残基附近微环境。
2.4.1 荧光猝灭机制
为进一步探讨人参皂苷Rh2对BSA的荧光猝灭作用机制, 针对不同猝灭剂浓度下的荧光光谱数据, 采用Stern-Volmer方程进行处理
其中, F0和F分别为未加入和加入猝灭剂的体系荧光强度;
Cq为猝灭剂浓度; KSV和Kq分别为猝灭常数和猝灭速率常数; τ 0为不存在猝灭剂时生物大分子的内源性荧光寿命[14]。 以各体系的(F0-F)/F测量值对cq进行直线拟合, 结果均呈良好线性关系[r> 0.999, 图5(a)]。 进一步根据直线斜率(KSV)和BSA的荧光寿命τ 0(~1.0× 10-8 s), 计算得两个相互作用体系在模拟生理条件下的Kq值分别为3.7× 1012和2.8× 1012 L· (mol· s)-1, 远超过生物大分子的最大碰撞猝灭速率常数(2.0× 1010 L· (mol· s)-1), 表明20S-Rh2和20R-Rh2对BSA的荧光猝灭过程均是通过形成复合物引起静态猝灭, 但20S-Rh2在猝灭速率常数上略高于20R-Rh2。
 | 图5 BSA与人参皂苷Rh2相互作用的Stem-Volmer图(a)和双对数曲线(b)Fig.5 Stem-Volmer plots (a) and double-log plots (b) for fluorescence quenching of BSA by ginsenoside Rh2 cBSA=2.0× 10-5 mol· L-1; λ ex=280 nm; λ em=342 nm |
2.4.2 结合常数与结合位点数
对于静态猝灭体系, 在猝灭剂与复合物在测定波长内均不产生荧光的情况下, 若猝灭剂的量远超过荧光体的量, 可利用Mineweaver-Burk双倒数曲线方程, 计算这种结合类型下的结合常数Ka与结合位点数n[14]
针对人参皂苷20S-Rh2和20R-Rh2对BSA荧光猝灭体系分别进行处理, 结果各体系拟合方程线性关系良好[r> 0.998, 图5(b)]。 根据线性方程截距和斜率, 计算得Ka和n值, 汇总见表1。 结果发现, 在模拟生理条件下, 20S-Rh2和20R-Rh2与BSA相互作用的n值均接近1, 表明二者均按1∶ 1摩尔比与BSA形成复合物; 两个体系的Ka值分别为2.5× 104和1.0× 104 L· mol-1, 进一步证实两个差向异构体均能与BSA形成稳定的分子复合物。
| 表1 人参皂苷-Rh2与BSA作用的结合常数和结合位点数 Table 1 The binding constants and the number of binding sites for the interactions between BSA and ginsenoside Rh2 |
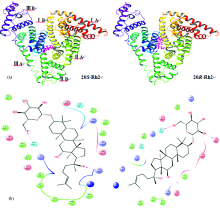 | 图6 HSA与人参皂苷Rh2的结合模式图Fig.6 Binding mode diagrams between HSA and ginsenoside Rh2 (a): Full view; (b): Ligand interaction diagram |
2.4.3 分子对接分析
分子对接是虚拟筛选研究的关键过程, 有助于获得功能蛋白质与小分子配体间相互作用的详细信息[16]。 在光谱实验研究的基础上, 进一步利用分子对接技术, 探索分析血清白蛋白与人参皂苷Rh2相互作用的立体选择性机制, 为充分模拟人体生理环境, 以人血清白蛋白(HSA, PDB ID: 4IW1)作为分子对接研究靶蛋白。 HSA由585个氨基酸残基组成三个同源结构域, 分别包含A和B两个亚域, 并经17个二硫键高度交联成心形的α -螺旋状分子, 在结构和功能上均与BSA高度一致, 小分子配体常结合在Ⅰ 和Ⅱ 两个结构域上[18, 22]。
如图6(a)所示, 对接结果表明, 人参皂苷Rh2差向异构体与HSA相互作用的结合区域存在明显差异, 其中, 20S-Rh2结合在HSA的Ⅰ B和Ⅱ B结构域上, 而20R-Rh2则结
合在Ⅰ B和Ⅲ B上。 二者与HSA的分子对接得分分别为-4.51和-3.82总结合自由能Δ Gbind分别为73.17和69.97 kJ· mol-1, 均为负值, 表明均能与HSA自发形成具有一定热力学稳定性的分子复合物, 但20S-Rh2较20R-Rh2具有更大的结合自由能绝对值, 显示相互作用程度更强, 与上述根据静态猝灭机制计算所得二者在结合常数Ka上的差异一致, 进一步证实20S-Rh2和20R-Rh2均能与血清白蛋白形成相对稳定的复合物, 但结合程度有所不同。
| 表2 HSA与人参皂苷-Rh2的主要相互作用力和氨基酸残基 Table 2 Docking results of the main force and vital residues involved in interaction by HSA and ginsenoside Rh2 |
针对HSA与人参皂苷Rh2相互作用模式的对接分析结果如图6(b)所示, 相互作用力和所涉主要氨基酸残基汇总见表2。 结果表明, 人参皂苷Rh2与HSA间存在氢键、 疏水作用力及静电引力、 范德华力等其他相互作用, 主要通过氢键和疏水作用力锚定在蛋白上, 且关键结合位点在蛋白分子的生色团附近, 因而可能通过相互作用引起内源性荧光猝灭, 从机制上为上述BSA体系的荧光猝灭提供了解释。 然而, 尽管20S-和20R-Rh2均与HSA形成两个氢键, 但C-20立体化学导致二者在结合域上的差异, 参与氢键相互作用的基团和结合方式也完全不同。 20S-Rh2经糖上的C6’ -OH和侧链的C20-OH分别接受氨基酸残基Lys195, Asn295的活泼H形成氢键(2.68, 2.21 Å ), 20R-Rh2则由糖上C2’ -OH和C6’ -OH分别提供活泼H与蛋白的Glu184和His288进行氢键结合(1.67, 1.98 Å )。 立体选择性同样表现在疏水相互作用上。 相比于20R-Rh2, HSA与20S-Rh2的结合涉及更多的氨基酸残基, 导致更稳定的结合, 因而结合自由能和结合常数相对更大(-73.17 vs. -69.97 kJ· mol-1; 2.5× 104vs. 1.0× 104 L· mol-1)。 另一方面, 在HSA与20R-Rh2的疏水相互作用中同时涉及有Trp和Tyr, 对于20S-Rh2, 则仅有Trp参与, 结果导致二者对蛋白同步荧光光谱的影响存在差异。 分子对接进一步解释并验证了上述光谱分析的实验研究结果。
综合应用紫外吸收光谱、 荧光光谱、 同步荧光光谱和分子对接技术, 探讨了人参皂苷Rh2与血清白蛋白的立体选择性相互作用, 获得了C-20差向异构体在蛋白结合机制、 结合位点数及结合强度和模式上的立体选择性差异。 结果表明, 在模拟生理条件下, 20S-和20R-Rh2主要经氢键和疏水相互作用, 与SA自发形成摩尔比1∶ 1的稳定复合物, 使SA中相关发光基团的疏水性增强, 并改变Trp和Tyr等氨基酸残基周围微环境, 从而影响UV特征吸收峰的强度和位置, 并引起内源荧光的静态猝灭, 但二者与SA的相互作用特征同时存在显著差异。 分子对接解释并验证了光谱分析结果, 进一步表明C-20立体化学导致差向异构体与SA的结合模式差异, 突出表现为结合区域以及参与氢键和疏水相互作用的基团和氨基酸残基的数目及类别明显不同, 这可能是人参皂苷Rh2与SA立体选择性相互作用的关键机制所在。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|