作者简介: 蒋雪松, 1979年生, 南京林业大学机械电子工程学院副教授 e-mail:xsjiang@126.com
小麦是我国战略性储藏粮食品种, 但小麦易受霉菌感染而发生霉变, 影响其食用安全。 加强小麦有害霉菌侵染程度的早期检测是控制其危害的需要措施。 然而, 现有的平板计数和荧光染色等检测方法, 普遍存在前处理繁杂、 时效性差等不足。 故此, 拟运用阵列式光纤光谱仪结合化学计量学方法, 建立霉变小麦的实时在线检测方法, 并为进一步开发粮食品质与安全在线检测装备提供参考。 小麦样品经辐照灭菌后分别接种五种谷物中常见有害霉菌: 串珠镰刀菌83227、 层出镰刀菌195647、 雪腐镰刀菌3.503、 寄生曲霉3.3950和赭曲霉3.3486, 并置于28 ℃和85%相对湿度环境中储藏7 d以加速霉变。 在样品储藏的第0, 1, 3, 5和7 d, 运用阵列式光纤光谱仪和漫反射探头在线采集样品的漫反射特征光谱, 并依据国标平板计数法测定样品菌落总数水平。 光谱采集步骤为: 在线检测平台上, 设置样品运动速度0.15 m·s-1和光谱仪积分时间20 ms, 采集波段为600~1 600 nm, 重复测量3次。 然后, 首先对小麦原始光谱进行平滑、 多元散射校正和导数变换等预处理以消除光谱噪音; 随后, 运用主成分分析(PCA)对受不同霉变程度(储藏阶段)的小麦样品进行区分; 最后, 利用线性判别分析(LDA)和偏最小二乘回归分析(PLSR)建立小麦有害霉菌侵染程度的定性定量分析模型。 小麦在储藏期内经历未霉变、 开始霉变和严重霉变三个阶段。 原始和二阶微分光谱显示霉菌侵染引起小麦光谱特征发生显著改变, PCA结果表明不同储藏阶段(霉变程度)小麦样品存在一定分离趋势。 利用前十个主成分得分建立的LDA判别模型, 对不同霉变程度小麦样品的识别率达90.0%以上。 结果表明: 小麦样品菌落总数的PLSR定量预测模型的预测决定系数(
Wheat is one of the main strategic stored grain varieties in China. But wheat is susceptible to fungal infection, which affects its safety as food. Early detection of harmful fungal infection in wheat is the precondition to control its hazard. However, current methods for mold detection, such as plate counting and fluorescence staining, are usually laboratory-intensive and time-consuming, and can not fulfill the need for on-site testing. Concerning this issue, this work intends to apply array fiber spectrometer series and chemometrics to establish an on-line method for detection of wheat mildew, and to provide a reference for further development of on-line sensing instruments for grain quality and safety. Sterile wheat kernels were inoculated with 5 different spore suspensions of fungal strains respectively, which were F. moniliforme 83227, F. proliferatum 195647, F. nivale 3.503, A. parasiticus 3.3950 and A. ochraceus 3.3486. Wheat samples were then stored at 28 ℃ and 85% relative humidity after inoculation to accelerate mildew process. At storage stage of 0, 1, 3, 5 and 7 d, Vis/NIR spectra of samples were collected by an on-line sensing system which was mainly conposed of an array fiber spectrometer and a diffuse reflectance probe. Total colony count of samples was also determined according to plate count method. Spectra of samples were measured at moving speed of 0.15 m·s-1 with integral time of 20 ms. Each sample was collected three times and the acquisition band ranged from 600 to 1 600 nm. Then original spectra of samples were firstly pre-processed by smoothing, multivariate scatter correction and derivative transformation to eliminate spectral noise. Subsequently, principal component analysis (PCA) was used to discriminate wheat samples with different mildew degrees (storage stage). Finally, liner discriminant analysis (LDA) and partial least squares regression (PLSR) were employed to develop qualitative and quantitative analysis models for fungal infection in wheat. Wheat samples undergone three stages during the storage period according to colony counts, which were not mildew, mildew and serious mildew. Analysis of original and second derivative spectra indicated that fungal infection resulted in significant changes in wheat spectra. PCA results showed that there was a certain trend of separation between wheat with different mildew degrees. The overall recognition rate obtained by LDA for the classification of samples with different mildew degrees was more than 90.0%. Colony counts in wheat samples was predicted by PLSR and coefficient of determination for the prediction set (
小麦是我国战略性储藏粮食品种之一, 小麦的质量安全直接关系到人民群众的食品安全。 然而小麦储运期间容易感染霉菌而霉变, 甚至产生呕吐毒素(deoxynivalenol, DON)和玉米赤霉烯酮(zearalenone, ZON)等真菌毒素, 严重威胁到人畜健康[1, 2]。 因此, 检测并监控小麦是否霉变对于小麦的储备以及饮食的安全都至关重要。 目前, 检测小麦感染霉菌的方法主要有平板计数法、 酶联免疫法、 荧光染色法和液相色谱-高分辨质谱法等。 虽然这些方法的检测精度较高, 但相比于近红外光谱的采集方便、 分析快速、 成本低, 且能最大限度地保存样品间的最小差异等优点, 还是缺乏适用性。 在很多情况下, 粮食收储、 贸易和加工部门待测的样品往往是大批量的, 检测结果需要实时反馈以做出决策, 而以上传统的静态检测手段已经越来越无法适应实际需求。 因此, 发展小麦霉菌侵染实时在线检测方法, 对于建立小麦霉变监测预警体系, 确保小麦储运、 贸易和加工安全无疑具有重要意义。
可见/近红外光谱(visible/near infrared spectroscopy, Vis/NIRS)作为一项光学无损分析技术, 以其快速、 低成本和无需样品预处理等诸多优势, 已经在农业和食品工业、 制药以及石油化工等行业得到了广泛应用[3, 4, 5], 为小麦有害霉菌侵染早期快速检测提供了一种新途径[6]。 在小麦霉变无损检测方面, 关二旗等利用全波段和特征波长处的小麦近红外光谱数据并结合化学计量学方法构建小麦赤霉病的快速识别模型[7]。 Shahin比较了可见/近红外高光谱图像(400~1 000 nm)和近红外光谱(1 000~2 500 nm)用于九种不同霉变程度(目测)的加拿大软红麦的鉴别结果, 发现可见/近红外波段的判别结果较优, 对不同霉变程度样品的整体识别率为67%。 如果将允许误差扩大到相邻的霉变程度, 判别正确率则显著上升到96%[8]。
现有研究已表明, 利用近红外光谱、 高光谱图像等实现霉变或病害小麦的定性判别具有可行性, 但目前小麦受有害霉菌侵染程度的快速检测仍是一大难点, 小麦霉变程度定性识别和定量预测的研究仍十分有限。 绝大多数研究仍停留在静态检测阶段, 在线检测鲜有报道。 本研究拟以感染不同种类有害霉菌的小麦籽粒为研究对象, 在线获取不同储藏阶段(0, 1, 3, 5和7 d)小麦样品的可见/近红外光谱特征信息, 结合化学计量学手段建立小麦有害霉菌侵染程度的快速识别方法, 并且定量预测小麦菌落总数水平, 以探索可见/近红外光谱技术用于小麦有害霉菌侵染在线检测的可行性, 为进一步开发粮食品质与安全无损检测装备提供参考。
新收获小麦样品(徐麦33, 水分含量16.0%), 由南京市灵山粮食储备库提供。 除杂并筛选籽粒饱满、 大小形态相近、 不染病虫的样品, 钴-60 辐照(剂量: 12 kGy)灭菌后用无菌塑料密封在4 ℃下冷藏。
五种小麦等谷物中常见有害霉菌标准菌株: 串珠镰刀菌(F. moniliforme)83227、 层出镰刀菌(F. proliferatum)195647、 雪腐镰刀菌(F. nivale)3.503、 寄生曲霉(A. parasiticus)3.3950和赭曲霉(A. ochraceus)3.3486, 来自北京北纳创联生物技术研究院。 在马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上分别接种五种霉菌, 在温度(28± 1) ℃, 空气相对湿度85%的培养箱内进行培养。 待霉菌生长到第15天后产生大量孢子, 用去离子水冲洗培养基表面数遍, 保存带孢子菌悬液。 用平板计数法(GB/T 4789.2— 2016)测定5种霉菌孢子菌悬液浓度, 并用去离子水调节菌悬液浓度至约1× 105 CFU· mL-1, 4 ℃冷藏, 备用。
称取约每份100 g的灭菌小麦样品共180份, 随机分成6组, 每组30份, 用无菌密封袋分装。 小麦霉菌接种步骤为: 在室温20 ℃下, 将小麦样品放置于灭菌培养皿中, 用移液器精确移取1 mL霉菌孢子菌液接种于样品中, 边接种边充分搅拌均匀。 每种霉菌接种30个样品, 5种霉菌共计接种150份。 剩余30份样品作为空白对照组并分别加入1 mL的无菌水。 待接种完毕后, 将6组样品装入180个上方有开孔的灭菌塑料盒中(规格: 115 mm× 115 mm× 65 mm), 并转移至6个不同的人工气候箱中储藏7 d, 设置储藏条件为28 ℃和85% RH以加速霉变。 样品从接种霉菌起, 选取储藏时间节点0, 1, 3, 5和7 d, 从每种霉菌侵染的小麦样品和对照组样品中各随机选取6份, 每次共计36份样品, 进行可见/近红外光谱分析和菌落总数测定, 样品分析前均放于4 ℃冰箱中冷藏。
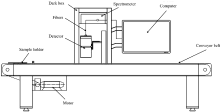
图1为阵列式光纤可见/近红外光谱在线检测系统示意图, 主要由光纤光谱仪、 漫反射探头、 遮光箱、 传送带、 电机和计算机等部分构成。 阵列式光纤光谱仪(德国Zeiss公司MCS 600型)开机预热30 min。 小麦样品待测前进行搅拌以使霉菌分布均匀, 取30 g小麦样品放置于直径9 cm灭菌培养皿中并压实平整, 样品厚度为1.5 cm。 将培养皿放置于皮带传送带中线位置处, 调节传送带速度最大至0.15 m· s-1。 当样品中心传送至与光谱仪连接的OMK500-H/NIR漫反射探头(德国Zeiss公司)正下方时采集样品光谱, 探头距样品表面垂直距离为2 cm, 光斑直径约为2 cm。 波长采集范围为600~1 600 nm, 积分时间20 ms。 每个样品重复装样扫描三次, 并采用OMNIC软件对所得光谱进行平均处理。 光谱采集完毕后, 对所用样品参照平板计数法进行小麦菌落总数的三次重复测定, 将所得结果取对数, 以便于进行后续建模分析。
采用TQ analyst 8.0软件对光谱数据进行处理和建模。 首先, 运用并对比多元散射校正(MSC)、 移动窗口拟和多项式(Savitzky-Golay)平滑、 微分(derivative)等方法以消除光谱噪音; 其次, 采用主成分分析(PCA)提取样品主成分得分, 对样品感染不同霉菌进行聚类趋势分析; 不同霉变程度(储藏阶段)小麦的定性判别模型通过线性判别分析(LDA)来建立。 应用偏最小二乘回归(PLSR)建立光谱和小麦样品中的菌落含量定量分析模型[9]。 采用模型决定系数(R2)、 建模、 预测和交互均方根误差(RMSEC/RMSEP/RMSECV)和相对分析偏差(RPD)等指标衡量PLSR 模型性能, 其中RPD 为预测集标准偏差与RMSEP的比值[10]。 模型建立前, 运用马氏距离对光谱异常值进行分析和剔除[11], 随后选取2/3的样品用于模型构建, 剩余1/3样品验证。
未接种和接种霉菌小麦样品在储藏期间菌落总数的变化趋势如图2所示。 观察可知, 在0~1 d时, 接种组所有霉菌生长极为缓慢, 菌落总数甚至有所下降, 可能是因为小麦样品最初接触菌液时, 霉菌只附在样品表面, 还未进入样品内部, 导致霉菌的生长处于延滞期并在逐渐适应生长环境。 在随后的1~7 d期间, 霉菌生长处于对数期, 霉菌菌落总数快速递增, 样品霉变程度逐渐加深。 观察可知, 不同霉菌的增长速度总体差异不大, 以层出镰刀菌195647繁殖速度最快, 串珠镰刀菌83227相对滞后。 参考前人研究, 根据菌落总数高低可将小麦样品分为未霉变(< 2.7 Log CFU· g-1)、 开始霉变(2.7~4 Log CFU· g-1)和严重霉变(> 4 Log CFU· g-1)3个阶段[12]。 由此判断, 储藏前期(0~1 d)接种族小麦样品的菌落总数虽略有差异, 但基本处于未霉变状态; 然而到第3 d时, 所有样品均达到了霉变状态; 除串珠镰刀菌83227组外, 第5 d时其他组样品均已处于严重霉变阶段; 第7 d时, 串珠镰刀菌83227组也变得严重霉变。 而未接种对照组样品的菌落总数在前3 d的储藏期中均为0。 由于无法做到与周围环境的完全隔离, 且处于相对高温高湿环境中, 因此第5 d时对照组样品菌落总数开始上升到2.15 Log CFU· g-1, 但仍处于未霉变状态; 到第7 d时已处于开始霉变状态(3.30 Log CFU· g-1), 但仍显著低于接种霉菌样品。 综上, 尽管样品中的菌落总数变化不同, 但整体的生长呈显著上升趋势, 表明样品中的霉菌随着储藏时间的延长逐渐旺盛繁殖, 产生大量代谢产物, 导致小麦物理结构和化学组成不断发生变化, 为基于光谱信息的霉变分析提供了可能。
图3为受层出镰刀菌195647侵染的小麦样品在不同储藏阶段的原始和二阶微分平均光谱图。 感染其他霉菌样品的光谱变化规律与之类似, 故不一一列出。 由图可知, 感染不同霉菌的样品光谱在600~1 600 nm波长范围内整体相似, 主要吸收峰位于962, 1 143和1 411 nm处, 分别对应于蛋白质、 氨基酸和淀粉中N— H和C— H基团的二级振动、 水O— H基团的一级基频振动等[13]。 由于可见/近红外光谱主要对应于含氢基团的基频振动的倍频和合频吸收, 谱峰重叠, 共线性严重, 难以判断不同类别样品之间的具体差异。 为进一步消除基线漂移对光谱的影响, 凸显微小光谱差异, 运用二阶微分对原始光谱进行处理[图3(b)]。 观察可知, 储藏后期(5和7 d)样品在914, 948, 1 077, 1 108, 1 329和1 366 nm等处的信号值也高于储藏前期。 表明随着霉变程度的加深, 霉菌侵染引起的小麦物理和化学变化越来越显著。
图4(a)— (f)为受不同类别霉菌侵染及对照组小麦样品的第一、 第二或第一、 第三主成分得分图。 两个主成分的得分贡献率之和在77.52%~99.30%之间, 其主成分组合的选取以获得较佳的样品分类效果为准则。 图中显示了在不同储藏阶段(不同霉变程度)下样品的分布规律。 总体而言, 对每一种霉菌侵染的小麦样品, 尽管不同类别样品在得分图上的分布区域相互重叠, 但不同的霉变程度的样品仍存在一定聚类趋势。 在串珠镰刀菌83227组中, 除了来自1 d的样品与其他样品重叠在一起, 其他类别有分离趋势。 层出镰刀菌195647组中, 第1 d和第3 d样品与其他类别区分明显。 寄生曲霉3.3950组中除了第5 d样品与其他类别重叠在一起, 其余存在一定聚类趋势。 雪腐镰刀菌3.503组的样品重叠要严重一些, 但第7 d样品与其他类别也基本分离。 赭曲霉3.3486组1 d和7 d的样品与其他类别同样区分明显。 不同储藏阶段的对照组样品同样也出现了明显的聚类趋势, 除了第7 d样品与其他类别相互重叠外, 其余均区分良好。 结果表明, 随着样品储藏时间的延长和霉变程度的加深, 霉菌繁殖和代谢导致小麦样品的光谱产生规律性变化。 因此, 利用光谱对小麦在各储藏阶段中不同霉菌侵染程度的判别分析具有可行性。
运用前十个主成分得分建立受霉菌侵染小麦样品及对照组样品霉菌侵染程度的LDA判别分析模型。 将小麦样品依据储藏阶段划分为5类, 结果如表1所示。 结果显示, 对感染不同类别霉菌的样品的建模判别准确率均在95.0%以上, 表明样品霉变程度与其光谱信息高度相关。 预测集中, 所有组的判别正确率均在90.0%以上, 赭曲霉3.3486组的准确率达到100%。 对照组的建模和判别正确率均为100%。 随着储藏过程的进行, 样品霉变程度和菌落总数水平逐渐加深。 结果表明, 可见/近红外光谱可用于区分不同储藏阶段的小麦样品, 进而实现样品霉变程度的在线识别。
| 表1 不同霉变程度小麦样品LDA模型判别结果 Table 1 LDA discrimination results of wheat samples at different mildew status |
以可见/近红外光谱吸收值为自变量, 小麦样品菌落总数的对数为因变量, 其PLSR定量分析统计结果如表2所示。 较大的
| 表2 基于可见/近红外光谱的小麦样品的菌落总数PLSR模型预测分析结果 Table 2 PLSR prediction results for colony count in wheat samples by using Vis/NIR spectroscopy |
对所有接种霉菌的150个小麦样品综合在一起建立PLSR分析模型, 同样随机选取100个样品作为建模集, 剩余50个样品验证, 结果也展示在表2中。 预测集的
小有害霉菌侵染引起小麦可见/近红外光谱发生显著改变。 PCA显示不同类别小麦样品间存在一定聚类趋势, 验证了光谱的内在差异性。 LDA模型对不同霉变程度小麦样品的整体识别率达90.0%以上。 小麦样品菌落总数PLSR模型的预测决定系数
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|