作者简介: 唐 乾, 1978年生, 大连大学生命科学与技术学院副教授 e-mail: tangqian@dlu.edu.cn
辣根过氧化物酶(HRP)是广泛应用的一种生物催化剂, 其光照后HRP酶活性变化的机理还未见报道。 利用紫外-可见(UV-Vis)、 同步荧光、 圆二色(CD)光谱研究了光对HRP催化活性及酶活变化机制。 实验结果表明: 光照射HRP可促使其发生还原反应, 同时其催化活性会发生变化。 UV-Vis吸收光谱数据显示, 光照射后HRP的Soret带403 nm最大吸收峰红移、 Q带498 nm处氧化峰强度下降, 说明经光照射HRPFe(Ⅲ)被还原为HRPFe(Ⅱ)。 不同波长对光照还原影响程度为280 nm>254 nm>498 nm>403 nm; 酶活为403 nm>498 nm>254 nm>280 nm; 280 nm波长光照射下, Phe, Trp, Tyr和Cys四种游离氨基酸以及谷胱甘肽的加入均对光照还原有促进作用。 酶活性与光照还原程度紧密相关, 因Fe(Ⅱ)无法提供空轨道与H2O2配位, 所以光诱导Fe(Ⅲ)还原导致酶活下降。 同步荧光和圆二色光谱揭示了光照还原后HRP血红素的构象发生了变化, 构象的变化也是光诱导酶活变化的原因之一。 紫外光影响酶活性下降的因素为光照引发活性中心Fe(III)还原, 蛋白质构象变化的贡献。 研究结果对进一步了解光对含血红素蛋白(酶)结构和功能的影响有重要的理论和实际意义。
Horseradish Peroxidase(HRP) is a widely used biocatalyst. However, activity change mechanism of HRP after irradiation has not been reported. In this research, the effects of irradiation on the catalytic activity of HRP and the mechanism of enzyme activity were studied by UV-Vis absorption、synchronous fluorescence and circular dichroism(CD) spectroscopy. The experimental results showed that irradiation could promote HRP reduction, while its catalytic activity would change. The UV-Vis absorption spectra date showed that the maximum absorption peak of the Soret band of HRP was red shift after irradiation and the oxidation peak intensity at 498 nm was decreased, and consequently HRPFe(Ⅲ) was reduced to HRPFe(Ⅱ). The effect sequence of wavelength on the photoreduction was 280 nm> 254 nm> 498 nm> 403 nm; the activity of the enzyme was 403 nm> 498 nm> 254 nm> 280 nm; while irradiated by 280 nm light , Phe, Trp, Tyr, Cys free amino acids and glutathioneall could promote the photoreduction process. Enzyme activity was closely related to the degree of photoreduction, and Fe(Ⅱ) could not provide empty orbit coordination with H2O2, so light-induced reduction of Fe(Ⅲ) led to decreased activity. Synchrotron fluorescence and circular dichroism spectroscopy revealed that the conformation of HRP did changed after photoreduction, so the conformational change was the reason for the change of enzyme activity. The factors that affect the decrease of enzyme activity by ultraviolet light are the contribution of light-induced active center Fe(Ⅲ) reduction and protein conformational changes. The results of this study have important theoretical and practical significance for a further understanding of the effects of light on hemoglobin(enzyme) structures and functions.
光辐射对蛋白质结构以及功能有着非常显著的影响, 适量光照强度和光照时间内含铁卟啉蛋白(酶)不变性且功能会发生改变, 同时可通过改变光照条件来调节蛋白(酶)的活性, 其对生物大分子影响的研究受到广泛关注[1]。
血红素蛋白中的铁卟啉结构类似于叶绿素, 活性中心是一个环状大共轭结构, 吸收不同波长的光可诱导铁卟啉活性中心的结构发生变化, 从而使血红素蛋白生物功能的表达受到影响。 周华伟等[2]发现特定波长光可诱导metMb中三价铁还原, 光照还原程度因入射光波长而异; 低温、 碱性有利于metMb的光照还原[3], 光激发卟啉后电子转移到三价铁未满的d轨道促进反应进行[4]。 紫外波长光照射Cyt c后其氧化和还原趋势因波长而异, 与其第六配位的甲硫氨酸密切相关, 整个反应是血红素中心铁卟啉、 氨基酸、 水等分子之间的能量和电子转移过程[5, 6]。 Liang等[7]发现在NADH存在时短时间光照Hb-FeⅢ 被还原成Hb-FeⅡ 的同时与O2结合能力增强, 而长时间光照metHb构象和结构发生变化同时O2结合能力降低、 功能丧失。
HRP是一种含血红素的酶, 在过氧化氢的作用下可以催化各种有机和无机化合物。 正铁原卟啉(即血红素)和两个钙原子维持了HRP的天然构象。 凭借其非凡的酶活性, 它已经被广泛应用于化学合成、 环境生物催化、 分析诊断等领域[8]。 Jennifer等[9]应用紫外可见吸收光谱研究了室温和超低温下HRPⅠ (Por+Fe(Ⅳ )=O)和HRPⅡ (PorFe(Ⅳ )=O)的相互转变, 发现低温时较低能量的光照使HRPⅠ 和HRPⅡ 的相互转换伴随着能量的转移。 随后Johan等[10]提出其转换为光诱导氧化反应。 Kai Kamada等[11, 12]发现HRP在紫外光诱导下酶活性会降低, 嵌入到二维纳米空间可显著抑制HRP的光致变性; 插入到半导体层, 通过控制紫外光可改变HRP酶活性, 实现了HRP酶活性的光化学控制。
目前无光照条件下对HRP生物体内外功能表达研究成果极为丰富, 但在有光条件下研究成果较少, 主要集中在HRPⅠ 和HRPⅡ 的相互转换。 迄今未发现光照对HRPFe(Ⅲ )与HRPFe(Ⅱ )还原机制的实验报道和机理阐述。 因此本实验运用紫外-可见、 同步荧光和圆二色光谱研究了光诱导HRP还原的光谱学特征、 酶活催化活性变化以及蛋白质结构变化, 阐明HRP光照还原酶活性变化机理。
试剂: 辣根过氧化物酶HRP(EC1.11.7)(RZ=3.0, 酶活性≥ 250 U· mg-1)获自美国Sigma公司。 使用时未经进一步提纯, 将其溶解在0.05 mol· L-1的磷酸(pH 7.4)缓冲溶液中, 配制成浓度为1× 10-4 mol· L-1的储备酶溶液(避光于4 ℃保存并尽快用于实验)。 实验中的HRP溶液需进一步稀释。 色氨酸(Trp)、 酪氨酸(Tyr)、 苯丙氨酸(Phe)、 半胱氨酸(Cys)及谷胱甘肽均为分析纯, 实验中用水均为超纯水。
无氧HRP溶液制备: 用封口膜密封装有HRP溶液的比色皿, 用注射针头通15 min高纯N2(纯度99%以上)。
酶活测定: 在室温用愈创木酚显色法来测定HRP活性。 反应体系含有25 μ L(0.02 mol· L-1)愈创木酚和10 μ L(0.04 mol· L-1)过氧化氢, 加入1.5 μ L HRP(10-5 mol· L-1)引发反应, 迅速混合均匀后立即置于UV-Vis分光光度计内, 检测产物在470 nm处OD值随时间的变化, 以OD值变化斜率标定酶活。
HRP的残留活性(RA)通过以下公式计算
UV-Vis吸收光谱的测定: HRP的紫外可见光谱在V-560型UV-Vis分光光度计(日本Jasco公司)上测定, 蛋白溶于0.05 mol· L-1磷酸缓冲溶液中(pH=7.4), 浓度约为1× 10-5 mol· L-1, 还原态的光谱在氧化态HRP溶液中加入浓度为0.5 mol· L-1连二亚硫酸钠。
同步荧光光谱测定: HRP的同步荧光在FP-6500型荧光分光光度计(日本Jasco公司)上测定, 蛋白溶于0.05 mol· L-1磷酸缓冲溶液中(pH=7.4), 浓度约为1× 10-5 mol· L-1
紫外区圆二色谱(CD)的测定: HRP的紫外区CD光谱在J-810型圆二色分光光度计(日本Jasco公司)上测定, 蛋白溶于0.05 mol· L-1磷酸缓冲溶液中(pH=7.4), 浓度约为5× 10-6 mol· L-1。
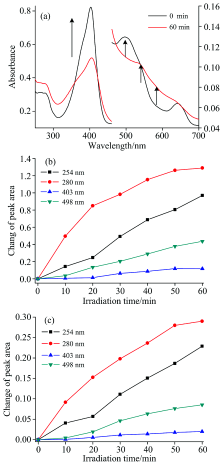
HRP有三个吸收带, 第一个吸收带在270~280 nm处, 是由蛋白质内部的芳香族氨基酸(Trp, Tyr, Phe)贡献的; 第二个吸收带为Soret带(403 nm)是由血红素辅基的卟啉环产生的; 第三个吸收带为Q带(450~650 nm)是由血红素与周边环境相互作用产生的, 后两个吸收带提供了血红素构象变化的信息[13]。 向HRP样品中加入不同浓度的Na2S2O4溶液, 反应2 min后UV-Vis光谱表明, HRP样品403 nm处的特征吸收峰随着Na2S2O4溶液浓度的增加而逐渐降低并红移, HRP样品498和643 nm处的特征吸收峰逐渐降低[图1(a)]。 当加入过量Na2S2O4时HRPFe(Ⅲ )能完全被还原为HRPFe(Ⅱ )(数据未列出)。 UV-Vis光谱表明在室温条件下光照HRP可产生与上述化学还原过程类似现象。 采用氙灯分出的280 nm单色光照射HRP溶液, HRP的Soret带403 nm处最大吸收峰的强度降低并红移, Q带498 nm处的最大吸收峰有明显的降低[图1(b)], 在约535 nm处形成了中间态的特征峰。
以愈创木酚(C7H8O2)为HRP的氢供体, 过氧化氢(H2O2)为氢受体底物, 可生成显色的四邻甲氧基连酚, 通过470 nm特征峰吸收强度随时间变化的斜率标定HRP酶活。 图1(c)显示, 相同时间内生成四邻甲氧基连酚的浓度越高(即紫外吸收强度高)则HRP酶活性越高。 加入还原剂Na2S2O4后HRP以HRPFeⅡ 形式存在, 酶活为71.3%。 HRP酶活性降低是因为HRP血红素卟啉中心的三价铁还原成了二价, 二价铁不能直接与H2O2配位生成HRPⅠ (Por+Fe(Ⅳ )=O), 但当H2O2存在时HRPFe(Ⅱ )又被氧化生成HRPFe(Ⅲ ), 所以其催化能力降低而不是完全消失。
2.2.1 不同波长光对HRP还原的影响
为了研究波长对HRP光照还原的影响, 选用氙灯分出的不同波长(254, 280, 403和498 nm)的光照射HRP样品。 经不同波长光照后, HRP的Soret带403 nm处最大吸收峰强度均降低并红移, Q带498 nm处的特征吸收峰也有明显的降低。 在不同的波长照射下, Soret带403 nm和Q带498 nm处峰面积随着光照时间增加变化不同, 其中280 nm光照射后峰面积变化最大即还原产物HRP-Fe(Ⅱ )最多。 由图2(b)和(c)得到四种波长对光照还原影响程度为280 nm> 254 nm> 498 nm> 403 nm, HRP被光诱导还原程度并非与光照波长能量成正比。 Mandal等[14]研究证明Trp受到UV光激发后, 激发态Trp将大量的激发能输送到辅基卟啉, Trp供体和血红素受体之间较高的能量转移效率有助于三价铁还原。 这与2013年Consani[15]在Science文章提及的Trp在肌红蛋白Trp-to-Heme能量传递过程中起重要作用的结论相吻合。 本实验中280 nm光照引起的光照还原反应现象最明显, 原因可能是280 nm波长的光被HRP内部芳香族氨基酸吸收, 芳香族氨基酸呈激发态比例高, 有利于电子传递, 使得HRPFe(Ⅲ )得到电子还原成HRPFe(Ⅱ )。
2.2.2 不同波长光照射下HRP酶活的变化
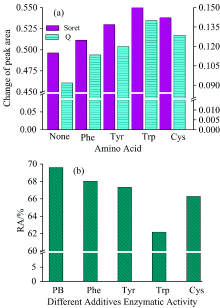
在室温下, 把具有相同酶活的HRP分别用不同波长光照射不同时间, 然后测定相应的酶活。 如图3所示, 不同波长光照射下酶活性都随反应时间的增加而降低, 280 nm波长光照射酶活下降最显著, 光照30 min后酶活为45.33%; 254和498 nm光照射下酶活下降程度次之, 分别为53.94%和76.68%。 403 nm光照射后的酶活变化有小范围的提高, 通过图2峰面积变化可知403 nm光照HRP基本上未还原, 其为三价铁的主峰, 光照使三价铁卟啉为激发态, 故活性稍有提高。 以上数据表明, 光照射HRP酶活变化与光照还原谱图变化趋势一致, 即光照还原程度越显著酶活性越低。 酶活下降程度不与光波能量成正比, 而与HRP光照还原的程度有关。 与Manzocco[16]提出的并非所有的紫外光照都可以使酶活性降低结论一致: 低强度UV光照处理可以改变酶活性位点的构象并导致活性增加; 高强度处理可导致不可逆的结构变化且导致酶失活。
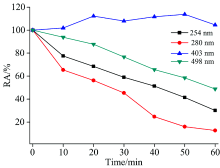 | 图3 不同波长氙灯光照后酶活性随光照时间变化图Fig.3 Change of activity of HRP after UV-Vis irradiated at different wavelengths |
2.2.3 不同游离氨基酸对HRP光照还原的影响
为了验证280 nm波长光照还原过程中氨基酸有重要贡献, 向HRP溶液中分别添加四种游离的氨基酸(Trp, Cys, Phe, Tyr)进行HRP光反应过程研究。 图4(a)为280 nm光照加入四种游离氨基酸后HRP峰面积的变化, 通过图4(b)可以发现光照还原的促进程度与酶活数据一致, 即促进程度越显著酶活性越低。 加入氨基酸的HRP溶液分别用280 nm波长光照射10 min后, 403 nm处吸收峰红移程度变大, 498 nm处吸收峰强度下降明显, 说明游离氨基酸的加入对HRP的光照还原反应有影响。 加入Trp与直接光照的HRP溶液相比其Soret带和Q带吸收峰差面积增加的更多, 说明280 nm波长光照射Trp时Trp被激发返回基态所释放的能量被卟啉吸收, Trp-to-Heme分子间能量传递促进了光照还原过程。 加入Phe和Tyr同样可以促进HRP的光照还原, 但是光照还原程度不如加入Trp明显。 403和498 nm波长光照时, 因为氨基酸不吸收这两种波长光, 所以对光照还原过程没有影响。 游离Cys特征吸收波长在239 nm, 其光照还原程度比在280 nm有较弱吸收的Phe和Tyr更显著, 可能与Cys具有还原性基团巯基(— SH)有关, — SH上的孤对电子可提供电子给Fe(Ⅲ ), 在溶液中Cys可作为电子供体参与光照还原过程。 为验证这一推测, 我们又设计了谷胱甘肽对HRP光照还原影响的实验。
谷胱甘肽(GSH)在所有生物细胞中都存在, 与Cys的结构相似, 存在还原性的巯基并且具有很强的供电子能力。 把加入GSH的HRP溶液避光放置15 min, 通过UV-Vis谱图发现HRP的Soret带403 nm和Q带498 nm基本没有变化, 说明GSH在无光照下不能作为还原剂使HRP还原。 图5(a)为280 nm单色光照射对加入GSH的HRP溶液的影响, 从图中可以看出与未加GSH的HRP溶液相比, 加入后光照还原程度更显著, 说明GSH的还原性只能在适当光照条件下才能发挥作用。 由图5(b)可知加入GSH光照后酶活由64.42%降低到55.99%, 说明光照还原程度的增加使酶活性降低更显著。 GSH中含有— SH, S原子上的孤对电子具有还原性, 当HRP被光照后形成激发态的高铁血红素, S原子可以提供电子给激发态的高铁血红素使其形成亚铁血红素辅基自由基, — SH提供氢质子给亚铁血红素辅基自由基最终转化为亚铁血红素。
2.3.1 同步荧光光谱
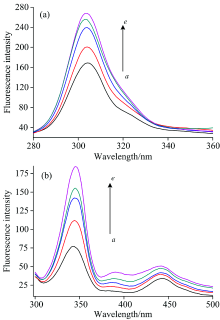
蛋白质的荧光是由色氨酸残基(Trp)和酪氨酸残基(Tyr)贡献的。 HRP包含1个Trp和5个Tyr, 所以有内源荧光。 因此, 测定HRP光照前后荧光强度的变化可以反映HRP三级结构的变化情况。 利用同步荧光光谱分别可以得到Tyr和Trp残基的特征吸收峰, Δ λ =20 nm显示的是酪氨酸的荧光光谱特征(A), 而Δ λ =60 nm呈现的是色氨酸残基的光谱特征(B)[17]。 通常, 蛋白质内这些芳香族氨基酸作为疏水基团在其内部被各种非极性氨基酸残基包围。 光照射后蛋白质的结构发生变化, 芳香族氨基酸的侧链逐渐暴露于水溶液中。
图6显示, 选择280 nm单色光照射时, 随着光照时间的增加, HRP中酪氨酸304 nm和色氨酸344 nm的荧光强度逐渐增强, 且色氨酸残基最大发射波长的峰位置发生轻微红移。 光照后荧光强度的增加可能是由于血红素与Trp的相对位置或距离发生变化导致能量传递效率增加, 这也说明光还原后色氨酸所处的微环境发生变化, 环境的疏水性降低, 蛋白疏水结构瓦解, 肽链的伸展程度有所增加[18]。 因此, 光照射可使HRP三级结构发生变化。
2.3.2 圆二色谱分析
HRP的远紫外区CD谱(190~250 nm)主要由分子构象的旋光活性造成, 可用来探测蛋白质二级结构变化情况; HRP的近紫外区CD谱(250~300 nm)是揭示脱辅基蛋白质二级结构变化情况的; HRP的CD谱(350~700 nm)能够揭示血红素周边环境和结构变化的信息[13]。
CD谱可作为探针揭示蛋白质的结构。 图7揭示了氙灯280 nm光诱导0~60 min的HRP二级结构变化。 208和222 nm是HRP在α -螺旋结构的特征峰, 随着光照时间的延长HRP的CD谱图发生变化, 208和222 nm处负峰振幅明显减弱, CD谱图的峰强度发生一定变化, 但是形状和肩峰的位置未发生明显改变。 在光照还原过程中随着疏水残基基团的不断暴露, 部分α -螺旋转变成β -折叠, 虽然短时间的光照引起了HRP二级结构的变化, 但是整个HRP的二级结构仍以α -螺旋为主, 说明光照时间内HRP蛋白未变性。
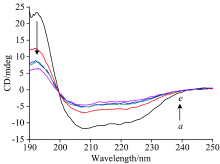 | 图7 HRP光照不同时间的CD光谱 a→ e的照射时间分别为0, 5, 10, 20, 30, 60 minFig.7 CD spectra of HRP at different illumination times a→ e: the illumination times are 0, 5, 10, 20, 30 and 60 min, respectively |
2.3.3 光诱发HRP酶催化活性变化及反应机理
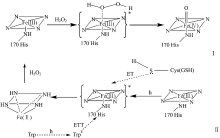
综合以上数据可得HRP光照还原的可能机理。 在光照过程中发生分子内电子转移, HRP经光照部分卟啉环π 电子被激发到激发态, 其电子较为活跃, 转移到d5未满的三价铁d轨道上, 电子组成为d6(即二价铁), 紫外光谱可证明形成了二价铁卟啉。 HRP的卟啉中心Fe缺电子并且半径比较小, 铁卟啉处于平面结构, Fe(Ⅲ )可以提供空轨道与H2O2配位, 发挥其酶活作用。 Soret带吸收强度下降, 共轭程度减弱, Fe(Ⅱ )处于还原态非平面结构, 平面下陷, 五配位的平面结构转变成五配位的四方锥体, 此时无法与H2O2配位。 当加入具有氧化性的H2O2时二价铁又被氧化成三价铁, 反应Ⅰ 又可重新进行, H2O2的消耗导致酶活性降低。 280 nm光照还原程度最显著, 因为其光照射后能量主要被蛋白质内的Trp吸收, Trp所发射出的能量波长恰极易被辅基卟啉吸收, Trp供体和血红素受体之间较高的能量转移效率有助于三价铁还原。 加入Cys和GSH的巯基中S富含电子, S原子提供电子给激发态的高铁血红素使其最终转化为亚铁血红素。 254和498 nm不是氨基酸的特征吸收峰, 不利于卟啉跃迁到激发态, Fe(Ⅲ )较难被还原, 403 nm是氧化态的特征吸收峰, 对光照还原基本没影响。 同时酶活变化与光照还原程度一致, 说明三价铁被还原是导致酶活下降的一个主要原因。 同步荧光光谱表明光还原后HRP中色氨酸所处微环境的疏水性降低, 蛋白疏水结构瓦解, 肽链的伸展程度增加, 极性增强, HRP的构象发生变化。 CD光谱可以看出随着光照时间的延长HRPFe(Ⅱ )含量升高, 蛋白为适应HRPFe(Ⅱ )的五配位平面结构, HRP的二级结构发生了变化, 进而影响了HRP的活性。 但是整个HRP的二级结构仍以α -螺旋为主, 所以短时间光照蛋白未变性。
通过化学还原和氧化的光谱图对照, 发现在254, 280和498 nm波长光照射可以使Fe(Ⅲ )还原成Fe(Ⅱ ), 同时得出不同波长光照射下酶活都随反应时间的增加而降低。 280 nm波长光能够被氨基酸吸收, 血红素中心铁卟啉、 氨基酸分子之间的能量和电子转移过程有助于光照还原; 254和498 nm不是氨基酸的特征吸收峰, 对光照还原影响不明显; 403 nm是氧化态的特征吸收峰, 对光照还原基本没有影响。 Phe, Trp, Tyr和Cys四种游离氨基酸的加入验证了铁卟啉和Trp之间的能量转移以及铁卟啉与Cys之间的电子转移有利于光照还原过程; GSH的巯基可作为电子供体对光照还原有较好的促进作用。 HRP在光照过程中Fe(Ⅲ )被光照激发形成未成对电子处于激发态是其被还原的关键, 同时还原程度越显著酶活性越低。 通过同步荧光和CD光谱分析, 光诱导HRP还原后, HRP芳香族氨基酸残基周围的疏水性降低, 蛋白肽链伸展结构和极性增加, 部分α -螺旋转变成β -折叠, 导致HRP与底物的结合能力下降, 酶活力下降。 以上实验结果对HRP的广泛应用有着非常重要的意义, 不仅阐述了光激发含铁卟啉蛋白酶的还原机制, 同时有助于了解光照射下含血红素蛋白(酶)活性变化机制。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|