作者简介: 王中瑗, 女, 1980年生, 国家海洋局南海环境监测中心高级工程师 e-mail: zhongyuan764@126.com
建立了流动注射(flow injection, FI)空气混合吸附预富集编结反应器(knotted reactor, KR)二次气体分隔洗脱法与火焰原子吸收光谱法(flame atomic absorption spectrum, FAAS)联用测定海洋生物样中的痕量铅。 在预富集步骤, 空气、 络合剂和铅溶液在线混合, 空气的引入, 大大提高了铅的螯合物在KR内壁的吸附效果。 在洗脱前, 通入一段空气流, 在洗脱过程中, 即在非完全洗脱时, 加入一段空气流, 两段空气流的引入, 大大降低了被分析物在洗脱液中的分散, 提高了信号响应值, 从而提高了浓集系数(enhancement factor, EF)。 将空气混合吸附预富集与二次气体分隔洗脱法联用, 使得KR吸附富集效果和洗脱效果达到了更高的水平。 和微柱的低寿命、 高反压相比, KR反压小, 耐酸耐碱, 寿命几乎无限长, 对蠕动泵的要求很低, 不易造成溶液渗漏等问题。 在洗脱过程进行到第5秒时输入1 s空气流作为间隔, 而不是等整个洗脱过程完成以后再输入空气流, 此方法的优点是: 洗脱完全, 而且大大降低了被分析物在洗脱过程中的分散, 吸收信号值大大增加。 如果单纯地把洗脱时间降到5 s, 那么洗脱会非常不完全, 也就是没有洗脱干净, 在管路中还会残存大量的被分析物, 残存的被分析物被带入下一个样品分析中, 会对整个实验造成很大的误差, 所有的实验数据都将不准, 失去数据利用价值。 所以完全的洗脱是非常必要的, 必须保证一定的洗脱时间。 由于随着洗脱过程的进行, 洗脱下来的被分析物呈逐渐减小的趋势, 在以往洗脱方法中, 等到整个洗脱过程全部进行完以后, 被分析物在洗脱液中的分散已经相当严重了, 导致所得到吸收信号值大大减小。 在洗脱过程中插入空气流, 即在非完全洗脱时插入空气流, 降低了被分析物在洗脱过程中的分散, 同时保证了洗脱的完全, 大大提高了吸收信号峰值。 优化了络合剂种类、 浓度和酸度, 样品富集时间和流速, 空气混合吸附时的空气流速和时间, 洗脱前第一次通气时间, 预洗脱时间, 洗脱过程中第二次通气时间等实验参数。 在最佳实验条件下, 铅在0.005~0.6 mg·L-1浓度范围内呈现良好的线性关系, 铅的检出限(3 σ)为2.2 μg·L-1。 将新方法与直接火焰原子吸收法、 传统的FI-KR空气混合吸附预富集普通洗脱法进行了比较, 结果显示本方法的浓集系数更高。 将该方法应用于海洋生物样中痕量铅的测定, 测得鳝鱼、 对虾、 虾姑、 鲟鱼、 舌鳎和贻贝标准中的铅含量为0.34~1.92 μg·g-1; 加标量为1.0 μg·g-1时, 加标回收率为93.5%~96.4%; 相对标准偏差为0.52%~2.94%。 用FI-KR-FAAS空气混合吸附预富集, 二次气体分隔洗脱法测定海洋生物样中的痕量铅, 具有富集效果好, 准确度高, 精密度好, 浓集系数高等优点, 分析结果令人满意。
In this paper, trace lead in marine biological samples was determined by using flow injection ( FI ) air mixture adsorption preconcentration and twice gas isolation elution method in knotted reactor (KR) coupled with flame atomic absorption spectrometry (FAAS) . Air, complexing reagent and lead solution were mixed on-line during the preconcentration step, and the introduction of air greatly improved the adsorption effects of the lead chelate on the inner walls of KR. By the introduction of air flow before elution and adding part of air flow during elution, through these two parts of the introduction of air flow bubble partition, the dispersion of the lead chelate in KR was greatly reduced, and the peak of the atomic absorption signal was increased, and the enhancement factor (Enhancement factor, EF) was increased. By the combination with the KR of the air mixing sorption preconcentration and twice gas isolation elution method, the KR adsorption effect and elution effect reached a higher level, and compared with high back pressure and short lifetime of the micro column, KR has the characteristics such as acid and alkali resistance, low back pressure and almost unlimited lifetime. What’s more, it has no critical requirement for the peristaltic pump and is not easy to cause leakage of the solution. In the elution process, 1 s air flow was used as a spacer at the fifth second, instead of entering the air flow after the entire elution process was completed. The advantage of this method is not only being eluted completely, but also greatly reducing the dispersion of the analyte during the elution process, and the value of the absorption signal is greatly increased. If the elution time is simply put down to 5 s, then the elution will be very incomplete, the tube being not clean, a large number of analytes still remaining in the tube, and the remnants of the analyte were brought into the analysis of the next sample. All the experimental data will be inaccurate, and the value of data utilization will be lost. So complete elution is necessary and must ensure a certain elution time. As for the elution process, the elution of the analyte decreased gradually, in the past elution method, until the entire process is performed after elution, the analyte in the elution dispersion has been quite serious, which leads to the great reduction of absorption signal value. Operational parameters such as types, concentration and pH of complexing agents, sample preconcentration time and flow rate, flow rate and time of air mixing sorption process, the first ventilation time, pre elution time, the second ventilation time were optimized for the purpose of determining trace lead. Using the optimized conditions, a linear relationship existed between the peak absorbance and the concentrations of lead in the range of 0.005~0.6 mg·L-1 respectively. The method was applied in the determination of trace lead in marine biological samples with a detection limit(3 σ) of 2.2 μg·L-1. In this paper, the detection results of FAAS method, traditional FI-KR-FAAS air mixing sorption preconcentration method and normal elution method were compared with this method, and it showed that the new method obtained the highest enhancement factor value. This method was applied to detect the trace lead in biological samples such as eel, pawn, slipper lobster, sturgeon, tonguefish and mussel. The trace lead content in these biological samples were among 0.34~1.92 μg·g-1. When the 1.0 μg·g-1 standard Lead solution was added, the recovery was 93.5%~96.4%, and the relative standard deviation (RSD) was 0.52%~2.94%. The method of FI-KR-FAAS twice gas isolation elution for the determination of trace lead in marine biological samples obtains several merits. It has good preconcentration effect, high precision, high degree of accuracy and high enhancement factor. This method can satisfy the analysis requirement for the marine biological samples.
重金属因其生物富集性而对海洋生态系统造成了极大威胁。 重金属不仅通过食物对人类健康造成危害, 同时, 还影响海洋生物的生长发育, 对海洋环境造成危害[1, 2, 3, 4]。 海洋生物体中的重金属是海洋污染检测研究的热点。 海洋生物中的铅由于浓度很低, 而且成分复杂, 是分析检测的难点[5, 6, 7]。
海洋监测规范[8]中, 海洋生物样的分析检测有三种方法: 无火焰原子吸收分光光度法, 阳极溶出伏安法, 火焰原子吸收分光光度法。 其中, 火焰原子吸收光谱法具有分析快速, 操作简便, 较高的分析精度, 测定元素范围宽, 背景干扰较小等特点, 从而得到普遍应用。 FI-KR分离富集方法与火焰原子吸收光谱法结合既可以降低检出限, 又可以减少或消除共存元素或杂质的干扰[9, 10]。
本研究将FI-KR空气混合吸附预富集二次气体分隔洗脱法与FAAS联用, 其中, 空气混合吸附预富集, 大大提高了重金属元素的螯合物在KR内壁的吸附效果; 二次气体分隔洗脱法, 大大降低了被分析物在洗脱液中的分散。 将本方法应用于测定海洋生物样中的铅, 结果证明此法准确可靠, 操作简便易行, 是对传统吸附预富集方法的一次改进[11]。
WFX-210型原子吸收光谱仪(北京瑞利分析仪器有限公司); MARS-X微波溶剂萃取系统(CEM); IFIS-D型流动注射分析仪(西安瑞迈分析仪器有限公司); pHS-3C型pH计(上海仪电科学仪器股份有限公司)。 VB 20赶酸器(Labtech)。
硝酸、 盐酸、 无水乙醇及丁二酮肟和8-羟基喹啉(8-HQ, 优级纯): 广州化学试剂厂; 二乙基二硫代氨基甲酸钠(DDTC)和乙二胺二硫代氨基甲酸铵(APDC, 分析纯): 天津市天新精细化工开发中心; 邻菲啰啉、 锌试剂和双硫腙(分析纯): 广州化学试剂厂; 铅的标准溶液由100.0 mg· L-1的储备液配制而成; 水为超纯水。
选取足够数量的完好的海洋生物样, 放入干净的聚乙烯袋中, 挤出袋内空气, 将袋口扎紧, 将袋子和样品标签一起放入另一聚乙烯袋中, 并封口, 冷冻保存。
将称量瓶放入105 ℃烘箱, 2 h后, 取出称量瓶, 置于干燥器中冷却30 min。
盖好瓶盖, 用分析天平称重, 记下重量。 取5~10 g海洋生物样于称量瓶中, 盖好瓶盖, 再称重(± 0.5 mg)并记下重量。 将盛样品的称量瓶半开盖放入105 ℃烘箱中, 24 h后取出, 置于干燥器中冷却30 min。 盖好瓶盖后称重并记录所称重量。 重复烘干操作, 至前后两次烘干后的重量差小于总重量的0.5%。 计算干重和干湿比。 干燥后的样品用玛瑙研钵磨碎, 全部过80~100目(180~150 μ m)尼龙筛, 供痕量元素分析用[8]。
用电子天平称取0.2 g左右烘干后的海洋生物样样品, 记录其准确质量, 将样品放于聚四氟乙烯消解罐中, 分别加入4 mL硝酸溶液和2 mL过氧化氢溶液, 加盖拧紧后将聚四氟乙烯消解罐放入微波消解仪中, 设置消解仪在120 ℃ 10 min, 160 ℃ 5 min, 180 ℃ 20 min。 在样品完全消解后, 等待消解罐内的温度小于80 ℃后, 将消解罐取出、 放气。 随后将消解罐放置在控温电加热器上, 用赶酸仪在160 ℃的工作条件下对样品进行2 h赶酸, 待罐内温度冷却至室温后, 将样品消解液定容到10 mL。 同时制备分析空白样[12, 13, 14]。
FI-KR-FAAS空气混合吸附预富集与二次气体分隔洗脱法联用测定样品中的痕量铅的操作步骤和程序见图1和表1。
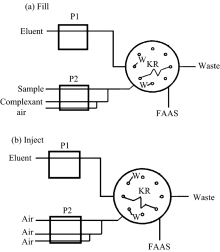 | 图1 FI-KR空气混合吸附预富集FAAS的流路图 P1, P2: 蠕动泵1, 蠕动泵2; W: 废液[11]Fig.1 The flow diagram of FI-KR air mixing preconcentration adsorption coupled with FAAS P1, P2: Peristaltic pump 1, Peristaltic pump 2; W: Waste[11] |
| 表1 FI-KR-FAAS测定铅的程序 Table 1 Procedure of FI-KR-FAAS for the determination of lead |
三根蠕动泵管由一个泵推动, 由于泵速相同, 所以通过改变三根蠕动泵管的管径来改变三根蠕动泵管的泵入溶液的流速。
由于FIA的核心在于受控制的分散: 预富集过程中, 分散有利于待测样品和络合剂的混合; 而洗脱过程中, 恰好相反。 洗脱过程中, 被洗脱下来的分析物有一个浓度梯度, 此时, 如果分散系数太大, 那么得到的吸收信号峰值就降低。 由于被分析物在洗脱过程中分散严重, 导致被分析物原来的高浓度溶液在进入检测器时浓度已经很低, 所以峰值很小, 浓集系数很小。 通过以上两次将空气流输入编结反应器, 大大降低了被分析物的高浓度部分在洗脱过程中的分散, 提高了吸收信号峰值, 大大提高了浓集系数。 其中, 第一次通空气的目的是隔绝洗脱剂与前面络合剂、 样品溶液的接触, 防止前后溶液混合; 第二次通空气的目的是最大限度的保留被分析物的头部高浓度部分不被洗脱剂稀释, 从而获得更高的吸收信号峰值。 通过两次将空气流输入编结反应器, 大大降低了被分析物的高浓度部分在洗脱过程中的分散, 提高了吸收信号峰值, 大大提高了浓集系数。 实际上, 随着洗脱过程的进行, 洗脱下来的被分析物呈逐渐减小的趋势, 等到整个洗脱过程全部进行完以后, 被分析物在洗脱液中的分散已经相当严重了, 所以本文在洗脱过程中通入空气流, 即在非完全洗脱时通入空气流, 以降低被分析物在洗脱过程中的分散, 大大降低分析物的高浓度部分在洗脱过程中的分散, 同时保证了洗脱的完全。
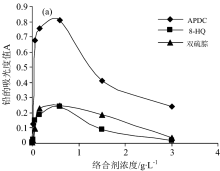
经过实验证明, 测定0.50 mg· L-1 Pb, 最佳络合剂为APDC, 较优络合剂溶液浓度范围为0.15~0.90 g· L-1, 最佳络合剂浓度为0.80 g· L-1, 所以本实验选择0.80 g· L-1的APDC为铅的络合剂[15]。
不同pH的铅溶液和不同pH的APDC溶液(用适当浓度的氢氧化钠溶解调节)在线络合之后吸光度值的变化如图3所示, 经实验证明, 体系最佳pH如下: 铅溶液pH为1.0, APDC溶液pH为10.0。
经实验证明, 选择在6.00 mL· min-1的流速时采样60 s为最佳的样品富集时间和流速[11]。
在预富集步骤, 测试了混合空气流速对吸光度值的影响后, 选择空气流速为9.00 mL· min-1 [11]。
2.5.1 第一次通气时间及流速的优化
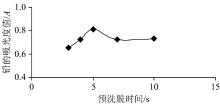
洗脱前通入一段空气流, 既可以增加吸附预富集效果, 又可以防止溶液与洗脱液之间的混合, 从而大大减小了被洗脱物在编结反应器中的分散。 如图4所示, 通入空气时间越长越好, 但时间太长会降低样品测定的效率, 因此, 本实验选择第一次通空气流速10.4 mL· min-1, 时间为15 s。
2.5.2 第二次通气时间及流速的优化
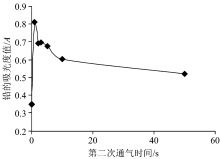
通过大量的实验表明, 当预洗脱流速为7.2 mL· min-1, 如图5所示, 时间为5 s时, 通入第二段空气效果最好。 如图6所示, 第二段通空气的时间为1 s时效果最好。
实验对比了不同浓度的三乙醇胺、 邻二氮杂菲以及抗坏血酸的掩蔽效果, 实验证明, 0.01%(体积分数)的三乙醇胺掩蔽效果最佳。 因此本实验所用络合剂中三乙醇胺的浓度为0.01%(体积分数)。 测定0.50 mg· L-1的铅溶液, 加入600倍含量的Na+, K+, Mn2+, Ca2+, Al3+与Fe3+, 按照实验最佳条件进行操作, 实验表明, 检测不受影响。
分别配制一系列浓度的铅标准溶液, 先用火焰原子吸收光谱仪直接测出各溶液的吸光度, 再用FI-KR-FAAS联用系统再测上述各浓度铅溶液的吸光度值, 记录数据, 分析数据, 得出每种方法的工作曲线。 其中, FAAS直接测铅标液的工作曲线方程为: A=0.069 2c+0.000 9, (c: mg· L-1), 相关系数r=0.999 6; 检测限(3σ )为15.6 μ g· L-1, 相对标准偏差(RSD)为2.0%; FI-KR-FAAS空气混合吸附预富集二次气体分隔洗脱方法测铅标液的工作曲线方程为: A=1.621 5c+0.001 3, (c: mg· L-1), 相关系数r=0.999 7。 检测限(3σ )为2.2 μ g· L-1, 相对标准偏差(RSD)为2.1%; 后者的曲线斜率除以前者的曲线斜率为EF, EF为23.4。 采用传统FI-KR空气混合吸附预富集, 普通洗脱方法测铅标液的工作曲线方程为A=0.698 9c+0.001 8, (c: mg· L-1), 相关系数r=0.999 8, 检测限(3σ )为4.3 μ g· L-1, 相对标准偏差(RSD)为2.3%, EF为10.1。
对海洋生物样样品进行分析, 结果列于表2。
| 表2 海洋生物样中痕量铅的测定 Table 2 Determination of trace lead in marine biological samples |
其中本底值是指样品中所含有的重金属元素的含量。 加标量为1.0 μ g· g-1。 采用本方法对海洋生物样和贻贝标准样(GBW 08571)中的铅进行测定。 在最佳的实验条件下, 得到结果如表2所示。 由表2可知, 本方法所得结果与标准样品的参考值基本吻合, 因而本方法可以用于实际样品中铅的富集与测定。 实际样品测定的加标回收率在93.5%~96.4%之间, 表明本方法可靠有效。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|