作者简介: 熊时鹏, 1993年生, 上海师范大学生命与环境科学学院硕士研究生 e-mail: 1217337323@qq.com
α-熊果苷是一种能够止咳平喘的植物提取物, 有关它与蛋白质的相互作用及作用机理报道较少。 应用光谱学与分子对接技术研究了在不同条件下α-熊果苷与人血清白蛋白(HSA)的相互作用。 研究结果显示: 随着α-熊果苷浓度的增大, HSA荧光强度得到了显著增强并且荧光光谱发生了蓝移。 利用荧光增敏的各种有关方程求得了α-熊果苷在不同温度下与HSA作用的结合常数, 通过范特霍夫方程计算HSA与α-熊果苷相互作用过程中的Δ H=-23.29 kJ·mol-1和Δ S=40.96 J·mol-1·K-1, 说明α-熊果苷与HSA之间的主要作用力是氢键和疏水作用力。 通过紫外吸收光谱、 同步荧光光谱、 三维荧光光谱等光谱学方法研究发现α-熊果苷使HSA的构象发生改变。 通过HSA与α-熊果苷作用前后圆二色二级结构的定量分析可得知, HSA与α-熊果苷复合物的形成使蛋白质螺旋稳定性降低。 最后应用分子对接实验, 验证了α-熊果苷与HSA间的相互作用位点在HSA的siteⅡ(亚域ⅢA), α-熊果苷能通过氢键和疏水作用力等多种作用力很好的结合在亚域ⅢA的疏水腔中。 从实验中获得的数据能够阐明α-熊果苷对HSA的作用机制, 同时能够有助于理解α-熊果苷在人体的储藏运输过程中对蛋白质功能的影响。
Alpha arbutin is a botanical extract which can relieve cough and asthma, and its effects on protein and the mechanism of action are poorly reported. This paper studied the interaction between alpha arbutin and human serum albumin (HSA) under different temperature conditions with fluorescence spectroscopy. With the increasing of alpha arbutin concentration, the fluorescence intensity of HSA was significantly enhanced with the occurrence of blue shift of fluorescence spectrum. By using fluorescence enhancement effect equations, we can obtain the binding constants of alpha arbutin and HSA. Thermodynamic parameters were obtained using the van’t Hof equation, resulting in the main type of molecular force between alpha arbutin and HSA. The thermodynamic parameters(Δ H=-23.29 kJ·mol-1 and Δ S=40.96 J·mol-1·K-1) indicated that hydrogen bond and hydrophobic were the intermolecular force. UV-Vis, Synchronous fluorescence spectrometry and Three-dimensional fluorescence spectra were utilized to explore the effects of arbutin and HSA interactions on the secondary structure of protein. The circular two color spectrometry can conclude the protein secondary structure, which indicated the loss of helical stability after the interaction of arbutin and HSA. The binding details between arbutin and HSA were confirmed by molecular docking, which revealed alpha arbutin was bound at siteⅡ (subdomain IIIA) via multiple interactions, such as hydrogen bond, hydrophobic. The full basic data in the work is to clarify the binding mechanism of alpha arbutin with HSA and is useful for understanding its effect on protein function during the blood transportation process.
α -熊果苷又名熊果素(4-羟基苯基-α -D-吡喃葡萄糖苷)是源于天然植物的一种脱色提取物, 存在于熊果树叶片、 虎耳草、 沙梨树树叶, 也存在于一些水果如小山梨等。 α -熊果苷是葡萄糖基化的氢醌类衍生物, 属于氢醌葡萄糖苷类[1], 具有某些特定的生理功能, 广泛存在于动物、 植物及微生物细胞中。 α -熊果苷分子能与酪氨酸酶竞争抑制酪氨酸酶活性, 降低黑色素合成酶活性, 所以α -熊果苷添加到美白类的化妆品中起到美白和保湿的功效; 另外α -熊果苷能用于哮喘治疗中起到延长潜伏期并且起到平喘的作用。
HSA(人血清白蛋白)是人体血浆中最丰富的蛋白质, 具有维持人体渗透压, 抗凝血, 清除自由基, 作为血的缓冲剂及影响血管渗透性等生理作用。 HSA作为药物分子、 代谢产物、 酶、 激素等内源性及外源性物质的运输载体, 起到贮存和转运的作用[2]。 因此人血清白蛋白是生命科学的重要研究对象, 熊果苷及其衍生物在医药、 化妆品等领域有广泛应用, 但是有关HSA与熊果苷的研究尚未有报道。 研究熊果苷与蛋白质的相互作用不仅对了解α -熊果苷在生命科学及生命技术、 药学材料科学领域有重要理论价值, 还能对熊果苷的药用科学性、 合理性的发展提供更多的理论依据。 利用紫外可见光谱、 荧光光谱、 圆二色光谱、 同步荧光光谱、 三维荧光光谱法、 分子对接等方法[3]得到了许多关于HSA与熊果苷相互作用信息, 包括蛋白质与小分子的结合常数、 结合位置、 作用力类型以及相互作用过程中构象变化的信息。 我们从不同的光谱定性和定量表征熊果苷如何影响HSA的二级结构, 从分子水平上了解熊果苷与HSA的键和模式及作用机理, 这有助于全面阐释熊果苷与HSA的结合规律与机理, 了解熊果苷的药用机理。
荧光分光光度计(Cary Eclipse), 美国Varian公司; 紫外-可见分光光度仪(TU-1901型), 北京普析通用仪器公司; 电位滴定仪(ZD-2型), 上海精密科学仪器有限公司; 电子分析天平(AL104型), 上海Mettler Toledo公司; 圆二色光谱仪(JASCO J-815型), 日本JASOC公司。
人血清白蛋白(纯度≥ 98.0%生化试剂, 上海源叶生物科技有限公司)用pH=7.4的Tris-盐酸缓冲液配置成1× 10-4 mol· L-1的贮存液; α -熊果苷标准品(上海源叶生物科技有限公司)用pH=7.4的Tris-盐酸缓冲液配置成5× 10-3 mol· L-1的贮存液, 贮存液置于4 ℃冰箱保存; 三羟甲基氨基甲烷、 氯化钠固体、 盐酸等试剂为分析纯(AR)。 实验体系中NaCl浓度保持在0.1 mol· L-1来维持离子强度; 实验用水为二次蒸馏水。
1.2.1 荧光光谱测定
在10 mL比色管中, 依次加入2 mL pH=7.4的Tris-盐酸缓冲液、 2 mL 0.5 mol· L-1 NaCl溶液、 一定量的HSA贮存液, 以及α -熊果苷贮存液, 混合静止10 min, 扫描荧光光谱。 荧光光谱参数设定: 激发波长280 nm, 激发与发射光谱带宽确定为5 nm, 记录发射波长范围为300~500 nm的光谱; 同步荧光光谱参数设定: Δ λ 分别为15和60 nm, 发射与激发光谱带宽为5 nm, 记录200~400 nm的激发光谱。
1.2.2 紫外-可见光谱测定
配制人血清白蛋白(2× 10-6 mol· L-1)与α -熊果苷的浓度比为1∶ 0, 1∶ 2, 1∶ 8, 1∶ 14, 1∶ 20, 用不含人血清白蛋白的对应浓度α -熊果苷溶液作为参比液, 298 K下水浴3 h。 将参比溶液作为背景, 200~350 nm范围内, 记录α -熊果苷与HSA混合溶液的紫外可见光谱。
1.2.3 三维荧光光谱测定
室温条件下, 分别检测HSA及HSA与α -熊果苷混合后的三维荧光光谱, 激发波长为200~450 nm, 发射波长为200~500 nm, 激发间隔为2 nm, 发射与激发光谱带宽均为5 nm。
1.2.4 圆二色谱测定
使用1 cm厚度荧光比色皿, 室温条件下, 记录190~350 nm的光谱数据。 测定HSA与α -熊果苷混合前后CD光谱, 以208 nm处的摩尔椭圆率θ 为基准, 利用公式: α %=[(-[θ ]208-4 000)/(33 000-4 000)]× 100%计算人血清白蛋白的α 螺旋含量。
1.2.5 分子模拟
使用AutoDock2.5分子软件包进行分子模拟, 蛋白质晶体结构从ProteinData Bank数据库下载, 蛋白的编号为4K2C, 先将蛋白进行删除水分子、 加氢等一系列预处理后, 再寻找并定义蛋白活性位点, 然后运用对接工具将α -熊果苷分子精准对接到HSA中的活性位位点后根据打分值大小对配体与受体结合状态进行判断, 选取最优的一组对接方式作进一步研究[4]。
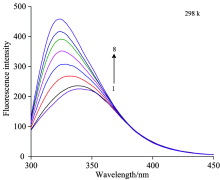
HSA在波长285 nm激光的激发下, 于349 nm处产生最大荧光发射峰, 而熊果苷在水溶液中几乎不产生荧光。 由图1可知, 在一定的实验温度下, 保持HSA浓度不变, 随着加入α -熊果苷量规律性增加, 发现HSA分子荧光发射峰峰形基本不变, 但荧光强度显著增强。 同时熊果苷的加入导致HSA最大的发射波长出现显著蓝移。 人血清蛋白中氨基酸残基的荧光发射波长与其所在的微环境有关。 由此表明, α -熊果苷的加入使得HSA所在微环境产生变化。
荧光增强, 又名敏化荧光, 是指一些药物小分子在水溶液中荧光强度极弱, 当药物分子加入蛋白质溶液后, 使蛋白质溶液的荧光强度增强或出现新的荧光峰。 可以使用荧光增强效应方程来计算药物小分子与蛋白质的相互作用。 假设蛋白质与药物作用过程中存在单一结合位点, 根据荧光增强方程[5, 6]
其中Δ F=F-F0, Δ F∞ =F∞ -F0
式中, F0为蛋白质最初荧光强度; F为HSA与配体相互作用后产生的荧光强度; F∞ 为配体与HSA相互作用饱和时的荧光强度; K为药物与蛋白作用结合常数; Q为药物浓度。 以1/(F-F0)对1/Q绘图见图2, 由图2直线斜率求出α -熊果苷与HSA的结合常数, 斜率的倒数值即为结合常数K。
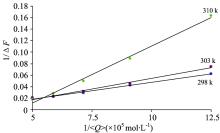 | 图2 α -熊果苷对人血清白蛋白荧光增强双倒数图Fig.2 Double-reciprocal plot of fluorescence enhancement of HSA by alpha arbutin |
从图2可以看出, 在不同温度下, α -熊果苷对HSA荧光增强的双倒数图具有明显线性。 表1中数据说明α -熊果苷能与HSA相结合, 且结合常数较大, 温度对于常数影响较小, 说明两者有较强结合作用。
| 表1 α -熊果苷与人血清白蛋白的结合常数 Table 1 The binding parameters of alpha arbutin with HSA |
配体小分子与蛋白质的相互作用力属分子间的弱相互作用, 结合力类型主要包含疏水作用力、 氢键、 静电作用力和范德华力。 温度变化不大的条件下, 焓变Δ H可以视作为一个常数, 根据公式
可以求得热力学参数, 通常Δ S> 0, Δ H> 0表明体系中存在疏水作用力; Δ S> 0, Δ H< 0说明同时存在疏水作用力和氢键; 当Δ S< 0, Δ H< 0时, 则主要存在范德华力和氢键[7]。
由表2可知, 反应的Δ G< 0, 说明反应可自发进行; Δ S> 0, Δ H< 0说明α -熊果苷与HSA间的相互作用力主除了疏水作用力, 兼有氢键的存在。
| 表2 α -熊果苷与人血清白蛋白相互作用的热力学参数 Table 2 The thermodynamic parameters of alpha arbutin-HSA binding procedure |
2.4.1 同步荧光光谱
同步荧光法是通过选取合适的波长差从而把相互重叠的峰分开。 HSA的荧光强度主要来自于色氨酸、 酪氨酸的残基贡献, 固定Δ λ =15 nm和Δ λ =60 nm, 分别得到代表酪氨酸和色氨酸的荧光光谱。 发射波长强度的改变可以断定蛋白质色氨酸和酪氨酸残基的微环境极性的改变, 进而断定人血清白蛋白的构象改变。
由图3可知, 随着加入α -熊果苷浓度的升高, HSA分子中代表色氨酸和酪氨酸的荧光光谱均得到增强, 且代表色氨酸的荧光增强的程度要比代表酪氨酸的大, 其中色氨酸对应的光谱图峰形不发生改变, 酪氨酸残基所对应的荧光光谱图产生了红移。 表明α -熊果苷的加入改变了HSA中色氨酸和酪氨酸附近的微环境, 使得酪氨酸残基所处的微环境极性有所增强, 从而使蛋白质结构变得致密。
2.4.2 紫外吸收光谱
紫外吸收光谱可判断α -熊果苷对HSA二级结构影响。 图4为加入不同浓度梯度α -熊果苷后HSA在200~350 nm范围内紫外吸收光谱图。
 | 图4 α -熊果苷与人血清白蛋白的紫外可见光谱Fig.4 UV-Vis absorption spectra of alpha arbutin-HSA system cHSA=2× 10-6 mol· L-1; a: cHSA=2× 10-6 mol· L-1; b— e: carbutin/cHSA=2, 8, 14, 20; T=298 K; pH=7.4 |
从图中可以看出, HSA分别在218和280 nm处随着α -熊果苷浓度的增加, 紫外吸收强度均发生增大, 说明蛋白质色氨酸和芳香族氨基酸残基附近的微环境均产生变化, 蛋白质的构象也变得更加致密。
2.4.3 圆二色光谱
圆二色光谱能进一步验证α -熊果苷浓度的增加与HSA产生相互作用, 从而使蛋白质的二级结构产生变化。 人血清白蛋白的圆二色光谱在208及220 nm有两负槽, α 螺旋在208及220 nm的两个负槽称作双槽曲线, 这两个负槽是由于HSA肽链α 螺旋肽键n-π * 跃迁导致。 α 螺旋含量可用公式[8]计算
从图5中可以看出α -熊果苷的加入使HSA在208及220 nm处的负槽减小, 但峰形并未变化。 通过公式计算α -熊果苷加入后使HSA的α 螺旋结构含量从58.81%降至55.60%, 进一步表明α -熊果苷与HSA发生了相互作用, α 螺旋含量降低从而使HSA的构象产生变化。
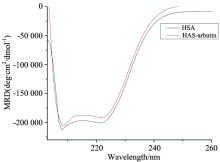 | 图5 α -熊果苷与人血清白蛋白相互作用的圆二色谱图Fig.5 CD spectra of the alpha arbutin-HSA system a: HSA: 10× 10-6 mol· L-1; b: HSA: 10× 10-6 mol· L-1+arbutin: 10× 10-5 mol· L-1; pH 7.40, T=298 K |
2.4.4 三维荧光光谱
三维荧光光谱也是考察蛋白质二级结构变化的有效方法。 用来探究蛋白质与小分子结合后的构象变化, 可显示蛋白质酪氨酸和色氨酸残基的改变。 图6为α -熊果苷加入前后HSA构象及微环境变化的三维荧光光谱。
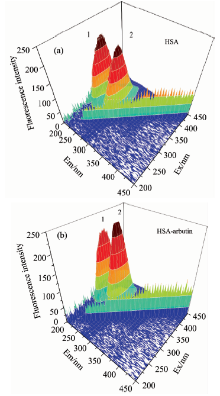 | 图6 α -熊果苷-人血清白蛋白的三维荧光光谱图Fig.6 Three-dimensional fluorescence spectra of the alpha arbutin-HSA system |
荧光主要由HSA多肽链的结构上C=0的P→ P* 跃迁导致的, 峰1主要表现多肽链的荧光特征; 峰2的荧光主要是酪氨酸和色氨酸残基引起的[9]。 随着α -熊果苷的加入, 荧光峰1和峰2的强度都有所增加, α -熊果苷对峰2的增强作用极为明显, 并且加入α -熊果苷后荧光峰1的波长红移了2 nm, 峰2的波长产生蓝移13 nm, 说明α -熊果苷与HSA相互作用导致蛋白多肽链轻微收紧, 一部分在蛋白分子内部疏水氨基酸残基裸露使得蛋白质疏水腔发生改变, 从而使血清白蛋白构象发生改变。
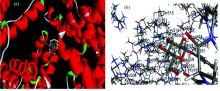
HSA分子结构通过 X衍射确认(PDB编号4K2C), 三维晶体结构显示, HSA的键合区域分别存在于亚结构域Ⅱ A和Ⅲ A的疏水腔, 又称作位点Ⅰ 和位点Ⅱ (siteⅠ , siteⅡ )[10]。 运用AutoDock软件来模拟分子对接, 得到了一系列模拟图如图7所示。
由图7可以得知α -熊果苷与HSA相互作用位点位于亚域IIIA中; 可以证明HSA有足够空间能够与熊果苷分子相互作用从而使两者相互作用的体系处于稳定状态。 熊果苷分子与疏水性氨基酸Cys514, Glu565, Cys558, The589等氨基酸很接近, 证明α -熊果苷与蛋白质之间有疏水作用力; 此外α -熊果苷主要与位于亚域Ⅲ A的LYS436和SER435残基形成氢键与前面根据热力学参数推导的作用力类型相一致。 蛋白质与配体形成的氢键降低了物质的极性, 使α -熊果苷与HSA体系间的荧光增强; α -熊果苷没有与Trp214残基相邻证明了α -熊果苷不会猝灭蛋白质内源荧光。 从α -熊果苷与HSA的结合点位使用对接模式计算得出的吉布斯自由能值Δ G=-32.74 kJ· mol-1, 与实验所得结果(-35.50 kJ· mol-1)也是相近的。 通过分子模拟可以得知α -熊果苷与HSA键和模式除了大部分是氢键, 另外还存在疏水作用力的影响。
凭借荧光光谱、 紫外可见光谱、 三维荧光光谱和圆二色等一系列光谱学方法探查了不同条件下α -熊果苷与人血清白蛋白的相互作用。 不同光谱法的研究结果表明, 药物对HSA的荧光有增强作用, 表现为荧光增强效应。 根据荧光增强效应方程作图得出α -熊果苷与HSA的结合常数以及热力学的一系列参数, 由此推测出α -熊果苷和HSA之间的主要作用力是氢键和疏水作用力。 由同步荧光、 圆二色和三维荧光证实了了α -熊果苷对HSA二级结构的影响。 分子对接模型进一步得到了α -熊果苷在HSA上的结合位点位于亚域IIIA中, 进一步确定了二者间的相互作用力类型, 计算得出了热力学参数, 从而进一步验证了前面通过荧光增强效应方程所得出的键和模式。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|