作者简介: 王玉田, 1952年生, 燕山大学电气工程学院教授 e-mail: y.t.wang@163.com
酚类化合物对动植物机理有着严重危害, 利用三维荧光光谱结合交替惩罚三线性分解(APTLD)算法, 完成了不含干扰物和干扰物共存时激发-发射荧光光谱重叠严重的麝香草酚、 对苯二酚和苯酚的直接快速准确定性、 定量分析。 研究了温度对三种酚类化合物荧光强度的影响。 对扫描所得激发-发射矩阵信号(EEM)进行二次去散射和光谱校正预处理, 最大程度保留了原光谱信息, 避免光谱严重失真。 将APTLD算法与平行因子(PARAFAC)和交替三线性分解(ATLD)算法进行对比, 突显该算法的优势。 实验得出, APTLD算法能够较好的解析荧光光谱数据的重叠峰, 分别得到三种目标分析物的荧光光谱, 实现快速定性分析; 定量分析时平均回收率为(97.4±4.5)%~(103.1±3.0)%; 预测均方根误差(RMSEP)低于1.664×10-2 μg·mL-1, 且检测限低于国家标准; 处理过程简洁快速, 为水环境中酚类化合物实现现场检测和在线实时监测提供了有力依据。
Phenols have serious harm to animals and plants. The experiment is a direct, rapid and accurate method for the qualitative and quantitative analysis of phenols in the case of interference and no interference by the method of fluorescence spectrometer combined with APTLD algorithm. The effects of temperature on the fluorescence intensity of thymol, hydroquinone and phenol were studied. After the comprehensive consideration, the experiment was carried out at 20 degrees centigrade. The obtained spectral data array is processed by eliminating scattering and correction. The original spectrum information is preserved to avoid the serious distortion of spectrum. APTLD algorithm is compared with PARAFAC and ATLD algorithm, highlighting the advantages of the algorithm. Experimental results showed that the APTLD algorithm can well analyze the overlapped peaks of the fluorescence spectrum data and obtain the fluorescence spectra of three target analytes respectively, achieving rapid qualitative analysis; the average recovery rate of the quantitative analysis is 97.4%±4.5%~103.1%±3%; The root mean square error of prediction is less than 1.664×10-2 g·mL-1, and the detection limit is lower than the national standard; The treatment process is simple and rapid, which provides a powerful basis for on-site detection and on-line real-time monitoring of phenolic compounds in water environment.
由于工业、 农业和家庭污水的排放, 或者自然现象的产生使得水体中存在酚类化合物, 这些化合物对人类和动物有致癌作用, 接触高浓度的酚可能会导致心脏、 肾脏和肝脏损伤, 被美国环保局和欧盟列为优先关注的污染物[1, 2, 3, 4]。 麝香草酚等酚类化合物在水环境中都是痕量级存在。
目前, 国内外检测水中酚类化合物较为常见的方法有气相色谱法、 高效液相色谱法等测定方法。 Asiabi等[5]采用固相微萃取-高效液相色谱法测定水环境中酚类化合物; 金铎等[6]利用气相色谱法测定水体中痕量酚类; 但这些方法缺点是消耗较多有机溶剂, 操作繁琐, 费用昂贵、 费时, 不利于满足现场检测的要求。 三维荧光光谱结合APTLD二阶校正法具有“ 二阶优势” , 可实现“ 数学分离” 代替“ 物理化学分离” [7, 8, 9, 10], 解决了在未知干扰物共存、 未校正背景干扰情况下, 分析物之间或分析物和基体之间光谱重叠严重问题, 实现多组分同时定性、 定量分析。 该方法操作简易、 检测高效且绿色环保, 具有较高的灵敏度和较低的检测限。
本文采用荧光光谱仪获得的激发-发射矩阵信号(excitation-emission matric, EEM)数据与交替惩罚三线性分解算法(APTLD)相结合, 实现对光谱重叠严重的麝香草酚、 对苯二酚和苯酚三种酚类混合物的直接、 快速定性与定量研究, 且结果稳定可靠。 经检索, 国内针对三维荧光光谱结合化学计量学对水中酚类检测的报道较少; 因此基于EEM结合二阶校正法检测水中酚类化合物的研究对水环境中酚类现场检测和实时监测具有重要意义。
荧光是物质在吸光之后所发射的辐射, 因而溶液的荧光强度与溶液吸收的光强度、 物质的荧光量子产率有关[11]。 根据Beer-Lambert定律, 荧光强度IF和酚类浓度c关系式为
用泰勒级数将式(1)展开, 当酚类溶液浓度很低时, 忽略高次项, 得到
式(2)中, Φ F为酚类化合物荧光量子产率, I0为入射光强度, ε 为酚类化合物的摩尔吸收系数, l为溶液中光的投射光程。
在I个激发波长、 J个发射波长设置下对K个不同浓度配比样本进行扫描, 得到相应的EEM数据阵列, 组成一个大小为I× J× K的三维数据阵X。 标量形式表示为
式(3)中, Xijk是数据阵X中的元素(i, j, k), ain是相对激发光谱矩阵A中的元素(i, n), bjn是相对发射光谱矩阵B中的元素(j, n), ckn是相对浓度矩阵C中的元素(k, n), eijk是残差数据阵E中的元素(i, j, k), N代表该体系组分数, 包括分析物、 干扰物和背景等。
三线性成分模型符合Lambert-Beer定律; 解具有唯一性[12], 具有明确的含义。 当在检测样本中含有未知干扰物时, 也可以快速完成对分析物的定性定量分析[13]。
APTLD算法是基于交替最小二乘原理和交替惩罚限制使3个不同的交替惩罚误差同时实现最小化[7], 从而实现三线性分解。 迭代过程如下:
(1)初始化A和B, 确定合适的惩罚因子r, p, q, 取r=p=q=1020;
(2)由A和B及惩罚因子计算C;
C=(
diag(b(j))+p
diag(a(i)))(
diagm(BTB)))diag(b(j))+p
diagm(ATA))diag(a(i))2)+(4)
(3)由B和C及惩罚因子计算A;
A=(
diag(C(k))+q
diag(b(j)))(
diagm(CTC)))diag(c(k))+q
diagm(BTB))diag(b(j))2)+(5)
(4)将A逐列归一化;
(5)由C和A及惩罚因子计算B;
B=(
diag(a(i))+r
diag(c(k)))(
diag(1./diagm(ATA)))diag(a(i))+
r
(6)对B进行归一化处理;
(7)由式(4)计算得到C;
(8)返回步骤三, 依次迭代, 直至收敛。
惩罚因子r, p, q对APTLD算法进行约束, 是使其性能优越于平行因子(PARAFAC)和交替三线性分解(ATLD)的关键, 可以对未知样本中的目标分析物直接定性定量分析。
其中Xi.., X.j. 和X..k分别表示EEM数据阵X第i个沿着激发方向矩阵(J× K)、 第j个沿着发射方向矩阵(K× I)、 第k个沿着浓度方向矩阵(I× J)。 a(i), b(j), c(k)分别为矩阵A, B, C的第i, j, k个行矢量。 “ +” 是Moore-Penrose广义逆。
用品质因子来评价算法性能的好坏, 预测结果准确度以及稳定性。 如检测限和预测均方根误差。
式(7)中, S0是3个空白背景样预测浓度的标准偏差。
预测均方根误差(RMSEP)[16]表达式为
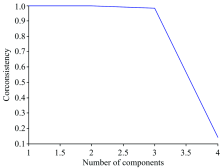
虽然APTLD对组分数不敏感, 但依据应用经验知, 组分数过大则会增大模型误差。 因此, 在处理所得3D荧光光谱数据前应该确定好组分数。 进行组分数估计的方法有加一法、 交叉验证法等, 本文采用核一致诊断法(CORCONDIA)[17]对混合物体系的3D荧光数据进行秩估计。
仪器: FS920稳态荧光光谱仪(英国Edinburgh Instruments 公司), 光谱波长响应范围200~900 nm, 液氮制冷范围77~320 k, 激发光源为功率450 W的脉冲氙灯, 信噪比6 000∶ 1, Czerny-Turner光路单色仪, 激发和发射端狭缝宽度为1.11 mm。 实验设置激发波长为230~320 nm, 步长2.0 nm; 发射波长为240~360 nm, 步长2.0 nm。 样品室温度20 ℃。
试剂: 麝香草酚(GC, > 99%), 对苯二酚(GC, ≥ 99.5%), 苯酚(GC, > 99.5%), 间甲酚(GC, > 99%), 甲醇(色谱纯), 均购买于上海阿拉丁试剂公司; 去离子水(实验室自制)。
分别称取0.1 g麝香草酚(Thymol)、 对苯二酚(HYD)、 苯酚(Phenol)和间甲酚(M-cresol), 烧杯中溶解后在100 mL棕色容量瓶中定容, 得到1 g· L-1一级储备液; 取0.1 mL一级储备液用去离子水定容至10 mL棕色容量瓶, 得到10 mg· L-1工作液, 放于冰箱中保存(4 ℃)。 实验时分别取适量工作液于17个10 mL棕色容量瓶内, 用去离子水定容得到样本溶液, 以上操作过程在避免光照条件下进行。
分别用工作液配制一系列不同浓度的麝香草酚、 对苯二酚和苯酚单组分溶液, 逐个进行扫描, 确定最佳线性范围, 发现三种酚类在0~1.0 μ g· mL-1浓度范围内, 相关系数均大于0.999。 根据均匀设计表, 得到如表1所示样本浓度(C1— C9为校正样本, T1— T5为不含干扰物的预测样本, T6— T8为含干扰物的预测样本)。 为了更好的去除散射, 实验扫描过程中, 在不同阶段测定10个去离子水空白样本, 光谱预处理时扣除空白样本的平均值, 能够最大程度的减少背景溶剂(去离子水)的Raman散射、 Rayleigh散射和衍射的影响。
| 表1 校正样本和预测样本浓度 Table 1 Concentration of calibration and prediction samples (μ g· mL-1) |
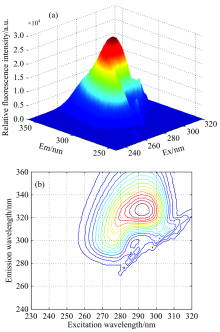
随着样品室温度的变化, 麝香草酚等酚类化合物的荧光量子产率也会发生改变, 通常在一定温度范围内, 随着温度的升高量子产率降低, 导致分析物的荧光强度降低。 以麝香草酚为例, 不同温度下麝香草酚荧光强度如图1所示。
这是由于当麝香草酚溶液温度升高时, 溶剂的驰豫作用减小, 麝香草酚的荧光分子和溶剂分子的碰撞猝灭概率加大, 因此麝香草酚的荧光强度减弱。 经对比实验结果和查阅文献, 样品室温度为20 ℃时就能获得更为理想的光谱信号。
从实验扫描得到的EEM光谱数据阵列中, 选择校正样本C5绘制3D荧光光谱图(图2所示, 二次去散射前)。 麝香草酚(Thymol)、 对苯二酚(HYD)和苯酚(Phenol)的光谱存在严重的激发-发射光谱重叠现象, 传统荧光分析方法不能实现对目标分析物的直接快速的定性和定量分析。
由于受到溶剂和其他因素的影响, 扫描所获得的光谱存在Raman散射和Rayleigh散射(以麝香草酚为例), 如图3(a)所示。 通过扣除空白样本的平均值后可完全去除Raman散射和部分Rayleigh散射, 但仍存在较强的Rayleigh散射, 如图3(b)所示。 因此通过Delaunay插值法对扣除空白样本均值后的光谱进行二次去散射。 因为扣除空白样本的光谱图中[图3(b)]只存在部分一级Rayleigh散射, 所以选定激发波长290 nm以后, 发射波长等于激发波长处及其临近区域为散射区域(± 10~15 nm)。 由图3(c)看出, Delaunay插值法可以有效的去除剩余散射, 凸显出有用信息。 扣除空白样本均值后的EEM数据的散射区通过Delaunay插值法进行去除, 其余区域未作改变, 因此, 最大程度的保留了大部分原始有用信息, 避免定性分析时光谱失真现象。
因仪器和环境因素的影响, 扫描所得光谱为表观光谱, 需要对所得荧光光谱进行激发、 发射校正, 校正后得到真实光谱。 由图3(d), (e)和(f)看出, 校正后荧光峰位置发生变化和荧光强度显著增强, 光谱更加圆滑, 因此, 校正使光谱信息更加准确。
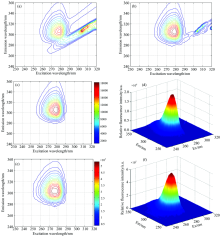
将C1— C9样(校正样本)和未加干扰物的T1— T5样(预测样本)的EEM光谱数据矩阵列组合得到(46× 61× 14)的三维响应矩阵, 应用APTLD算法进行解析。 如图4所示, 当组分数大于3时, 核一致值急剧减小, 且小于60%, 因此选择组分数为3。 分析得到的激发、 发射荧光光谱结果如图5所示。
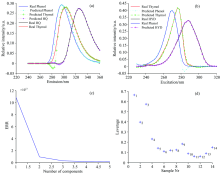
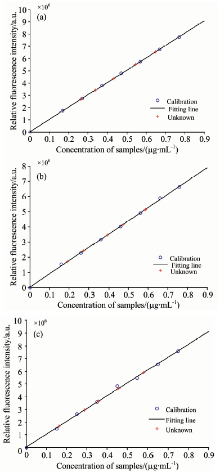
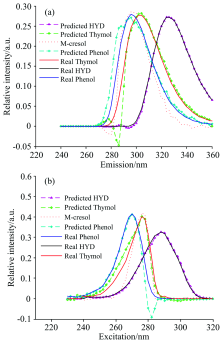
由图5(a)和(b)可以看出, 麝香草酚、 对苯二酚和苯酚三种酚类的主要荧光峰位置的激发-发射波长分别为: 276 nm/304 nm, 288 nm/326 nm, 270 nm/298 nm, 三者的激发、 发射光谱严重重叠, 在检测时往往互相干扰。 用APTLD算法进行解析, 预测结果(图5中加标虚线)与其真实光谱图(图5中实线)非常相似。 因为在光谱预处理时采用了先扣除空白样本均值, 再对剩余散射区域应用Delaunay插值法, 所以预测光谱失真程度较低, 因此APTLD算法定性分析结果更加理想。 图5(c)为残差分析, 当组分数趋近于3时, 值越来越小, 趋于平缓, 从另一角度证明了组分数为3(与核一致分析相同)。 图5(d)为样本图。 三种算法的预测结果参数见表2和表3。 将校正样本浓度和荧光强度进行拟合, 相关系数均大于0.999, 如图6所示。
| 表2 未加干扰预测样本的三种酚类的浓度及预测结果 Table 2 The added and predicted concentrations using APTLD in the predicted samples with no interference (N=3) |
| 表3 方法精密度测定结果 Table 3 Data of precision test |
因为实际水体中, 往往还含有其他酚类和物质, 在本次实验中加入适量的间甲酚作为溶液中的干扰物。 将C1— C9(校正样)和T6— T8(含有干扰的预测样)的EEM光谱数据矩阵列组合得到(46× 61× 12)的三维响应矩阵, 核一致诊断法确定组分数为4, 将干扰物和背景视为一类荧光物质, 应用APTLD算法进行解析。 分析所得激发、 发射荧光光谱结果如图7所示。
因为共存干扰物间甲酚的荧光峰位置(274 nm/300 nm)与麝香草酚荧光峰的激发波长(276 nm)和苯酚荧光峰的发射波长(298 nm)极其相近, 光谱相似且重叠现象非常严重, 所以模型对苯酚和麝香草酚与间甲酚重叠部分相对于不含干扰物时分辨较差。 在定性分解时, 麝香草酚的激发光谱图(在246~270 nm范围)和苯酚的发射光谱图(在272~292 nm范围)产生一定程度的失真, 但仍然非常相似; 在定量分析时产生一定的影响, 但分析结果仍然准确且优于其他算法, 可信度高, 充分体现了APTLD算法的“ 二阶优势” 。 将校正样本浓度和荧光强度进行拟合, 相关系数均大于0.999, 三种算法对干扰物共存样本的预测结果见表4和表5。
| 表4 含干扰物预测样本的三种酚类的浓度及预测结果 Table 4 The added and predicted concentrations using APTLD (N=4) in the predicted samples with interference |
| 表5 方法精密度测定结果 Table 5 Data of precision test |
由样本分析的结果可知, 从准确度来看, 三种算法的检测结果都比较好, APTLD算法稍优于其他两种算法, 尤其是存在干扰物时; 从算法自身原理来看, PARAFAC对线性要求严格且对组分数敏感, 选取组分数大于估计组分数时, 易陷入“ 沼泽” , 迭代次数多, 耗时长。 尽管ATLD算法优化了以上缺点, 但仍然存在求解不稳定, 受制于噪声水平等缺点, 不利于现场检测和实时监测的要求。 APTLD算法是由ATLD发展而来, 计算快速、 准确、 稳定, 适用于复杂体系中。 三种算法比较如表6所示。
| 表6 三种算法的性能比较 Table 6 Conclusion about PARAFAC, ATLD and APTLD |
研究了温度对酚类化合物量子产率的影响, 经对比实验结果和查阅文献, 样品室温度为20 ℃时就能获得更为理想的光谱信号。
采用先扣除空白样本平均值, 再用Delaunay插值法对剩余散射进行处理的二次去散射方法, 最大程度的保留了原光谱信息, 避免了算法解析时光谱失真现象, 提高了检测准确度。
将APTLD算法与其他二阶校正算法对比, 突显了APTLD算法准确度高, 计算速度快, 不受限于噪声水平且结果稳定的优势; 以“ 数学分离” 代替繁琐的“ 化学分离” 。 实验中三种酚类化合物的平均回收率在97.4%~103.1%, 预测均方根误差(RMSEP)低于1.664× 10-2 μ g· mL-1, 检测限低于0.001 6 μ g· mL-1。 为实现现场检测和在线实时监测提供了可靠依据, 具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|