作者简介: 赵晓雪, 1995年生, 浙江农林大学工程学院硕士研究生 e-mail: zxxzafu@163.com
光谱分析法结合物理模建研究小檗淫羊藿甙(ICA)与清蛋白(HSA)的分子间作用, 采用多种理论方程描述ICA与HSA分子间作用, 并比较分析ICA与HSA分子间作用适用模型。 运用荧光光谱法研究ICA与HSA的分子间作用。 结果表明, ICA与HSA分子间作用具有荧光特征谱, ICA与HSA的分子间作用力使得HSA的荧光强度呈现规律性变迁, 说明ICA与HSA确实发生了分子间作用。 同步荧光光谱结果表明ICA与HSA的分子间作用使得HSA的微区构象发生改变。 利用Lineweaver-Burk方程、 双对数回归方程、 Scatchard系列方程、 Stern-Volmer方程、 Lehrer-Fasman方程和Tachiya模型分别描述ICA与HSA的分子间作用, 发现不同理论模型描述分子间作用可分为两类定量结果, 通过物理模建技术辅助确定ICA与HSA分子间作用模式, 得到双对数线性回归方程更符合ICA与HSA分子间作用模型, 同时辅助解析ICA与HSA的分子间作用, 物理模建结果表明ICA与HSA的分子间作用发生在HSA活性位域Sudlow’s sites Ⅰ, 且主要是通过范德华力、 疏水作用力和氢键发生分子间作用。 该研究所得结果可为全面分析ICA与HSA分子间作用机理提供借鉴, 也为小分子与生物大分子的分子间作用的理论描述研究提供有益参考。
The intermolecular interaction between Icarrin (ICA) and Human Serum Albumin (HSA) was investigated by spectral method and building molecular model to explore ICA-HSA mechanism of interaction. And the intermolecular interaction model of ICA-HSA was described by using a variety of theoretical equations to compare and discuss their usability. The results showed that the fluorescence intensity of HSA in the fluorescence spectra showed regular decrease, indicating that HSA did interact with ICA. The synchronous fluorescence spectrum showed that micro-conformation of HSA changed due to the intermolecular interaction between ICA and HSA. The intermolecular interactions of ICA-HSA were described using Stern-Volmer equation, Lineweaver-Burk equation, double logarithmic regression equation, Scatchard series equation, Lehrer-Fasman equation and Tachiya model respectively. The results showed that the theoretical model was different and the results were different from ICA-HSA. There are two quantitative kinds of trends based on the differences between hypothesis and experimental conditions. In this paper, physical model was built to assist the intermolecular interaction mode of ICA-HSA.The optimal mode of ICA-HSA intermolecular interaction was the double logarithmic equation. Meanwhile, the ICA-HSA intermolecular interaction was analyzed by physical modeling, indicating that the ICA tend to occurr in active site Sudlow’s sites I and ICA-HSA system mainly has van der Waals force, hydrophobic interaction and hydrogen bonding. These results obtained in this paper serves to provide a reference for the comprehensive analysis of ICA-HSA intermolecular interaction, as well as the theoretical description of the intermolecular interactions between small molecules and biomacromolecules.
现有的分子体系中, 化学键是描述分子内原子形成分子体系的基础, 是较强的分子内作用力, 已有成熟的理论体系。 而相对较弱的分子间作用力对分子的构型甚至是构象都会产生影响, 从而改变物质的理化性质, 因此, 分子间作用力对分子物质体系的影响越来越受重视, 例如, 药物小分子进入生物体必然与生物体内的生物大分子发生分子间作用, 进而产生药理和毒理作用。 目前, 研究有机物和其他分子相互作用已有大量报道[1, 2, 3, 4], 但在小分子与生物大分子间的分子间作用力研究较少, 且研究思路和方法少有相应的理论创新。 因此, 用物理模建结合光谱学方法研究生物大分子与小分子的分子间作用具有普遍意义, 并且生物大分子与小分子的分子间作用是物理学、 化学、 生物学、 医学等领域的交叉内容, 开展生物大分子与小分子的分子间作用研究极有意义。
目前, 对于生物大分子与小分子的分子间作用体系而言, 由于生物大分子微观结构比较复杂, 因此研究生物大分子与小分子的分子间作用有一定难度, 所采用的研究方法主要有光谱法、 色谱法、 电化学法等, 由于荧光光谱法灵敏度高、 选择性好、 待测样品用量少和实验方法简洁等诸多优点[5, 6, 7], 使其成为研究生物大分子与小分子的分子间作用的有效手段, 该方法主要通过对光谱特征峰及其在不同条件下的变迁规律, 从而获得生物大分子与小分子的分子间作用信息。
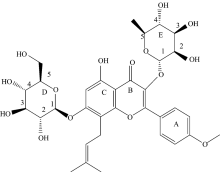
本文考察小檗淫羊藿甙(Icarrin, ICA)与清蛋白(Human serum albumin, HSA)的分子间作用。 ICA是典型的黄酮苷类化合物, ICA药理学特性关键在于抗癌、 增强机体免疫力和改善心脑血管等方面, 是目前国内外青睐的中药活性成分之一。 由于ICA是黄酮苷活性成分的典型代表, 因而开展ICA与HSA的分子间作用对研究黄酮苷类化合物与清蛋白的分子间作用具有十分重要的意义。
本文从生物和物理学角度, 运用光谱实验和物理模建的方法研究ICA与HSA分子间作用, 比较优化药物小分子与清蛋白的物理模型, 可为全面了解黄酮苷类活性物质与生物大分子的分子间作用为研究微观药理机制提供有益参考。
三羟甲基氨基甲烷(Tris, 上海华美生物工程公司)配制成0.1 mol· L-1, pH 7.4的Tris-HCl缓冲液(内含0.1 mol· L-1 NaCl); 其他试剂均为分析纯; 人血清白蛋白(HSA, 纯度≥ 98%, 上海华美生物工程公司)用pH 7.4的Tris-HCl缓冲液配制成1× 10-5 mol· L-1备用; 小檗淫羊藿甙(ICA, 纯度≥ 98%, 上海华美生物工程公司)用乙醇配制成1× 10-3 mol· L-1; 实验用水均为二次蒸馏水。
F-4500型荧光光度计(Hitachi, 日本); UV-2600型紫外-可见分光光度计(Shimadzu, 日本); ZD-2型自动电位滴定计(上海精密科学仪器有限公司); ChemDraw软件(美国CambridgeSoft公司); Discovery Studio 2.5 软件(美国BIOVIA公司); AutoDock软件(4.02 version)。
1.3.1 ICA与HSA分子间作用的荧光发射光谱测定
移取HSA溶液(cHSA: 1.0× 10-5 mol· L-1)2.5 mL于1 cm比色皿中, 微量加样枪分别加入不同浓度的ICA溶液[cICA: (0.0, 0.4, 0.8, 1.0, 1.6, 2.4, 3.2)× 10-5 mol· L-1]进行荧光滴定, Tris-HCl缓冲液作为荧光空白校正。 设置荧光发射与激发狭缝宽度5 nm, 波长扫速为240 nm· min-1, 固定激发波长为280 nm, 室温下绘制250~700 nm的发射光谱。
1.3.2 ICA与HSA分子间作用的同步荧光光谱测定
荧光光谱仪扫描激发波长和发射波长之间波长差(Δ λ )分别为15和60 nm的ICA与HSA分子间作用体系的同步荧光光谱, 其余测量条件及空白组和实验组溶液配制、 浓度梯度设置与1.3.1实验操作一致。
1.4.1 Stern-Volmer方程
对于生物大分子与小分子的分子间作用, 若小分子ICA(Q)与生物大分子HSA(P)反应, 则分子间作用的结合常数为
其中, [P]为HSA浓度, [Q]是ICA浓度, [QP]是ICA与HSA发生分子间作用形成的非共价复合物的浓度。
若HSA的总浓度为[P0], 且HSA的总浓度是ICA-HSA非共价复合物的浓度与反应体系中HSA浓度的和, 在分子间作用过程中, 若只有HSA产生荧光, 而且ICA-HSA复合物在测定波长范围内不产生荧光, 则
将F0/F对[Q]线性回归可通过斜率获得ICA-HSA分子间作用的结合常数Ka。
1.4.2 校正Stern-Volmer方程
通常测定荧光时会考虑杂散光对实验体系的影响, 杂散光会使得实验数据出现偏差, 因此需要考虑基团各自的荧光效率[8], 引入荧光校正系数fa, 则校正的Stern-Volmer方程
式(3)中, Ka是结合常数。 F0/(F0-F)对[Q]-1进行线性拟合, 斜率为(faKa)-1, 截距为fa, 结合常数Ka为截距与斜率的商。
1.4.3 Lineweaver-Burk双倒数方程
Lineweaver-Burk双倒数方程, 是另一个适用于计算小分子药物与生物大分子的分子间作用结合常数。
计算时以(F0-F)-1对[Q]-1作线性回归, 截距与斜率的比值即Ka。
1.4.4 双对数方程
一般生物大分子与小分子的分子间作用都不是简单的1∶ 1结合, 通常生物大分子是以1∶ n方式结合[8], 则可以根据双对数回归曲线进行分子间作用结合模型分析
F0与F分别为小分子ICA加入前后HSA的荧光强度, Ka为结合常数, n为结合位点数, [Q]为ICA的游离浓度。 以lg[(F0-F)/F]对lg[Q]作实验数据线性拟合得到Ka和n。
1.4.5 Scatchard方程
将小分子药物与蛋白质大分子的分子间作用设定为小分子在大分子特定位域的结合, 当蛋白质大分子有m个可作用区域, 且每个区域有n个等效的结合位点, 可结合n个小分子时[8], 则有Scatchard方程
式(6)中, [Q0]为体系中ICA的总浓度, [P0]为HSA的总浓度, [P]为HSA的游离浓度, 以[Q0]F0/(F0-F)为横坐标, F0/F为纵坐标进行一元线性拟合, 则依据直线的斜率和截距即可确定结合常数Ka和结合位点数n。
在Scatchard方程变换下, 可得到相关方程, 如式(7)
式(7)中, 蛋白质的浓度[P], 药物的浓度[Q], 对实验数据按式(7)进行拟合, 可求得Ka和n。
1.4.6 Scatchard方程修正式
根据位点结合模型, 提出了一个确定小分子与生物大分子分子间作用的公式[9]
式(8)中, [P]和[Q]分别为蛋白质和药物溶液的浓度之和, F和F0分别表示加入和未加入小分子药物时的蛋白质溶液的荧光强度。 实验数据做非线性最小二乘法曲线拟合即可得到Ka和n。
1.4.7 Lehrer-Fasman方程
假设HSA荧光体具有等效独立的结合位点, 每个小分子ICA与HSA的分子间作用在每个位点有相同强度的作用效果, 则Ka可由式(9)获得
β =(F0-F)/(F0-F∞ ), [Q]=[Q0]-nβ [P], [Q]为小分子的游离浓度; 以β /(1-β )对[Q]作回归曲线得斜率Ka值。
1.4.8 Tachiya模型
Tachiya模型公式[10]认为一个HSA分子上所含有的能与小分子结合的位点数与实际结合的ICA的数目有偏差。 当小分子浓度[Q]很高, 达到饱和态时, 生物大分子上的所有结合位点都已被小分子占用, 使得再增加[Q]也不会导致结合数的增大, 此时, Tachiya公式为
式(10)中, n为结合位点数; r为蛋白质与小分子ICA的结合距离; R0为Fö rster距离(能量转移达到50%时偶极-偶极之间的距离)。
而当[Q]极低时, 小分子ICA与生物大分子的荧光体结合的平均数很小, 则公式可表示为
1.5.1 准备ICA与HSA对接参数文件
PDB数据库获取“ 1h9z” 清蛋白晶体结构的pdb文件。 Discovery Studio打开1h9z.pdb文件对其进行除水、 加氢、 计算点电荷的前期处理, 保存为pdbqt文件。 Chemdraw构建配体ICA分子, 能量优化后保存为pdb文件。 AutoDock软件中对其进行加氢、 添加电荷、 添加原子类型的前期处理, 保存为pdbqt文件, 在AutoDock中打开pdbqt格式的清蛋白, AutoDock的Grid模块设置格点图, 格子的大小X, Y, Z分别设置为X: 60, Y: 60, Z: 60, 格点间隔为0.375 Å , 输出保存为gpf格式文件。 AutoDock的Docking模块打开HSA的pdbqt文件和ICA的pdbqt文件, 采用Lamarchian genetic algorithm (LGA)方法进行构象搜索, 输出保存为dpf格式。
1.5.2 ICA与HSA分子间作用物理模建
通过AutoDock软件自带的模建规则和python脚本, 建立ICA与HSA分子间作用模型。 首先, 利用半柔性对接方法使得HSA与ICA在活性区域内相互契合, 再根据LGA算法进行构象搜索得到最有可能的分子间作用方式, 基于经验性函数对分子对接进行结合自由能计算, 最后根据打分函数评价对接结果, 获得合理的ICA与HSA分子间作用模型, 进而结合光谱实验数据评估ICA与HSA分子间作用模建的合理性。
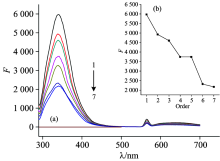
激发波长为280 nm时测定荧光光谱时的荧光主要来源于色氨酸残基、 酪氨酸残基和苯丙氨酸残基[12], ICA与HSA分子间作用的荧光发射谱如图2。
由表1可知, 当激发波长为280 nm时, 341 nm附近有HSA的最大发射峰, 随着ICA浓度的增加, HSA的荧光强度呈现持续降低趋势, HSA的荧光最大发射峰从339.8 nm迁移至342.8 nm, 出现了规律性迁移, 说明ICA与HSA发生了分子间作用。
| 表1 HSA, ICA-HSA荧光发射谱特征 Table 1 The Fluorescence emission spectra characterizes of HSA, ICA-HSA |
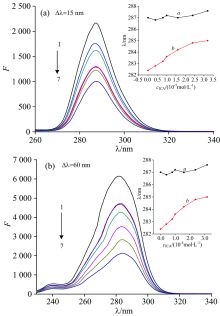
Δ λ =15 nm和Δ λ =60 nm所得到的同步荧光光谱分别代表Tyr残基和Trp残基的特征光谱[13]。 并且色氨酸残基和酪氨酸残基分别位于HSA活性位点Sudlow’ s sites Ⅰ 和Sudlow’ s sites Ⅱ 区域, 两种氨基酸残基的最大发射峰与其所处的微环境有关, 当λ max发生蓝移, 则表明氨基酸残基所处环境的疏水性增加, 反之, 则产生红移[11]。 因而, 可以通过ICA-HSA体系的同步荧光光谱来判断ICA与HSA分子间作用的位域, 如图3所示。
由图3(a)可知, 随着ICA浓度增加, Tyr残基的荧光强度降低明显, 最大发射波长几乎没有改变; 由图3(b)可见, Trp残基的最大发射波长降低更加显著, 随着药物小分子浓度的增加, 最大发射波长明显红移, 根据ICA与HSA分子间作用的变迁规律, 波长位移越大, 表明小分子与Trp残基所在的HSA活性位域发生分子间作用越明显, 因此, 可说明ICA与HSA分子间作用的位域以Trp氨基酸残基所在的Sudlow’ s sites Ⅰ 为主。 同步荧光光谱进一步从微观水平表明ICA与HSA发生分子间作用。
分子间的作用主要包括氢键、 静电作用、 范德华力等, 从基本上讲就是分子间的非共价结合作用力, 由于非共价结合作用力在一定条件下有协同作用, 形成具有方向性的强作用力, 使其成为生物大分子与小分子间结合的基础。 因此, 针对ICA-HSA体系, 运用不同理论方程计算分子间作用参数, 进而求算Gibbs自由能, 有利于ICA与HSA分子间作用力的分析。 小分子与生物大分子的分子间作用研究已建立了系列理论, 如Lineweaver-Burk曲线、 双对数回归曲线、 Stern-Volmer方程、 Scatchard系列方程、 Lehrer-Fasman方程和Tachiya模型, 利用这些方程计算分子间作用参数(Ka和n), 从宏观角度分析ICA与HSA分子间作用的理论模型适用度。
根据1.4理论方程, 以荧光特征谱的F值代入式(2)— 式(11), 按实验数据进行拟合, 并通过Vant’ t Hoff方程对ICA与HSA分子间作用体系进行适用度分析, 结果见表2。
式(12)中, Δ G为Gibbs自由能, R为气体常数, K由式(2)— 式(11)计算得到的Ka。
| 表2 描述ICA与HSA分子间作用的不同理论模型相关参数 Table 2 Related parameters of intermolecular interaction between ICA and HSA based on different models |
选择不同的理论方程描述ICA与HSA的分子间作用体系, 计算结果迥异。 将ICA与HSA的分子间作用看作是小分子在蛋白大分子上位点的结合, 首先, 二者的分子间作用力呈现出随着ICA浓度的升高而增加, 当到了一定浓度范围ICA-HSA体系存在一稳定的分子间作用力, 即不同梯度的ICA与HSA的分子间作用表现出先“ 占位” 后达到饱和的状态。 由表2可知, 从可量化的Ka和分子间作用的Gibbs能的角度来看, ICA与HSA分子间作用的理论模型可分为两类, 第一类理论模型(Stern-Volmer, 校正Stern-Volmer, Lineweaver-Burk, Scatchard系列方程和Lehrer-Fasman方程)的Ka值均比第二类理论模型(双对数方程、 Tachiya模型)的Ka值小一个数量级, 且Δ G的波动也明显小于第二类。 分析原因可能是由于第一类理论模型中的Stern-Volmer, 校正Stern-Volmer, Lineweaver-Burk方程是假设生物大分子与小分子是以1∶ 1的方式发生分子间作用, 而Scatchard系列方程和Lehrer-Fasman方程是假设小分子结合在生物大分子的特定位域, 且各位域的分子间作用是同等强度, 这些假设在实际的分子间作用时不满足设定的理想状态。 而第二类理论模型是设定生物大分子与小分子以1∶ n的作用方式且没有特定作用位域的限制。 因此推测双对数线性回归模型和Tachiya更符合ICA与HSA分子间作用的实际体系。 由理论模型描述分子间作用的结果可知, Δ G均为负值, 表明ICA与HSA发生分子间作用是一个自发的过程, 且ICA与HSA分子间作用趋势较强, 此结论与前述的荧光光谱相映证, 说明理论模型描述与光谱实验一致。
分子对接技术广泛用于蛋白质和药物分子通过几何匹配和能量匹配的分子间作用[12, 13, 14, 15]。 HSA有585个氨基酸残基, Sudlow等提出HSA分子间作用发生的两个主要的位域是Sudlow’ s sites Ⅰ 和Sudlow’ s sites Ⅱ 。 Site Ⅰ 以Trp 214为中心主要结合体积较大的疏水性杂环小分子; Site Ⅱ 以Tyr411为中心主要结合一些带有阴离子或负电荷的脂溶性小分子。 运用ICA分子对接HSA两个活性位域的方法可以间接判断ICA与HSA的分子间作用, 也可进一步验证光谱实验。 通过分子模建ICA与HSA分子间作用模型, 可以获取两者的分子间作用力与作用位域, 从分子水平阐述ICA与HSA分子间作用。 ICA与HSA活性位域Sudlow’ s sites Ⅰ 的分子对接结果见图4。
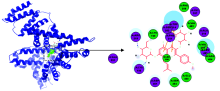 | 图4 ICA与HSA(Sudlow’ s sites Ⅰ )分子间作用的分子对接图及局部图 紫色代表参与氢键、 静电或极性相互作用的氨基酸; 绿色代表参与范德华相互作用的氨基酸Fig.4 Molecular docking and partial map of ICA and HSA (Sudlow’ s sites Ⅰ ) |
由图4可知, 在二者分子间作用过程中, ICA结合在HSA的表面活性口袋中, 整个分子处于被包围的状态, 结合口袋周围主要为疏水氨基酸残基: Leu198, Phe206, Gly207, Ala210, Phe211, Trp214, Ala291, Val344, Leu481, Val482, 这些氨基酸残基形成一个疏水区域, ICA分子的B, C环与Trp214形成π — π 共轭, Arg218, Lys195氨基酸残基分别与D环的4位和2位上的羟基氧形成氢键, 以上结果表明ICA与HSA体系的分子间的疏水作用力和氢键起着至关重要的作用。
考虑HSA的柔性造成该生物大分子的多构象型态, 以及ICA的多种可能构象, HSA晶态构象与优势ICA构象分子对接产生的ICA-HSA分子间作用模式未必为HSA晶态构象与优势ICA构象的简单“ 契合” , 需要分析ICA-HSA分子间作用自由结合能(Ebinding)判断ICA与HSA分子间作用力大小, Ebinding低者分子间作用力大, 为合理的分子间作用模型。 同时, Ebinding最低的分子间作用模型不一定是分子间作用的药效构象, 但药效构象一般与Ebinding最低分子间作用模型属于同一类构象模型。 由此, 通过聚类分析可以推断ICA与HSA分子间作用模型的分布。 本文优选10个对接构象以tolerance(RMS值公差)2.0进行聚类, 得到ICA与HSA(I)分子间作用体系的构象聚类图见图5。
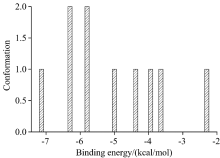 | 图5 ICA与HSA分子间作用的能量分布图 (Sudlow’ s sites Ⅰ )Fig.5 The distribution map of ICA and HAS docking energy (Sudlow’ s sites Ⅰ ) |
表3中列出了不同的ICA构象与HSA结合主要贡献的能量。
| 表3 ICA与HSA分子对接的能量 (Sudlow’ s sites Ⅰ ) Table 3 Binding energy of molecular docking between ICA and HSA (Sudlow’ s sites Ⅰ ) |
由图5、 表3可知, 在ICA与HSA(Ⅰ )实际对接的10个构象中, 得到8类聚类结果, 第1类的总能量值最优且有1个构象, 其次, ICA与HSA(Ⅰ )分子间作用力主要来自于范德华力(Evdw)。 结合图4分析结果, 在ICA与HSA(Ⅰ )分子间作用过程中, 范德华力、 疏水作用力、 氢键为ICA与HSA分子间作用力的主要贡献。
ICA与HSA分子的活性位点Sudlow’ s sites Ⅱ 的分子对接, 对接结果如图6。
 | 图6 ICA与HSA(Sudlow’ s sites Ⅱ )分子间作用的分子对接图及局部图 紫色代表参与氢键、 静电或极性相互作用的氨基酸; 绿色代表参与范德华相互作用的氨基酸Fig.6 Molecular docking and partial map of ICA-HAS (Sudlow’ s sites Ⅱ ) |
由图6可见, ICA结合在HSA的以Tyr411为中心的Sudlow’ s sites Ⅱ 活性位域, 结合口袋周围主要为疏水氨基酸残基: Leu387, Ile388, Val415, Val418, Leu423, Val426, Val428, Leu430, Leu453, Leu457, Leu460, Val473, Phe488, 这些氨基酸残基形成一个疏水区域, ICA的A, B环分别与Arg410形成π — π 共轭, A环还与Lys414也形成了π — π 共轭, 并且E环的2位羟基氧与Asn391形成氢键, 表明疏水作用力和氢键对维持ICA与HSA的分子间作用有一定贡献。
同样, 图7显示ICA与HSA(II)分子间作用的10个构象以tolerance(RMS值公差)2.0进行聚类后得到ICA与HSA分子能量构象图。
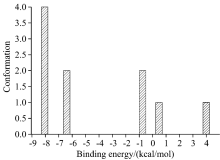 | 图7 ICA与HSA对接能量分布图(Sudlow’ s sites Ⅱ )Fig.7 The distribution map of ICA and HAS docking energy (Sudlow’ s sites Ⅱ ) |
依据以上与Sudlow’ s sites I相同的分析, 表4列出不同ICA构象与HSA结合主要贡献的能量。
| 表4 ICA与HSA分子对接的能量(Sudlow’ s sites Ⅱ ) Table 4 Energy of molecular docking between ICA and HSA (Sudlow’ s sites Ⅱ ) |
由图7、 表4可知, 在ICA与HSA(Ⅱ )实际对接的10个构象中, 得到5类聚类结果, 其中第1类总能量值最优, 聚类后有4个构象, 说明这4个ICA-HSA(Ⅱ )分子间作用模式有相同趋势的分子间作用力, 其次, ICA-HSA(Ⅱ )分子间作用力主要来自范德华力(Evdw)。 结合图6分析结果, 在ICA与HSA(Ⅱ )分子间作用过程中, 范德华力、 疏水作用力、 氢键为ICA与HSA分子间作用力的主要贡献。
由表3、 表4可知ICA与HSA分子间作用于活性位域Sudlow’ s sites Ⅰ 的最优对接模型的能量值为-7.11 kcal· mol-1(-29.72 kJ· mol-1), ICA与HSA分子间作用于活性位域Sudlow’ s sites II的最优对接模型的能量值为-8.05 kcal· mol-1(-33.65 kJ· mol-1), 两个位域的最优能量值的相对偏差为12%, 在合理的波动范围内, 说明ICA与HSA的物理模建结果合理。 根据光谱实验ICA与HSA分子间作用的理论模型结果, 分析比较得知, 双对数线性方程的自由能-29.75 kJ· mol-1与ICA-HSA体系在活性位域Sudlow site I的最优对接模型的能量值-7.11 kcal· mol-1(-29.72 kJ· mol-1)最为接近, 且ICA与HSA分子间作用的活性位域与n(1.10)相匹配, 则推断ICA是与HSA活性位域Sudlow’ s sites Ⅰ 发生分子间作用, 且双对数线性方程更符合ICA与HSA分子间作用模型。 物理模建结果也进一步验证了光谱实验。
采用光谱分析法在分子水平上系统研究ICA与HSA的分子间作用, 获取了荧光特征谱, 还建立了ICA与HSA分子间作用理论模型并进行了深入的比较分析。 结果表明, ICA与HSA分子间作用的荧光谱表明分子间作用力使HSA荧光峰值出现规律性的变迁趋势。 结合ICA与HSA物理模建结果比较分析不同分子间作用的理论模型, 说明在实验中选用理论模型描述分子间作用时, 应考虑其适用性前提和理论假设条件。 经过理论模型的比较, 认为双对数理论模型更符合ICA与HSA分子间作用体系。 光谱实验结果表明ICA与HSA的分子间作用位域是Sudlow’ s sites Ⅰ , 与物理模建结果保持一致, 说明ICA通过进入HSA的活性位域Sudlow’ s sites Ⅰ 附近的疏水腔发生了分子间作用, 且范德华力、 氢键和疏水作用力在ICA与HSA体系的分子间作用中起着关键作用。 上述工作对ICA与生物大分子的分子间作用的研究具有重要的意义, 对于研究黄酮苷类化合物与蛋白质分子间作用提供了有益参考。
致谢: 感谢浙江大学邹建卫教授提供的AutoDock4.02软件和Discovery Studio2.5软件条件的支持。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|