作者简介: 王慧泉, 1985年生, 天津工业大学电子与信息工程学院讲师 e-mail: huiquan@tjpu.edu.cn
基于近红外光谱法对组织内的异质体进行无创检测时, 光源-探测器(S-D)相对于异质体的位置对检测效果有着重要影响。 为实现对组织内异质体的快速定位, 该研究基于一源多探的检测结构针对不同水平位置、 不同深度和不同直径的异质体进行光密度分布有限元分析, 计算各探测器之间的差分光密度差异。 仿真实验结果表明, 根据多探测器形成的差分光密度差异曲线可快速定位组织内异质体的水平位置。 曲线的高斯拟合特征量与异质体的水平位置、 深度和直径有着强相关性。 基于差分光密度差异曲线可以实现组织内感兴趣区域的快速定位, 对采用近红外光谱法的组织肿瘤检测、 光学脑功能成像等领域的源-探位置放置提供重要参考, 提高其检测精度。
The position of the source-detector (S-D) relative to the anomaly had an important influence on the detection effect when the detection of the anomaly in tissues was non-invasive based on near-infrared spectroscopy. In this study, a Single-Source Multi-Detectors structure was designed in order to realize the rapid localization of anomaly within the organization. This method was for finite element analysis of optical density distribution for different horizontal positions, depths and diameters of anomaly. Then calculated the difference in optical density between the detectors. The simulation results showed that the horizontal position of the anomaly in the tissue could be quickly located according to the differential optical density difference curves formed by the multiple detectors. The Gaussian fitting feature of these curves has a strong correlation with the horizontal positions, depths and diameters of the anomaly. Through the differential optical density difference curves, rapid localization could be achieved within the region of interest in the organization. It provides an important reference for the sources and detectors location in terms of tumor detection, brain function optical imaging and other fields using near infrared spectroscopy, which can improve its detection accuracy.
近年来, 基于近红外光谱的组织成分检测方法因其快速、 无创等优势得到广泛关注, 已经运用于肿瘤检测[1]、 脑功能成像[2]和脑血肿检测[3]等多个方面, 并逐步进入临床使用。 基于多光源和多探测器的阵列方式并通过组织光学参数断层重建, 即扩散光学层析成像(diffuse optical tomography, DOT)的方法获得组织光学参数的三维分布, 从而实现对组织内肿瘤、 血红蛋白分布等情况的成像, 然而此方法计算量较大, 成像速度慢, 不适用于组织异质体快速检测的要求。 差分光密度(differential optical density, Δ OD), 即正常组织与目标组织之间的光密度差, 自Britton Chance[4]提出以来, 已在脑部肿瘤[5]、 组织内血红蛋白检测[6, 7]和脑血肿[8, 9]快速检测方面得到了充分应用, 效果良好。 然而, 准确的放置光源-探测器(Source-Detector, S-D)位置是有效检测目标异质体是否存在的关键环节[10]。 S-D分布与检测结果之间的关系一直以来也是本领域的研究热点, 准确的S-D分布可以有效提高近红外光谱法的组织检测精度[11]。
本研究采用一源多探(single-source multi-detectors, SS-MD)结构, 基于Nirfast光学有限元工具[12], 构建均匀组织内不同水平位置、 不同深度和不同直径的异质体模型, 计算多探测器上的差分光密度, 并绘制相邻探测器间的差分光密度差异(Δ OD')曲线。 采用高斯曲线拟合方法[13]对差分光密度差异曲线进行拟合, 得到其特征参数。 实验结果表明根据差分光密度差异曲线的特征参数判别可以实现均匀组织内异质体的快速定位, 为基于近红外光谱法检测组织内异质体提供最佳S-D位置放置的辅助参考, 其准确的S-D定位将有效改善近红外光谱法的检测效果。
图1所示为差分光密度差异曲线计算示意图, 其中S和S'为入射光源, D1, D2, …, Dn和D'1, D'2, …, D'n分别为等间隔的光电检测器。 在进行检测时, 分别在待检测组织位置和与其对应(光学参数相同)的无异质体组织位置进行检测, 分别得到n个探测器测得的光强记为I1, I2, …, In和I'1, I'2, …, I'n。 由式(1)和式(2)可得到每个位置的光密度分别为OD1, OD2, …, ODn, OD'1, OD'2, …, OD'n。
将对称位置的光密度相减, 计算差分光密度
再将相邻位置探测器得到的差分光密度进行相减, 即得到各点的差分光密度差异
将多探测器得到的Δ OD'依次连接, 即可得到差分光密度差异曲线。 此曲线可反映差分光密度值在不同S-D位置上的改变速率, 其特征可反映均匀组织内异质体的分布情况。
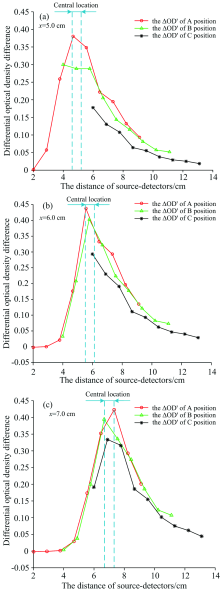
为研究差分光密度差异曲线的变化趋势与均匀组织内异质体的分布情况之间的关系, 基于Nirfast光学有限元工具, 建立了15 cm× 15 cm二维均匀组织模型, 其中μ a= 0.01 mm-1, μ 's=1 mm-1 [14]。 模型中分别设置了三种一源多探(SS-MD)分布来分别检测组织内异质体的位置, 同时比较本研究中不同SS-MD位置对异质体定位的影响, 如图2所示, A种SS-MD分布是将光源放置在原点, 将10个探测器等距离放置在距离原点2~10 cm处, B种SS-MD分布是基于第一种分布, 水平向右移动2 cm, C种SS-MD分布是基于第一种分布, 水平向右移动4 cm。
(1) 异质体的水平位置与Δ OD'的关系仿真模型及结果
异质体在深度相同的基础上, 改变异质体在水平方向的位置。 本实验采用单个异质体, 异质体仿真实验参数设定为直径为3 cm, 吸收系数μ a为0.5 mm-1, 散射系数μ 's为1 mm-1。 分别设置异质体的中心坐标点位置的横坐标x的值为4.0, 4.5, 5.0, 5.5, 6.0, 6.5, 7.0, 7.5和8.0 cm, 纵坐标y的值为-2.5 cm, 即深度为1.0 cm, 其他参数不变。 计算每个探测器测量到的Δ OD'值。 选择横向位置5.0, 6.0和7.0 cm为例, 图3(a), (b), (c)示出了三种SS-MD分布的光源与探测器的距离与Δ OD'的关系。
图3显示探测器的位置不同时测得的Δ OD'不同, 源探分布的位置不同时测得的Δ OD'不同, 并且其变化趋势明显。 这表示目标检测区域的Δ OD'值的敏感程度与光源与探测器之间的距离存在一定的关系。 曲线中Δ OD'最大的点表示差分光密度在该位置变化速率最大, 其对应的光源与探测器的距离可反映出异质体在横向位置的信息。
(2) 异质体的深度与Δ OD'的关系仿真模型及结果
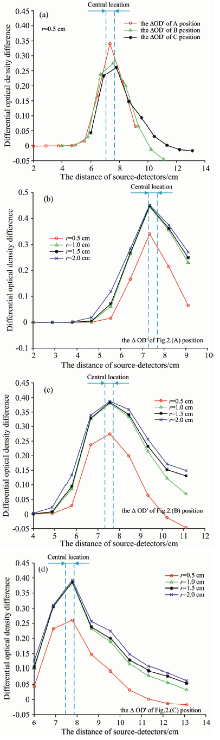
异质体在位置相同的基础上, 改变异质体的深度。 本实验异质体的仿真参数设定为直径为3 cm, μ a为0.5 mm-1, μ 's为1 mm-1。 异质体的中心点坐标位置在水平方向为距离原点6 cm, 针对光学脑功能成像应用, 成年人的平均头皮颅骨厚度通常为1.0~1.8 cm, 故在1.0~1.8 cm的范围内间隔0.1 cm改变异质体深度。 计算每个探测器测量到的Δ OD'值。 选择深度1.0, 1.2和1.4 cm为例, 图4(a), (b)和(c)示出了三种SS-MD分布的光源与探测器的距离与Δ OD'的关系。
图4显示异质体处于不同的深度测得的Δ OD'曲线, 且其变化趋势明显。 这表明目标检测区域的Δ OD'值对光源与探测器之间的距离敏感。 首先, 异质体在水平方向与原点的距离为6 cm, 图中曲线的Δ OD'的最大值也接近6 cm, 证实了实验(1)的结论。 同时图4显示异质体的深度不同时Δ OD'的值不同, 随着异质体的深度的增大, 对应Δ OD'的值降低。
(3) 异质体的大小与Δ OD'的关系仿真模型及结果
异质体在水平位置和深度相同的基础上, 改变异质体的大小。 本实验异质体的实验参数设定为异质体的中心点坐标位置在水平方向距离原点7.5 cm, 深度为1.0 cm, μ a为0.5 mm-1, μ 's为1 mm-1。 分别改变异质体的直径为1.0, 2.0, 3.0和4.0 cm, 计算每个探测器测量到的Δ OD'值。 图5示出了三种SS-MD分布的光源与探测器的距离与Δ OD'的关系。
图5(a)显示在异质体位于固定位置时不同的SS-MD分布测得Δ OD'的结果, 验证了实验(1)的结论。 图5(b), (c), (d)三幅曲线表示在同一种SS-MD分布情况下不同的异质体的大小与其对应的Δ OD'值的关系, 由图可知各个异质体Δ OD'的变化趋势的相似性很高, 并且随着异质体半径增大, 检测到的Δ OD'也增大。
在实验中获得的光谱曲线是由离散点组成的, 将这些离散点设为(xi, yi), 而曲线拟合的目的是找到变量x和y之间的函数关系y=f(x)。 假设高斯拟合中的原始光谱是通过多个单峰堆叠带形成的, 高斯函数系被视为光谱曲线的基本函数, 即将y=f(x)设置为高斯函数系, 其中每个高斯函数由三个参数确定: A是峰高, B是峰值位置, C是峰宽。 则高斯函数系可以写成
然而在实际拟合的过程中, 不需要拟合曲线y=f(x)通过所有的点(xi, yi), 只需根据一定的标准, 使各个点xi的拟合误差(δ =f(x)-yi)最小。 本研究使用最小二乘法求得最佳拟合曲线, 提取曲线峰值的位置信息作为曲线的特征参数, 并进行该特征参数的相关性分析。 本方法实现了原始光谱信息的提取和简化, 结果分析更为便捷。
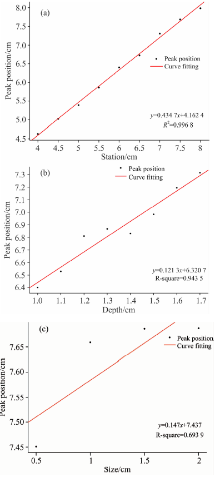
从仿真实验(1), (2), (3)获得含有异质体的位置和大小的Δ OD'的数据。 为了更清楚地观察这些离散点的变化规律, 采用高斯拟合的方法, 提取曲线拟合的特征峰值并进行相关性分析, 其结果如图6所示。
由图6(a)可知, 异质体在不同水平位置时测得的Δ OD'拟合曲线特征峰值具有良好的相关性99.68%。 随着异质体位置在自左向右移动的过程中, 当异质体位于SS-MD分布结构中间位置时, 曲线拟合的峰值更准确, 更接近于真实值; 当异质体位于SS-MD分布结构两侧位置时, 曲线的峰值在允许误差范围内变化。 由图6(b)可知, 异质体在不同深度时测得的Δ OD'拟合曲线的特征峰值具有良好的相关性94.35%。 随着异质体深度的增加, Δ OD'拟合曲线的峰值有增大的趋势, 且其Δ OD'的最大值仍可用于精确表示异质体的存在位置。 由图6(c)可知, 异质体在不同大小时测得的Δ OD'拟合曲线的特征峰值的大小保持在(7.5± 0.2) cm, 在允许误差范围内相关性在69%左右, 且随着异质体半径的增大, Δ OD'的拟合曲线的峰值有增大的趋势。
高斯拟合曲线的数据相关性表明, 高斯拟合的特征峰值可以作为判定是否含有异质体及其位置的依据, 快速提取数据曲线的主要特征, 能够大大简化原始数据。
提供了组织内异质体的快速定位方法。 通过使用不同的SS-MD分布结构来检测未知位置的组织内异质体, 分析源探距离和Δ OD'之间的关系并且分析Δ OD'曲线的变化趋势, 来确定异质体的位置。 结果表明, Δ OD'曲线的特征参数判别可以实现均匀组织内异质体的快速定位, Δ OD'可以表示系统对于异质体的灵敏度, Δ OD'的值越高, 系统的灵敏度越高。 因此, 本方法可以对肿瘤检测、 脑功能成像等源探位置的放置提供参考, 同时作为快速评估组织内是否含有异质体的有效辅助手段, 也可作为进一步指导临床应用的筛选工具。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|