作者简介: 张 晗, 1993年生, 华中农业大学理学院化学系硕士研究生 e-mail: 1312736870@qq.com
以轻质溶剂辛醇为萃取剂, 建立了分散液液微萃取-石墨炉原子吸收光谱分析法(LDS-DLLME-GFAAS), 并应用于生活用水中痕量Pb及Cd的测定。 在分散液液微萃取(DLLME)中, 以二乙基二硫代氨基甲酸盐(DDTC)为螯合剂, 用微量注射器将辛醇和甲醇的混合溶液快速注入到样品溶液中发生雾化分散现象, Pb2+和Cd2+与DDTC的络合物被萃取到辛醇微滴中。 离心分离后, 以GFAAS测定萃取至上层辛醇相中的分析物。 实验考察了萃取剂种类和体积、 分散剂种类和体积、 pH、 DDTC浓度、 萃取时间等影响萃取效率的实验参数。 在最优实验条件下, Pb和Cd的检出限分别为0.15和0.03 μg·L-1, 富集倍数分别为87和48, 具有良好的线性和精密度。 该分析方法优势在于操作简便, 快速, 低成本, 高富集倍数, 萃取剂用量少, 已成功应用于自来水、 饮用水和南湖水中痕量Pb和Cd的检测。
A simple and efficient method for the determination of Pb and Cd in domestic water and drinking water was developed by combining low-density solvent based dispersive liquid liquid microextraction (LDS-DLLME) with graphite furnace atomic absorption spectrometry (GFAAS). In the LDS-DLLME, a mixed solution of octanol (extraction solvent) and methanol (dispersive solvent) was rapidly injected into the sample solution by a microsyringe to form a cloudy emulsion. With diethyldithiocarbamate (DDTC) as chelating agent, Pb2+ and Cd2+ were extracted into the highly dispersed octanol microdroplets. The mixture was then centrifuged and the chelates of Pb and Cd moving into the organic phase, which was analyzed by GFAAS subsequently. In addition, the experimental conditions were investigated and optimized, such as the type and volume of extractant and dispersant, pH, DDTC concentration and extraction time. Under the optimal experimental conditions, the detection limits of Pb and Cd were 0.15 and 0.03 μg·L-1, and enrichment factors were 87 and 48, respectively, with good linearity and precision. This method has the advantages of simplicity, rapidity, low cost, and high enrichment. It is successfully applied to the determination of trace Pb and Cd in tap water, drinking water and South Lake water.
铅和镉是广泛分布于自然界中的有毒重金属元素, 可经食物链从环境转移至动物和人体内, 在较低浓度的情况下, 即能损害肾脏、 肝脏和肺[1]。 世界卫生组织建议人体每周按体重每千克最多摄入Pb和Cd分别应低于0.025和0.007 mg[2]。 由于Pb和Cd在生活用水和饮用水中含量一般非常低, 建立一个灵敏可靠的分析方法具有重要意义。
测定痕量Pb和Cd的常见分析方法有火焰原子吸收光谱(FAAS)[3]、 石墨炉原子吸收光谱(GFAAS)[4, 5]、 电感耦合等离子体质谱(ICP-MS)[6]、 原子荧光法[7]及电化学法[8]等。 其中, GFAAS操作简便, 成本低, 进样量小, 灵敏度高, 对大多数重金属的检出限可达pg级, 广泛应用于Pb和Cd的痕量分析。 然而, 在实际样品分析中, Pb和Cd含量一般非常低, 且易受基质影响, 往往需要进行适宜的萃取分离、 预富集前处理。
分散液液微萃取(DLLME)[9]是Rezaee等于2006年提出的一种微萃取技术, 具有操作简单、 快速、 成本低、 灵敏度高等突出优点。 传统DLLME一般采用密度比水大的含氯化合物为萃取剂, 如氯仿, 四氯乙烯[9], 四氯化碳[5]等, 以便于离心分层, 移除上层水相后, 再取下层有机相分析。 含氯化合物毒性较高, 污染环境。 本组提出以密度比水小的甲苯、 辛醇等为萃取剂的DLLME, 避免了含氯萃取剂的使用。 并且, 萃取分层后, 无需去除下层水相, 可直接取上层有机相进行后续分析, 操作更简便[10, 11]。 本工作基于轻质萃取剂的分散液液微萃取(LDS-DLLME)方法, 结合GFAAS, 用于生活用水中痕量Pb和Cd的测定研究。
甲醇、 乙醇、 乙腈、 丙酮、 辛醇、 四氯化碳、 甲苯、 十一醇、 盐酸(AR)、 硝酸(AR)、 氢氧化钠、 四水合硝酸镉、 硝酸铅购于国药集团化学试剂有限公司, 二乙基二硫代氨基甲酸钠(DDTC)购于阿拉丁试剂有限公司, 实验室超纯水(18.2 MΩ · cm)由Milli-Q超纯水机制得, 高纯氩(武汉市明辉气体科技有限公司)。
制备1 000 mg· L-1 Pb标准溶液和1 000 mg· L-1 Cd标准溶液长期储存备用。 混合工作标准溶液由超纯水稀释相应标准储备液得到, 每日现配现用。 配制溶液的玻璃器皿使用前用10%硝酸浸泡24 h, 然后用去离子水清洗数遍。 聚乙烯吸管及微型进样器均用超纯水和甲醇清洗数次。 实际水样自来水取自本实验室。 饮用纯净水、 矿泉水购于本地超市。 南湖水样(通过0.45 μ m滤膜处理)取自武汉市南湖。
ICE-3000石墨炉原子吸收光谱仪和Pb, Cd空心阴极灯(赛默飞世尔科技有限公司)的参数见表1; Mettler-Toledo AL204电子天平(梅特勒-托利多仪器有限公司); 漩涡混匀器(海门其林贝尔仪器制造有限公司); 1 mL微量进样器(上海高鸽工贸有限公司); 移液枪(Thermo Scientific); Anke TDL-40B台式高速离心机(上海安亭科学仪器厂); pH计(梅特勒-托利多仪器有限公司)。
| 表1 GFAAS工作参数 Table 1 The operating parameters of GFAAS |
在100 mL烧杯中配制1 ppb Pb和0.2 ppb Cd混合标准溶液, 并加入DDTC(0.2 g· L-1), 以0.5 mol· L-1 NaOH和0.5 mol· L-1 HCl将溶液pH调至8.0备用。 取7.5 mL该溶液于聚乙烯吸管中, 用1 mL微量注射器快速喷入75 μ L辛醇和300 μ L甲醇的混合溶液, 溶液立即雾化。 此时, 待测物被萃取到辛醇微滴中。 然后, 以3 000 r· min-1离心2 min, 溶液澄清分层, 用移液枪取10 μ L上层辛醇相作GFAAS测定。
对可能影响分散液-液微萃取的实验参数进行了优化, 如萃取剂种类和体积, 分散剂种类和体积, pH, DDTC浓度, 萃取时间等。
2.1.1 萃取剂种类和体积
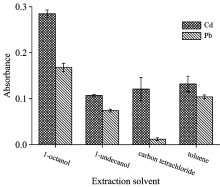
萃取剂种类是影响分散液液微萃取效率的关键因素之一。 实验考察了辛醇、 甲苯、 十一醇和四氯化碳的萃取效果, 结果如图1所示。 其中, 四氯化碳是常规DLLME常用的典型萃取剂, 密度大于水。 辛醇作为萃取剂时, Pb和Cd的信号达到最高。 所以, 本实验选取辛醇作为萃取剂, 不仅萃取性能更好, 同时避免使用含氯萃取剂。
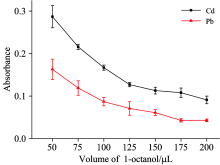
为了优化萃取剂体积, 实验考察了辛醇加入体积为50~200 μ L时的待测物信号。 如图2所示, 随着辛醇体积增加, Pb和Cd的信号均降低。 这说明当水相体积为7.5 mL时, 加入50 μ L辛醇即可实现萃取。 辛醇体积增大后, 析出相体积也增大, 分析物浓度下降。 但为使同一次萃取后的有机相体积可用于分别测定Pb和Cd两次, 则需要析出40 μ L以上的有机相。 因此, 选取辛醇加入体积为75 μ L。 此时, 离心后析出的上层有机相体积约为(50± 5) μ L, 而当辛醇加入体积为50 μ L, 离心后析出相体积则不足30 μ L。
2.1.2 分散剂种类和体积
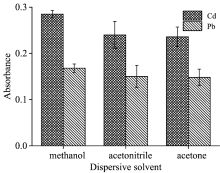
分散液-液微萃取技术中, 分散剂必须与萃取剂和水均互溶。 实验考察了甲醇、 乙腈、 丙酮对萃取效果的影响。 从图3可以看出, 甲醇作为分散剂时, Pb和Cd信号均最高。 所以, 实验选取甲醇为分散剂。
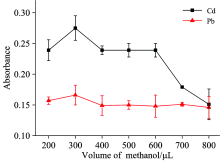
分散剂体积也和萃取效率有关, 为了优化分散剂体积, 实验考察了甲醇体积对萃取效果的影响。 如图4所示, 甲醇体积由200到300 μ L时, Pb和Cd信号均增强, 而当甲醇体积超过300 μ L, Pb和Cd信号均降低或持平。 原因可能是, 当甲醇体积较小时, 辛醇不能随甲醇一起均匀地分散于水相, 导致溶液雾化不完全, 影响萃取。 相反, 当甲醇体积过大时, Pb-DDTC和Cd-DDTC螯合物在水-甲醇溶液中的溶解度亦可能增加[5], 不利于萃取。 所以, 选取甲醇体积为300 μ L。
2.1.3 pH值
样品溶液pH是影响重金属离子与DDTC螯合反应的一个重要因素。 图5显示了pH对萃取效果的影响。 可以看出, 当pH=4~6时, 萃取效率几乎为0, 而pH=6~7时, Pb和Cd信号明显增强, pH=7~8时, Pb和Cd信号持平, pH高于8之后Pb和Cd信号均降低。 综合考虑选择样品溶液pH=8.0。
2.1.4 螯合剂浓度
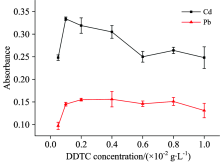
实验考察了DDTC浓啡对Pb和Cd萃取效果的影响, 结果如图6所示。 当DDTC浓度从0.000 5 g· L-1上升至0.002 g· L-1时, Pb信号明显增加, 而DDTC浓度继续上升时, Pb信号保持不变或略微减弱。 而对于Cd信号, DDTC浓度为0.001 g· L-1 时最高, 当DDTC浓度高于0.001 g· L-1时, Cd信号减弱或持平。 为了避免其他共存离子干扰, 最终选择DDTC浓度为0.002 g· L-1。
2.1.5 萃取时间
DLLME的萃取时间定义为从喷入辛醇和甲醇的混合溶液开始到离心分离两相之前的时间段。 实验考察了萃取时间(1~20 min)对萃取效果的影响。 实验结果表明, 1~2 min即可实现完全萃取。 这说明, DLLME达到萃取平衡的速度较快。 所以选定萃取时间为2 min。
从线性范围(linear range)、 相关系数(r)、 检出限(LOD)、 相对标准偏差(RSD)、 富集倍数(EF)等方面考察了本方法的分析性能。 从表2可知, 当水相中Pb和Cd的浓度分别在0.1~2.0和0.02~0.2 μ g· L-1范围时, 萃取后测定有机相所得标准曲线的线性良好。 Pb和Cd的检出限(3δ , n=10)分别为0.15和0.03 μ g· L-1, RSD分别为7.4%和4.8%。 样品体积为7.5 mL时, Pb和Cd的富集倍数分别为87和48。
| 表2 LDS-DLLME-GFAAS分析性能 Table 2 Characteristics of LDS-DLLME-GFAAS for Pb and Cd |
表3比较了LDS-DLLME与其他液相微萃取技术应用于GFAAS测定水样中Pb和Cd的分析性能。 可以看出, 本方法富集倍数较高, 萃取时间短。 以轻质溶剂辛醇为萃取剂, 避免应用含氯萃取剂, 使萃取过程更加绿色环保, 亦为DLLME萃取剂的选择拓宽了范围。
| 表3 GFAAS检测痕量Pb和Cd不同方法比较 Table 3 Comparison of microextraction techniques for the determination of Pb and Cd in water samples using GFAAS |
将建立的分析方法应用于实际水样中Pb和Cd的测定。 结果如表4所示, 所测试两个品种饮用水均未测出Pb和Cd, 不存在重金属Pb和Cd的污染风险。 两份自来水样品测得Pb为0.564和0.600 μ g· L-1, 其中一份测得Cd为0.093 μ g· L-1, 另一份未检出Cd, 均远低于国家生活饮用水卫生标准(Pb和Cd最高限值分别为0.01 mg· L-1和0.005 mg· L-1)[16]。 南湖水样品中Pb为0.182 μ g· L-1, Cd为0.316 μ g· L-1, 均低于国家地表水环境质量标准(Pb和Cd的最高限值分别为0.01和0.001 mg· L-1)[17]。 分别对实际水样进行标准加入回收实验, 本方法对实际水样中Pb的相对回收率在60%~103%之间, Cd的相对回收率在76%~117%之间, 平行3次萃取实验数据的相对标准偏差在0.5%~9.4%之间。 本方法对水样中Pb和Cd分析的加标回收率、 重现性均较好, 适合实际水样分析。
| 表4 水样中Pb和Cd的实测结果 Table 4 Experimental results of Pb and Cd in water samples |
建立了基于轻质萃取剂的分散液-液微萃取(LDS-DLLME)新方法, 并结合石墨炉原子吸收光谱法, 成功测定了生活用水中痕量Pb和Cd。 与传统DLLME相比, 本方法采用工业生产中常用的辛醇为萃取剂, 毒性较含氯溶剂小, 有效拓宽了DLLME萃取剂范围。 另外, 由于辛醇密度小于水, 在两相分离之后无需去除水相, 可直接取上层有机相进行后续分析, 操作更方便。 总之, LDS-DLLME操作简便, 快速, 成本低, 灵敏度高, 稳定性好, 绿色环保, 适用于生活用水中痕量重金属Pb和Cd的分析。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|