作者简介: 王金海, 1966年生, 天津工业大学教授 e-mail: wangjinhai@tjpu.edu.cn
近红外光密度差异法检测创伤性硬膜血肿具有快速、 无创等优点, 是近几年组织光学的研究热点, 在急救临床上有着重要应用。 为了进一步提高对颅脑外伤患者血肿程度的检测精度, 采用多通道差分吸光度方法获得头部左右对称吸光度数据, 即利用与近红外光源距离不同的5个检测器采集颅脑对称位置的光密度信息, 计算对称位置的差分吸光度, 利用偏最小二乘法建立脑部光学吸收系数与差分吸光度数据之间的校正模型, 实现对颅内硬膜血肿程度的预测。 可以检测具有不同头皮颅骨厚度患者是否出现硬膜血肿, 也可预测脑血肿程度。 模型仿真预测结果显示, 所建立预测模型对硬膜血肿部分的光学吸收系数预测平均相对误差为11.16%, 对血肿发生深度预测平均相对误差小于1%, 基本满足创伤性硬膜血肿程度的无创检测需求。 将多通道差分吸光度法引入到脑部血肿近红外光谱无创检测中来, 可以明显消除个体差异对检测结果的影响, 有效提高脑血肿检测精度, 并能实现对患者脑血肿程度的预测, 该方法为近红外光谱脑部检测研究提供了新的思路和重要参考。
Differential near infrared optical density has the advantages of rapid and noninvasive detection when detecting the traumatic subdural hematoma . This technology is a hot research topic in recent years, it has an important application in emergency treatment. To further improve the accuracy of traumatic subdural hematoma degree predication, the multi-channel differential absorbance method is used in this paper. We use 5 detectors that have different distance to the source to obtain absorbance data. In addition, we use partial least square method to establish the calibration model between the optical absorption coefficient of the brain and differential optical density. The model prediction results show that average relative error of absorption coefficient is 11.16%, and average relative error of hematoma depth is less than 1%. The model basically meets the demand of traumatic subdural hematoma degree predication. By introducing multi-channel differential optical density in the detection, it could eliminate the effects of individual differences and improve the accuracy of traumatic subdural hematoma degree predication. This method provides a new idea and an important reference for the brain detection with near infrared spectroscopy.
硬膜血肿多发于颅脑创伤之后, 无法及时准确的诊断并制定合理的诊疗方案, 会给患者带来不可逆脑损伤直至危及生命。 因此, 创伤性硬膜血肿的无创检测一直是生物医学工程领域的研究热点[1]。 传统影像(CT、 MRI等)方法虽然能够直观、 准确显示大脑组织的各部分情况, 但因为其检测设备大型且成本较高, 无法在脑外伤发生后及时、 快速的进行脑血肿判断。 650~900 nm的近红外波段是生物组织的光学窗口, 此波段光可以入射到脑部组织几厘米深度并由表面出射出来。 通过分析出射光信息可以获得被测脑组织的相关光学属性, 从而实现脑部疾病的快速、 无创的检测[2]。 因此, 近红外光谱技术已广泛运用于脑功能成像[3]、 脑部肿瘤成像[4]、 脑血流量检测[5]和脑血肿检测[6]临床应用中。
美国宾夕法尼亚大学的Britton Chance提出利用头部两个位置的光学对比度的变化来判断脑血肿是否发生[7], 即在同一个人头部选取两个位置, 分别采集并计算其吸光度, 并比较此两个检测位置的吸光度差异, 当吸光度差异为0.15和超过0.4时, 分别对应着脑皮质缺氧和脑血肿的发生。 Salonia和Bartomiej等对此方法进行了持续研究[8, 9]。 差分吸光度方法可以一定程度上消除个体差异对近红外光谱定量检测的影响, 然而, 若固定光源-检测器距离只能在其有效检测深度上获得最佳信息[10], 人体头部结构和光学参数的差异, 以及血肿等病变发生的位置不同, 均会对差分吸光度法在血肿检测上的应用带来误差, 且无法定量的判断脑血肿发生程度, 对临床上实施急救带来不便。
本工作提出多通道差分吸光度方法用于脑血肿程度的检测, 通过间隔一定距离的多通道传感器同时对感兴趣区域出射光信号进行采集分析, 计算头部对称位置的吸光度差异。 利用偏最小二乘法建立多通道差分吸光度与脑血肿发生位置吸收系数之间的定量校正方程, 最终实现了对颅内硬膜位置的吸收系数进行预测, 从而实现对血肿发生程度的判断。 仿真实验结果表明, 该方法可以实现对不同脑血肿深度、 不同脑部解剖结构下的脑血肿程度检测, 有效的克服了个体差异, 为基于近红外光谱的脑血肿程度快速检测方法进入临床应用提供了有力保障。
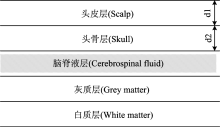
根据人颅脑解剖结构, 颅脑模型分为5层, 分别为头皮层、 颅骨层、 脑脊液层、 灰质层、 白质层(如图1所示)。
脑部结构及在840 nm波长下的光学参数如表1所示[11, 12]。 其中脑部参数定义如下: 折射率n、 吸收系数μ a(cm-1)、 散射系数μ s(cm-1)、 各向异性因子g、 组织厚度d(cm), 其中d1为头皮厚度, d2为颅骨厚度; 两者厚度随着受测者成长环境、 年龄、 种族、 性别等因素不同而具有不同大小, 总大小(d1+d2)通常在1.0~1.7 cm范围[13]。
| 表1 头部模型光学参数 Table 1 Brain model optical parameters |
临床上脑血肿分为硬膜下血肿、 硬膜外血肿、 脑内血肿、 蛛网膜下血肿。 颅脑外伤造成的血肿绝大多数为硬膜位置血肿[14], 位于头皮颅骨层下面的硬膜内外, 即发生在所建立颅脑模型的第三层脑脊液位置。 随着头皮颅骨厚度改变, 血肿位置也随之改变。 本研究主要针对这种血肿。 当创伤性颅脑血肿产生时, 颅脑组织吸收系数会明显增大, 临床研究表明, 血肿产生时吸收系数变化10倍以上, 正常硬膜位置吸收系数为0.05 cm-1。
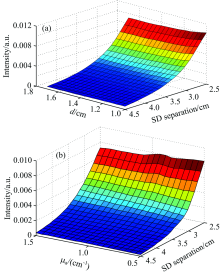
光子传播仿真程序基于Wang Lihong教授的Monte Carlo程序进行优化和修改, 对光源径向散射出的光子数及其各层传播轨迹进行记录[15]。 仿真光子数为108个, 仿真波长为840 nm, 头皮颅骨层厚分别设置为1.0~1.7 cm, 间隔0.1 cm, 硬膜位置μ a分别设置为0.5~1.5 cm-1, 间隔0.1 cm-1时, 由MC共获得88个光源径向光强分布数据, 如图2所示。 图2(a)所示为头皮颅骨厚度范围1.0~1.7 cm, 硬膜位置μ a为0.05cm-1, 与光源距离不同的各个检测器获得的光强分布。 图2(b)所示为头皮颅骨厚度1.3 cm时, 硬膜位置吸收系数为0.5~1.5 cm-1, 距离光源距离不同的各个检测器获得的光强分布。 针对不同个体差异, 固定距离传感器获得的光强分布有着明显区别, 靠单独固定位置的检测器会造成较大的检测误差。
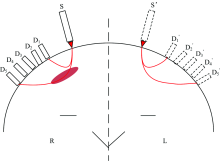
图3所示为多通道差分吸光度法脑部血肿检测的示意图。 其中S和S'为入射光源, D1— D5和D'1— D'5分别为等间隔的光电检测器, 分布在头部对称位置。 检测时, 首先在头部右侧(R侧)进行一次检测, 5个传感器得到的光强分别为I1— I5; 然后在头部左侧(L侧)进行检测, 5个传感器分别获得的光强为I'1— I'5。 I0为左右两侧入射的光强。 由式(1)和式(2)可得到每个位置的吸光度分别为OD1— OD5, OD'1— OD'5。
将左右对称位置的吸光度相除, 得到差分吸光度
根据头部左右对称位置的吸光度差异可以获得脑内部血肿程度信息, 将多个位置的差分吸光度联立建立模型, 可以有效提高脑血肿的检测精度。
偏最小二乘法回归(partial least squares method, PLS)具有较强的抗干扰能力, 通过降低模型维度来有效消除噪声并提取有用信息。 PLS模型对信息进行综合, 使其具有小样本的强回归能力和抗自变量多重线性干扰能力。 本研究获得的88个数据样本为原始数据, 分别在2.5, 3.0, 3.5, 4.0和4.5 cm这五个光源径向位置设置检测器, 并分别加入1 000:1信噪比的高斯白噪声以仿真真实采集数据情况。 基于PLS建立五个传感器位置的光强分布、 差分吸光度与硬膜位置μ a和头皮颅骨厚度d之间的校正模型, 随机抽取72个为建模集样本, 其余16个为预测集样本。 采用逐一剔除的交叉验证方法, 估算分量总数为10, 不同分量数相关度R-Sq分布如图4所示, 可以看出头皮颅骨厚度d预测模型和硬膜位置μ a预测模型均为当分量数为5时, 模型相关度R-Sq达到最佳, 因此, 两预测模型的分量数设置为5。
如图5所示为PLS模型对头皮颅骨厚度d的建模预测结果, 其中建模集预测相关度为99.65%, 平均误差为0.010 8 cm, 最大误差为0.031 8 cm; 预测集预测相关度为99.65%, 平均误差为0.011 5 cm, 最大误差为0.027 7 cm。 如图6所示为PLS模型对硬膜位置μ a的建模预测结果, 其中建模集预测相关度为88.94%, 平均误差为0.083 8 cm-1, 最大误差为0.259 3 cm-1; 预测集预测相关度为86.65%, 平均误差为0.104 7 cm-1, 最大误差为0.299 0 cm-1。
 | 图5 (a)建模集预测结果; (b)预测集预测结果Fig.5 (a)Prediction results of model set; (b) Prediction results of prediction set |
 | 图6 (a)建模集预测结果; (b)预测集预测结果Fig.6 (a)Prediction results of model set; (b)Prediction results of prediction set |
将差分多通道差分吸光度信息和光强分布信息同时引入到硬膜位置μ a的建模当中, 有效的利用了多维数据和消除了个体差异, 建模集和预测集的预测精度和与真实值之间的相关程度满足临床快速、 无创创伤性硬膜血肿的检测精度, 为基于近红外光谱法的脑血肿快速检测迈向临床应用提供了基础。
颅骨厚度可以反映发生血肿的深度, 硬膜位置μ a值的不同体现了创伤性硬膜血肿程度的不同, 利用多通道近红外光差分吸光度以及光强分布, 对头皮颅骨厚度以及硬膜位置μ a进行建模分析, 预测结果精度较高, 基本满足对患者创伤性脑血肿情况进行快速准确的需要。 该模型可以对不同头皮颅骨厚度创伤性硬膜血肿厚度患者进行检测, 具有很好的适用性, 为创伤性硬膜血肿的快速检测和程度预测提供了新的重要参考。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|