作者简介: 林 茜, 女, 1991年生, 南华大学公共卫生学院硕士研究生 e-mail: lin1044@163.com
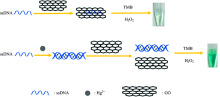
基于富T碱基序列能特异性识别Hg2+、 氧化石墨烯(GO)对单链DNA(ssDNA)和T-Hg2+-T复合物的亲和力不同以及GO自身具有的模拟酶催化性能, 构建了一种可视化检测水样中痕量Hg2+的新方法。 在pH 4.0的NaAc-HAc缓冲溶液中, 通过π—π堆积作用力, ssDNA可以吸附在GO表面, 致使GO的类过氧化物酶活性减弱, 从而催化H2O2氧化3,3’,5,5’-四甲基联苯胺(TMB)产生的蓝色产物减少, 体系位于波长652 nm处的吸光度值降低; 当待测体系中存在Hg2+时, ssDNA上的胸腺嘧啶碱基(T)与Hg2+发生特异性结合作用, 形成T-Hg2+-T类似双链结构的稳定复合物, 该复合物与GO的作用力较弱, 不易吸附于其表面, 因此不影响GO的模拟酶活性, 体系吸光度值增强。 在一定条件下Hg2+浓度越大, 覆盖在GO表面的ssDNA越少, 体系吸光度越强, 据此建立检测Hg2+的新方法。 当汞离子浓度在3.26×10-8~9.0×10-7 mol·L-1范围内时, 体系的Δ A值与汞离子浓度呈现良好的线性关系。 其线性方程为Δ A=41.75 c(nmol·L-1)+0.048 7, 相关系数 r=0.997 3, 检出限为9.79×10-9mol·L-1。 该方法简单、 直观, 抗干扰能力强、 无需昂贵仪器设备, 可用于检测环境水样中Hg2+的含量。
A new method for visual detection of trace Hg2+ ions was successfully established based on the single-stranded DNA (ssDNA) and T-Hg2+-T complex have different interaction with graphene oxide(GO), which owns mimetic enzyme catalytic performance. In NaAc-HAc buffer of pH 4.0, ssDNA can be adsorbed on the GO surface, which will efficiently decrease the peroxidase-like activity of GO to catalyze the oxidation of peroxidase substrate TMB to form blue product in the presence of H2O2, which presented a characteristic absorbance at 652 nm. When Hg2+ ions exist, the ssDNA formed double-stranded DNA via thymine-Hg2+-thymine complex coordination structure, which hardly absorbed on the surface of GO for the interactionbetween dsDNA and GO is much weaker, the peroxidase mimetic activity of GO is not affected, accompanying with the color darkening and increase of absorbance at 652 nm. Under the optimal conditions, the absorbance versus Hg2+ concentration is linear in the range from 3.26×10-8 to 9.0×10-7 mol·L-1, which can make a calibration graph. The regression equation is Δ A=41.75 c(nmol·L-1)+0.048 7, r=0.997 3. The limit of detection is 9.79×10-9 mol·L-1. This method has the advantages of simplicity, cost saving and good specificity, thus can be applied for determinating mercury ion in the environment samples.
汞是一种在常温下唯一呈液态的金属元素, 分布范围广, 存在于空气、 土壤、 水等生态环境中[1, 2], 可经多种途径进入人体, 扰乱机体多方面的生理和生化功能, 对人体健康危害极大。 因此环境中汞含量已被列为重点监测项目[3, 4, 5]。
目前, 国内外检测Hg2+的方法很多, 主要有冷原子吸收光谱法[6]、 原子发射光谱法[7]、 原子荧光光谱法[8]、 电感耦合等离子体质谱法[9]、 生物传感[10]等。 这些方法各具优点, 但也存在如一些仪器昂贵, 操作繁琐等不足。 因此建立简单、 快速、 灵敏度高的检测新方法具有重要的研究意义。
研究表明, 氧化石墨烯(GO)具有过氧化物酶活性[11, 12], 能催化过氧化氢氧化底物3, 3’ , 5, 5’ -四甲基联苯胺(TMB)生成蓝色的自由基产物。 另外, 研究还发现氧化石墨稀与单链具有较强的结合力, 而与双链或适配体/分子复合物的结合力较弱[13]。 在此基础上设计一条能与Hg2+离子特异性结合的ssDNA(T12), 利用GO表面对ssDNA和T-Hg2+-T复合物不同的亲和力以及GO自身具有过氧化物模拟酶的性能, 建立了一种新的水样中痕量Hg2+的可视化分析检测新方法。 目前基于DNA-GO的荧光[14]、 电化学[15]检测方法比较多, 但基于GO自身催化活性的DNA生物传感检测方法尚未见报道。
UV2550型紫外-可见分光光度计(日本岛津), 电子分析天平(梅特勒-托利多), PB-20型精密酸度计(德国塞多利斯), ssDNA(大连宝生物公司)序列, 氧化石墨烯(GO), NaAc-HAc缓冲溶液, H2O2溶液, TMB溶液, 氯化汞等。 所用试剂均为分析纯, 实验用水为超纯水, 电阻18.3 MΩ · cm。
在2 mL EP管中, 依次加入一定量NaAc-HAc缓冲溶液、 15 μ L 3.0× 10-6 mol· L-1 ssDNA溶液和不同量的1.0× 10-6 mol· L-1 Hg2+标准溶液, 室温放置10 min。 向上述混合液中加入40 μ L 0.10 mg· mL-1氧化石墨烯, 混匀, 室温放置5 min后, 加入35 μ L 1.0× 10-2 mol· L-1 TMB溶液和20 μ L 1.0 mol· L-1 H2O2, 控制溶液的总体积为500 μ L。 在30 ℃的电热恒温水浴箱中反应30 min, 同时做试剂空白。 用紫外-可见分光光度计扫描, 得到紫外可见吸收光谱。 在最大吸收波长652 nm处, 测定体系吸光度A和试剂空白A0, Δ A=A-A0。
Hg2+的检测原理如图1所示, 在pH 4.0的NaAc-HAc缓冲溶液中, 具有类过氧化物酶活性的GO催化H2O2氧化TMB生成蓝色的双偶氮联苯胺类产物, 该蓝色产物在652 nm处有最大吸收。 当溶液中存在富T碱基的ssDNA时, 通过π — π 堆积作用, ssDNA可吸附在GO表面, 减弱了GO的类过氧化物酶催化活性, 体系吸光度值降低。 由于碱基数量的变化会影响ssDNA与GO的结合力, 并且碱基数量越少结合力越弱, 为了降低空白的本底值, 我们选择了一条由12个T碱基构成的寡核苷酸序列作为Hg2+的特异性识别探针。 当体系中存在Hg2+时, 由于π — π 堆积作用力远远小于T-Hg2+-T的结合力, 富T碱基的ssDNA探针基于T-Hg2+-T的结合力形成双链结构的稳定复合物, 不易吸附于氧化石墨烯表面, 氧化石墨烯的类过氧化物酶活性不受影响, 体系吸光度值A显著增大。 在一定的条件下Hg2+浓度越大, 覆盖在GO表面的ssDNA越少, 体系吸光度越强, 据此建立检测Hg2+的可视化分析新方法。
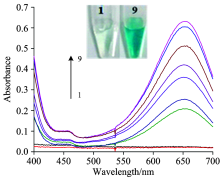
图2为体系的紫外-可见吸收光谱图。 由图2可见, 体系H2O2-TMB(曲线1)和体系H2O2-TMB-ssDNA(曲线2)在波长400~700 nm范围的吸收值非常低, 在652 nm的吸收峰不明显, 显色反应如插图中的1所示, 没有观察到明显蓝色。 在GO-H2O2-TMB体系中, 吸光度值显著增强, 652 nm处有最大吸收峰(曲线9), 肉眼可见明显蓝色(插图中9), 由此可见GO对H2O2-TMB的氧化还原反应有显著催化作用。 当体系中加入富T ssDNA后, 由于ssDNA通过π — π 堆积作用吸附在GO表面, 减弱了GO的过氧化物模拟酶催化活性, ssDNA-GO-H2O2-TMB体系在652 nm处吸光度值(曲线3)比GO-H2O2-TMB体系(曲线9)明显降低, 证明我们的实验原理正确, 与实验现象相符。 而当向ssDNA-GO-H2O2-TMB体系中加入Hg2+后, 体系在652 nm处的吸光度值得到恢复, 如(曲线4)所示, 并且吸光度值随着Hg2+的加入量的增加而增大(见曲线4— 曲线8)。 再次证明了我们的检测原理正确。
2.3.1 缓冲体系及pH的影响
实验分别研究了磷酸盐缓冲溶液, HEPES缓冲溶液, NaAc-HAc缓冲溶液对反应体系吸光度的影响, 结果表明在磷酸盐缓冲溶液和HEPES缓冲溶液中, 反应的稳定性、 灵敏度均低于NaAc-HAc缓冲溶液, 故采用NaAc-HAc作为缓冲体系。 进一步试验了pH对体系的影响, 在pH 2.0~7.0的范围内考查了pH值的影响(如图3所示), 结果表明, 当pH为4.0时, 体系的Δ A最大, 且比较稳定。 pH过高或过低均影响GO的催化活性, 不利于反应的发生, 显色反应不稳定或不明显, 故实验采用pH 4.0的NaAc-HAc缓冲溶液来控制体系的酸度。
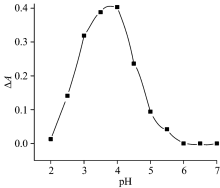 | 图3 pH值对体系的影响Fig.3 Effect of pH on the Δ A of system cGO=8.0 μ g· mL-1; cssDNA=9.0× 10-8 mol· L-1; |
2.3.2 GO浓度的影响
分别探讨了不同浓度的GO对体系Δ A的影响, 实验结果表明当GO浓度在2.0~8.0 μ g· mL-1范围时, 随着GO的浓度增加, Δ A值也逐渐增大, 当GO的用量达到8.0 μ g· mL-1, Δ A最大且稳定, 在此基础上继续增加GO用量, 体系本底值也相应增加, Δ A反而降低。 实验选择GO的浓度为8.0 μ g· mL-1。
2.3.3 ssDNA长度和浓度的影响
由于GO对不同长度的ssDNA具有不同的作用力, 我们对比了不同长度的汞特异性ssDNA探针对GO的催化活性的影响。 实验结果表明, 随着ssDNA探针碱基数目的增加ssDNA-GO-H2O2-TMB体系的吸光度值逐渐减小。 当ssDNA只有5个碱基时, 吸光度值的下降率为35%, 当ssDNA有8个碱基时, 吸光度值的下降率为50%, 当ssDNA有12个碱基时, 吸光度值的下降率为75%, 当ssDNA有15个碱基时, 吸光度值的下降率为80%。 考虑到ssDNA含T碱基过多会影响Hg2+检测的灵敏度, 因此实验选择ssDNA的长度为12个T碱基。
实验对ssDNA浓度进行了优化, 发现体系ssDNA-GO-H2O2-TMB的吸光度值随ssDNA浓度的增加逐渐减低。 当ssDNA浓度为9.0× 10-8 mol· L-1, GO浓度为8.0 μ g· mL-1时, 体系的吸光度值降低程度减慢, 逐渐平稳, 表明此时ssDNA对GO的吸附反应已达平衡。 因此实验选择ssDNA浓度为9.0× 10-8 mol· L-1。
2.3.4 H2O2浓度和TMB浓度的影响
实验发现H2O2浓度在5.0× 10-3~4.0× 10-2 mol· L-1时, Δ A值迅速增加; H2O2浓度在4.0× 10-2 mol· L-1时, Δ A值为最大, 若继续增大H2O2的浓度, Δ A值反而降低, 推测可能是因为过量的H2O2抑制GO的催化活性, 导致Δ A值下降。 故选择H2O2浓度为4.0× 10-2 mol· L-1。
按照实验方法, 对TMB浓度影响进行了研究, 结果显示, 当TMB浓度在1.0× 10-4~7.0× 10-4 mol· L-1时, Δ A值一直随着TMB浓度的增加而增大, Δ A值增加幅度较大。 当浓度在大于7.0× 10-4 mol· L-1之后, Δ A值增加幅度较小, 说明此时化学反应趋于平衡, 过量的TMB不能被H2O2全部氧化, 因此体系的吸光度值没有明显变化。
2.3.5 温度和反应时间的影响
在20~60 ℃的范围内进行了温度对反应体系影响的研究, 发现当温度在30~40 ℃时, 反应进行快, 体系Δ A最大且比较稳定。 温度过低, GO的类过氧化物酶活性较低, 使得催化H2O2氧化TMB的时间过长, 显色慢; 温度过高, 大于50 ℃时, 体系反应快, 显色快, 褪色也很快, 且Δ A不稳定, 实验采用30 ℃进行。
在30 ℃的条件下进行了反应时间的考察, 结果表明当反应进行30 min后, 体系显色反应达到平衡, 体系Δ A较大波动小, 稳定2 h不褪色。
在最佳实验条件下, 根据实际情况, 考察了多种干扰离子的影响,
在最适实验条件下, 按1.2实验方法分别测定不同浓度汞离子标准溶液, 实验结果表明, 汞离子的摩尔浓度范围为3.26× 10-8~9.0× 10-7 mol· L-1时, Δ A与浓度呈现较好的线性关系, 线性回归方程为Δ A=41.75c(nmol· L-1)+0.048 7, 相关系数r=0.997 3。 经11次空白平行测定, 按照cL=3Sb/k, 计算出汞离子的检出限为9.79× 10-9 mol· L-1, 相对标准偏差为0.91%, 实验结果充分表明本方法具有较好的精密度。
采集了南华大学校内荷花池水样, 衡阳市湘江水样以及公共卫生学院实验室自来水样, 分别记为水样1, 水样2, 水样3, 煮沸过滤后置于10 mL比色管中备用。 分别采用本方法及原子荧光法(国标法)检测水样, 均未检出汞离子。 分别将1.0× 10-7, 4.0× 10-7和8.0× 10-7 mol· L-1的汞离子加入水样中, 用本方法测定加标回收率, 每份样品平行测定7次结果如表1所示。
| 表1 本方法检测水样中Hg2+的结果(n=7) Table 1 Result of Hg2+ in the water samples detected by this proposed method (n=7) |
根据富T碱基的ssDNA能特异性识别Hg2+并与Hg2+结合形成T-Hg2+-T复合物、 GO表面对ssDNA、 T-Hg2+-T复合物亲和力的差异性以及GO自身的过氧化物模拟酶活性催化过氧化氢氧化底物TMB生成蓝色产物的特性, 建立了一种可视化检测水样中痕量Hg2+的新方法。 该方法基于T-Hg2+-T的高度特异性结合作用, 提高了方法的准确度, 将Hg2+的检测转化为催化显色反应, 操作简便、 快速, 对仪器要求不高, 有较大的开发应用潜能。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|