作者简介: 陈 伟, 女, 1987年生, 山西师范大学地理科学学院讲师 e-mail: wan_xin_chen@126.com
土壤纤维素酶参与土壤中养分的循环过程, 分解纤维素为小分子糖分微生物生命活动提供能源物质, 并且对生态系统有重要的指示作用。 如何快速、 精确的测定纤维素酶活性对土壤生态系统诊断、 恢复等有重要指示意义。 自然界中不同的氮肥处理及种植不同的苦荞品种均会对土壤纤维素酶活性产生影响。 利用德国进口全自动进样酶标仪(InfiniteR 200 PRO), 以4-Methylumbelliferyl β-D-cellobiopyranoside (Cel) 纤维素荧光物质为底物, 将不同耐瘠性苦荞(迪庆苦荞-耐低氮; 黑丰1号-不耐低氮)根际土壤以悬液形式用排枪吸取微量和荧光底物混合加入到96孔微孔板进行充分反映、 培养测定土壤中纤维素酶活性, 其中将对照板和样品放在同一个板块上, 减少培养空间占用和操作时间。 结果表明, 除了苦荞成熟期的常氮处理, 苗期和开花期的低氮处理条件下, 纤维素酶活性均表现为迪庆苦荞根际土壤显著高于黑丰1号, 迪庆根际纤维素酶活性在苗期低氮处理下高于黑丰39.50%; 纤维素酶活性在迪庆苦荞的开花期和成熟期氮处理间有显著性差异, 表现为常氮高于其他处理, 而黑丰1号仅在开花期时常氮处理和其他处理之间有显著差异; 灭菌处理酶活性显著低于常氮处理的54.29%, 说明迪庆苦荞根际纤维素酶一部分来源于微生物的贡献, 养分充足时微生物的活性更高, 贡献越大。 荧光光谱法分析出的纤维素酶活性表明耐瘠性品种迪庆苦荞可以通过增加根际土壤酶活性的方法来抵抗外界环境的胁迫, 面对黄土高原养分贫瘠的土壤, 可以考虑选种耐贫瘠的品种来降低成本增加收益。 试验过程中, 荧光标记的酶标仪测定方法与传统的测定方法相比更加快捷、 准确和节约, 同样适合大批量样品测定, 可以为未来精准农业生产, 测土配方施肥提供及时的数据支持。
Cellulasel plays an very important role in the ecosystem and the nutrient cycling. It can decomposite cellulose to small molecules of sugar and provide energy for biological activities. How to measure cellulase activity quickly and accurately is of great significance for the diagnosis and restoration for soil ecosystem. Different nitrogen treatments and cultivate would influenced enzyme activity. This study use automatic TECAN Infinite 200 Multi-Mode Microplate Reader (made in Germany) bombined with 96 microplates and fluorescence (4-Methylumbelliferyl β-D-cellobiopyranoside (Cel)) detection method to detect the activity of cellulasel under different tartary buckwheat (DiQing-low nitrogen toleration, HeiFeng 1-low nitrogen intoleration). During the process, the experiment use less substrate and put the control and sample together in the same plat,then reduced the culture space and operation time. The results showed that except the normal nitrogen treatment under the maturation stage, cellulasel was higher in DiQing than in HeiFeng 1 in the stage of seeding and flowering. In addition, the activity of cellulase in root trace of Diqing was higher than that of Heifeng 39.50% under low nitrogen treatment at seedling stage. Cellulasel had a significant difference among nitrogen treatments in the flowering and maturation stage, much higher activity in normal treatment when compared with the others under DiQing, but Heifeng only showed the same trend in flowering stage. The enzymatic activity of sterilizing treatment was significantly lower than that of normal nitrogen treatment of 54.29%, which indicated that some of cellulase in root trace of Diqing Tartary buckwheat originated from the contribution of microorganism, and the activity of microorganism was higher when the nutrient was sufficient. The analysis of cellulase activity by fluorescence spectrum showed that the resistant variety Diqing Tartary buckwheat could resist the stress of external environment by increasing the activity of soil enzyme in root trace. While in the poor nutrient soil in Loess Plateau, maybe selecting barren-tolerant varieties would reduce costs and increase the benefits for farmers. Compared with traditional method, fluorescence microplate fluorescence microplate method is quick, accurate and economical. It is also suitable for mass sample determination, which can provide timely data support for foreign precision agriculture production and soil testing formula fertilization in the further.
土壤酶可以来源于微生物、 动植物残体及其代谢过程, 种类多, 数量大, 活性因土壤质地和作物种类不同而有很大差异[1, 2]。 实验室常用的酶测定方法为紫外分光光度法, 但是测定步骤繁琐, 时间较长, 且灵敏度较低, 土壤中胶体含量较多时容易引起产物的吸附, 以及有机质所伴有的杂质对显色过程的干扰。 荧光分析方法是20世纪90年代开始应用, 原理是用荧光标记底物, 通过荧光显示的强弱来反应酶活性的高低。 相比于传统方法来说具有培养时间短, 灵敏度高的优势, 药品用量少, 试样量少, 操作简单, 成本较低[3]。 因此荧光分析技术被广泛应用于临床检验、 微生物学研究、 食品科学和农业科学等领域。 应用96孔微孔板加入微量的土壤悬浊液和荧光物质, 配合适当的试剂, 同时可以测定多种酶活性并且增加了重复率, 提高了试验的精确性。 目前应用酶标仪测定土壤纤维素酶的荧光技术还鲜有报道。
“ 缺氮、 少磷、 钾充足” 是黄土高原瘠薄地区土壤养分含量的共同特点。 苦荞被广泛种植在黄土高原生态环境较严酷的地区, 是中西部经济相对落后地区的主要粮食作物、 经济作物和避灾救荒作物, 有着其他大宗作物无法替代的区位优势。 作物品种间对养分的吸收存在差异性, 苦荞遭遇养分胁迫时, 根系分泌物的成分和数量会发生急剧变化来适应环境。 土壤中因为凋落物的归还等各种原因而含有大量的纤维素, 纤维素可以在酶催化下最终生成葡萄糖, 纤维素酶活性强可以增加土壤中碳源, 从而间接的增加微生物活性来提高土壤速效养分的有效性。 土壤中酶活性的高低可能与苦荞的耐低氮特点有一定的相关性。
本实验以黄土高原典型黄土为供试土壤, 设计不同的氮肥处理盆栽控制实验, 采用耐低氮有差异的苦荞品种为研究对象。 应用96孔微孔板, 以荧光物质作为酶的反应底物, 用全自动进样酶标仪测定土壤纤维素酶活性, 以期回答不同耐瘠性苦荞对土壤低氮胁迫的响应机制是否与酶调控有关。
本实验于2017年5月以典型黄土为基质开展盆栽试验, 种植不同苦荞品种“ 迪庆苦荞” (耐低氮)0和“ 黑丰1号” (不耐低氮)[4]。 试验设置为对照1(CK1, 不施肥)对照2(CK2, 不施氮肥)、 低氮处理[N1, 0.8 g· (10 kg)-1]和正常供氮[N2, 1.6 g· (10 kg)-1], 灭菌处理(每天浇1 mol· L-1 O3水400 mL)。 每个处理均重复4次。 氮肥为尿素(含氮量46.4%), 其中磷肥(P2O5, 150 mg· kg-1)和钾肥(K2O, 60 mg· kg-1)均作为底肥使用。
分别于30, 60和90 d采土样, 作为幼苗期(S, Seeding stage)、 开花期(F, Flowering stage)与成熟期(M, Maturation stage)的土样。 采样时, 将植株连根挖出, 采用抖土法收集根际土, 采集距离根系5 cm左右的厚层土作为根区土。 4 ℃冰箱贮存, 用于测定纤维素酶活性。
主要仪器: 多功能酶标仪(InfiniteR 200 PRO)(TECAN公司); 八通道进液器(德国Eppendorf公司)。 其余仪器均为实验室常规仪器。
试剂(分析纯): 酶底物(4-Methylumbelliferyl β -D-cellobiopyranoside (Cel), C22H28O13, 分子量500.05, 200 μ mol· L-1)、 柠檬酸(C6H8O7)、 乙酸钠(C2H3O2Na)、 叠氮化钠(NaN3)、 氢氧化钠(NaOH)、 顺丁烯二酸(C4H4O4)、 硼酸(H3BO4)、 三羟甲基氨基甲烷(NH2C(CH2OH)3)、 甲基纤维素(CH3OCH2CH2OH)、 钠盐(C10H7O3Na)、 甲基伞形酮(C11H10O3)。
纤维素酶活性的测定: 2.00 g鲜土放入1 L烧杯中, 向烧杯中加入1 mmol· L-1叠氮化钠溶液, 搅拌15 min, 制备土壤悬液, 用移液枪吸取50 μ L土壤悬液加入到微孔板, 培养箱30 ℃培养2 h, 培养结束后取出迅速加入终止剂0.5 mol· L-1 NaOH, 对照和样品微孔板试剂添加量见表1。
| 表1 对照和样品微孔板试剂和样品用量 Table 1 Control and sample plate of solution in each well |
使用SPSS 16.0软件数理统计, 用Duncan’ s对不同处理间进行多重比较来判断差异显著性(p< 0.05), 用Origin 8.0作图。
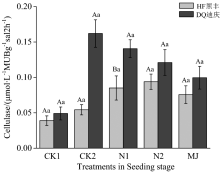
图1显示苦荞在苗期时不同的氮肥处理并没有对根际土壤纤维素酶产生影响, 但是在低氮处理时, 迪庆根际酶活性显著高于黑丰39.50%(p< 0.05)。
可能是在低氮胁迫下, 耐低氮苦荞通过纤维素酶的活性来增加土壤中碳的含量, 促使微生物的活性增加, 来释放出更多的养分元素。 苗期对养分的需求不算巨大, 所以数据并没有检测出大的差异性。
图2显示苦荞在开花时期不同的氮肥处理对纤维素酶活性产生了影响。 其中常氮处理的两个品种纤维素酶活性显著高于其他处理(p< 0.05)。 低氮处理条件下, 耐瘠性强的迪庆根际纤维素酶活性显著高于黑丰1号(p< 0.05)。
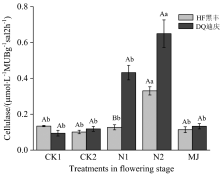 | 图2 苦荞开花期根际土壤纤维素酶活性Fig.2 Cellulase activity in rhizospheric of different tartary buckwheat at flowering stage |
作物开花期, 会加快养分的消耗。 有研究结果显示苦荞整个生育期N:P:K的比例保持在1:0.36~0.45:1.76。 添加适量外源纤维素酶, 可以增加土壤中脲酶、 蔗糖酶、 SOD和碱性磷酸酶的活性, 可以增加蒸腾速率, 增加胞间CO2浓度, 从而增加植物的光合作用[5]。 孙锋等[6]发现在棕黄砂质土壤中施氮肥会增强纤维素酶活性, 纤维素水解加快促进了养分循环的速度, 这与我们的研究结果相一致。 在低氮处理下, 耐瘠性苦荞品种可以通过自身的调节作用, 通过调控纤维素酶的活性来满足自身的养分需求。
图3显示成熟期时不同的氮处理只对耐瘠性较强的迪庆苦荞根际土壤纤维素酶产生了影响, 常氮处理和2组对照及灭菌处理之间差异显著(p< 0.05), 低氮处理和不施肥的对照处理差异显著(p< 0.05)。 常氮处理条件下, 两个不同的苦荞品种根际酶活性有显著性差异(p< 0.05)。
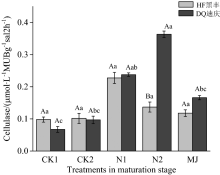 | 图3 苦荞成熟期根际土壤纤维素酶活性Fig.3 Cellulase activity in rhizospheric of different tartary buckwheat at maturation stage |
成熟期时, 苦荞对土壤中的养分需求能力逐渐减弱。 作为耐瘠性较强的迪庆苦荞, 土壤中聚集了较多的纤维素酶, 黄土本身团聚体对酶活性的吸附固定作用较弱, 所以残留有活性的纤维素酶造成了在迪庆品种土壤根际的高活性。 灭菌处理酶活性显著低于常氮处理的54.29%, 说明迪庆苦荞根际纤维素酶一部分来源于微生物的贡献, 养分充足时微生物的活性更高, 贡献越大。 高氮处理下两个不同的苦荞品种表现出了显著的差异性, 可能是因为苦荞遭遇养分胁迫时, 根系可以增加分泌物的含量来改变根际微环境[7]。 例如苦荞根系分泌物酚酸对土壤中部分微生物有一定的抑制作用, 减少其对生长介质的消耗, 来保证酶有充足的底物来供给自身的养分需求, 增加竞争能力。
苦荞苗期和开花期时, 纤维素酶活性在低氮处理下不同品种间均表现出显著差异, 耐瘠性的苦荞品种在生长前期可以通过调节根际土壤酶的活性来抵抗外界环境的胁迫, 获取更多的需求养分。 苦荞开花期时对养分需求较大, 纤维素酶在氮处理间均显示出了显著差异性, 其中常氮处理显著高于其他水平。 苦荞成熟期时, 纤维素酶在高氮处理下表现出了品种间的差异, 且只有耐瘠性迪庆苦荞根际纤维素酶活性在不同氮处理下表现出差异。 在贫瘠的土地上可以适当的选择耐瘠性较好的苦荞品种, 来节约农业成本投入。 土壤酶活性可以作为灵敏性较强的检测指标应用于农业生产实践中, 开展实践工作中需要大量和及时的酶数据来进行工作的预判, 采用荧光检测酶活性的方法可以提高工作效率, 节约成本, 为工作带来更大的便捷。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|