作者简介: 张立志, 1994年生, 辽宁大学化学院硕士研究生 e-mail: zhlizhi94@163.com
以柠檬酸和尿素为碳源和氮源, 采用固态法一步合成出量子产率高达23%的荧光碳点。 表征结果表明, 所合成的荧光碳点为平均粒径为3~4 nm的球形, 表面富含羟基、 羧基和胺基等基团。 此外, 碳点的XRD谱图显示出无定型碳的特征峰。 以所制备的碳点为荧光探针, 基于碳点和阿霉素之间的共振能量转移而猝灭碳点的荧光, 建立了阿霉素定量分析新方法。 实验中考察了溶液的pH值和孵化时间的影响。 在最佳实验条件下, 阿霉素浓度在0.67~16.67 μg·mL-1范围之间与碳点的荧光猝灭值Δ F呈良好的线性关系( R2=0.995), 检出限为0.22 μg·mL-1, 回收率为83.0%~89.2%, 相对标准偏差小于2.5%( n=5)。 尿样中常见物质对测定干扰较小, 显示出所建立的方法具有较好的选择性。
Fluorescent carbon dots (CDs) with a fluorescent quantum yield of 23% was successfully synthesized by one-step solid-state approach with citric acid and urea as carbon source and nitrogen source. It was found that the obtained CDs have highly disordered carbon structure and show sphere with an average diameter of 3~4 nm. In addition, the surfaces of CDs were covered with hydroxyl, carboxyl and amine groups. Based on the fluorescence resonance, energy transfers from fluorescence carbon dots to ADM (doxorubicin or adriamycin), the fluorescence of CDs can effectively quenched by ADM and a novel method for the sensitive and selective determination of ADM was proposed in this paper. Some experimental parameters, such as pH value of the reaction solution and reaction time were investigated. Under the optimum conditions, the decrease of CDs fluorescence intensity was in a good linearity with ADM in the concentration range of 0.67~16.67 μg·mL-1 ( R2=0.995), the detection limit of the method was found to be 0.22 μg·mL-1, and the spiked recoveries ranged from 83.0% to 89.2% with RSD no more than 2.5%. he result showed that common relevant substance, cations and anions did not significantly interfere with the detection of ADM.
荧光碳点(CDs)作为21世纪新型的纳米材料, 具有良好的荧光特性、 毒性低和生物相容性好等优点, 其制备和应用一直是人们关注的研究重点。 虽然碳点的应用主要还在生物医学领域, 但最近几年, 人们也开始利用其荧光特性对某些物质进行了分析检测。 研究者基于碳点的荧光猝灭现象, 对Hg2+, Fe3+和Cu2+等多种金属离子建立了分析检测方法[1, 2, 3]。 此外, 人们利用碳点荧光被猝灭后还可以恢复的现象, 建立了P
阿霉素(ADM)为一种抗癌抗生素, 广泛用于治疗肿瘤疾病[8]。 为了了解其药效, 有必要知道ADM在体液中的浓度分布。 虽然高效液相色谱法[9]和荧光法[8]等方法已用于对ADM的分析检测, 但这些方法还存在着干扰大和测试时间长等诸多不足, 有必要发展新的测定方法。
采用固态法制备了发蓝光的水溶性荧光碳点, 并对其形貌、 结构和光学性质等进行了表征。 利用ADM能够有效地猝灭碳点的荧光, 且猝灭程度与ADM的浓度在一定范围内有良好的线性关系, 据此建立了ADM含量的测定方法, 并应用于人体尿液中ADM的定量检测。
JEM-100SX透射电子显微镜(日本电子公司); D8X射线衍射仪(Bruker公司); Nicolet Avatar 330傅里叶红外光谱仪(美国热电公司); TU-1800PC紫外-可见分光光度计(美国Varian公司); Cary Eclipse 300荧光光谱仪(美国Varian公司); Invia拉曼光谱仪(RENISHAW公司; NanoZS90型纳米粒度及Zeta电位分析仪(英国Malvern 公司)。
柠檬酸、 尿素、 氯化钠、 三羟甲基氨基甲烷(Tris)、 硫酸奎宁、 盐酸和氢氧化钠等试剂都为分析纯(国药集团化学试剂沈阳有限公司); 99%的ADM原料药(浙江海正药业)。 实验中所有的溶液都是用超纯水配制的。
取0.5 g的柠檬酸和0.8 g的尿素溶于二次蒸馏水中, 完全溶解后转移到50 mL反应釜中, 在鼓风干燥箱中200 ℃下, 反应3 h, 待冷却至室温后, 得到棕黄色的碳点溶液。 先离心, 再用0.22 μ m滤膜过滤, 最后透析48h后除去溶液中的未反应的原料和其他杂质。 最后将纯化后的碳点溶液经冷冻干燥, 得到碳点固体粉末并用于下面的各种表征和荧光猝灭实验。
以硫酸奎宁作为对照, 测定该CDs的量子产率。 首先用0.1 mol· L-1的H2SO4配制硫酸奎宁溶液。 保证该浓度下的硫酸奎宁溶液在波长为360 nm处的吸光度Af小于0.1, 此外, 将CDs溶液稀释后在同样条件下测定其紫外吸收, 也要保证使其吸光度值小于0.1。 然后用荧光分光光度计分别测定硫酸奎宁溶液和CDs溶液的荧光发射谱, 并计算各自的峰面积为If和I。 最后将测得的硫酸奎宁和碳点溶液的吸收值和荧光峰面积值分别代入到式(1)中, 计算荧光量子产率。
式(1)中: Φ f为硫酸奎宁的量子产率(Φ f=54%), η 和η f分别为CDs和硫酸奎宁所用溶剂的折光率(硫酸的折光率η f=1.428, 水的折光率η =1.33); A和Af分别为CDs和硫酸奎宁溶液的吸光度; I和If分别为CDs和硫酸奎宁的荧光峰面积。
向1 cm的石英比色皿中加入3 mL浓度为2.0 μ g· mL-1的碳点溶液, 然后用微量注射器依次加入10 μ L的ADM溶液(100 μ g· mL-1), 室温下, 孵化4 min后, 在激发波长为360 nm时, 分别测定每次加入ADM后混合溶液的荧光光谱。 仪器的激发和发射单色器狭缝宽度均为5 nm。
图1为碳点的透射电镜照片及其粒径分布图。 由图1可以清楚地看到所合成的碳点呈球状, 平均粒径为2.5~4.5nm, 且颗粒分散性很好。
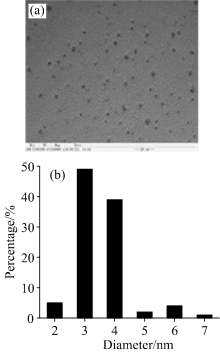 | 图1 碳点的投射电镜照片(a)和粒径分布图(b)Fig.1 Image (a) and histogram of size distributions (b) of the as-synthesized CDs |
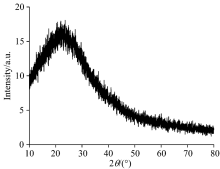
图2为碳点的XRD谱图。 由图可知, 在2θ =22° 附近有个强的宽衍射峰, 指出所合成的碳点具有无定型碳的结构[10]。
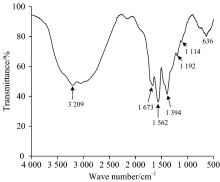
图3为碳点的红外光谱图。 由图3可知, 1 673 cm-1处为C=O的特征吸收峰; 在3 300~2 500 cm-1区域出现特征的宽峰, 这是由于O— H直接连于羰碳上二者相互作用导致, 是羧酸的特征峰; 1 192和1 114 cm-1处为C— O伸缩振动吸收峰; 1 394 cm-1处为O— H的弯曲振动吸收峰; 636 cm-1左右宽的弱峰, 是O— H的面外弯曲振动; 1 562 cm-1为N— H的弯曲振动吸收峰。 由红外光谱可以推知碳点表面含有大量的羟基、 羧基和胺基, 使其具有良好的水溶性。
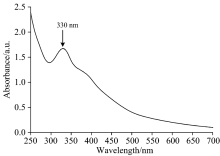
图4为碳点的紫外-可见吸收光谱。 由图可知, 所制备的碳点吸收范围由紫外区延长至可见区, 而且在330 nm处有个特征吸收峰, 此峰归于C=O的n→ π * 跃迁[11]。
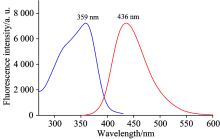
图5为碳点的荧光激发和发射光谱。 由图可知, 碳点的最大激发波长为359 nm, 最大发射波长位于436 nm, 此时斯托克斯位移为77 nm, 较大的位移将有利于实际应用中信号的检测。 此外, 以硫酸奎宁为参比, 测得CDs的荧光量子产率高达30.4%, 表明所制备碳点具有良好的光致发光性能。
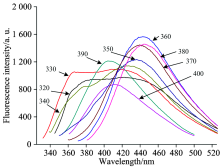
用不同波长光分别激发碳点溶液, 得到的如图6所示的荧光发射光谱图。 从图中可以看出, 激发波长从320 nm增加到360 nm时, 碳点的荧光发射峰强度随着激发波长的增加而增强, 并出现峰位置有稍许红移现象, 当激发波长为360 nm时, 溶液的荧光强度达到最大; 而激发波长从360 nm增加到400 nm的过程中, 其荧光强度又开始逐渐减小, 同时峰位置发生了蓝移。 这种现象反映了碳纳米材料荧光的发射与激发波长之间存在着依赖性[12]。 这种激发和发射波长可调的性质可能是碳点表面存在大量缺陷(发射位点)造成的[12]。
在石英比色皿中加入3 mL浓度为2.0 μ g· mL-1的碳点溶液, 用微量注射器依次加入不同量的ADM溶液, 然后分别用激发波长为360 nm的光激发, 测得相应的荧光发射光谱, 结果如图7所示。 由图可知, 随着ADM含量的增加, 碳点的荧光强度逐渐减弱, 这说明碳点和ADM之间发生了相互作用。 利用此碳点荧光猝灭现象有可能用于ADM的定量分析。
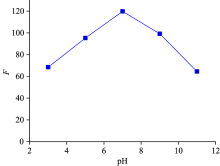
实验中考察了pH值和孵化时间对碳点-ADM体系荧光强度的影响。 由图8可知, pH值对反应体系荧光强度有影响, 并且在pH 7时荧光猝灭程度最大。 所以下面的所有实验都是在pH 7.0的Tris-HCl缓冲溶液条件下进行的。
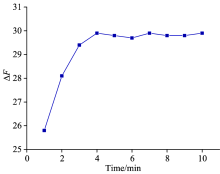
固定溶液的pH值为7.0, 考察孵化时间对碳点荧光猝灭的影响, 结果如图9所示。 由图可知, 孵化时间从4到10 min, 碳点荧光猝灭程度几乎不再变化, 基本保持稳定。 因此, 本实验荧光测定都是在孵化4 min以后开始的。
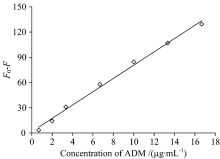
固定碳点浓度为2.0 μ g· mL-1, 在最优pH值和孵化时间条件下测定了加入不同浓度ADM后碳点的荧光猝灭光谱。 依据所测定的荧光猝灭数据, 绘制了如图10所示的碳点荧光猝灭与ADM浓度的关系曲线。 拟合曲线的线性范围为0.67~16.67 μ g· mL-1, 线性回归方程为Δ F=9.589+36.97c(c, μ g· mL-1), 相关系数R2为0.995, 检出限为0.22 μ g· mL-1(3SD/K)。 虽然利用ADM的内源性荧光可以直接测定它的含量, 但实际样品中其他共存离子等的猝灭效应较大, 所以尽管方法的检出限可达到10-9 mol· L-1, 但选择性较差[13]。
为了考察尿液中可能存在的物质(如蛋白质、 无机离子、 维生素等)对阿霉素测定的影响, 进行了干扰试验。 HSA、 维生素C的浓度分别为2 000 μ g· mL-1, 是实验中ADM浓度的1 000倍; K+和Na+的浓度都为1 000 μ g· mL-1, 是实验中ADM浓度的500倍; Mg2+的浓度为200 μ g· mL-1, 是实验中ADM浓度的100倍; Fe3+的浓度为10 μ g· mL-1, 是实验中ADM浓度的5倍。 在碳点和ADM溶液(浓度为2 μ g· mL-1)中, 分别加入上述浓度的各物质, 利用所建立的ADM测定方法测定加入干扰物样品中ADM含量, 结果如图11所示。 从图中可以发现, 除维生素C外, 其他物质的对ADM测定的影响都在± 5%相对误差内, 而一般的尿液样品中维生素C浓度不会很高, 因此, 可以说本方法具有较好的选择性。
临床实验表明, 约5%的ADM会由人体尿液中排出[14]。 实验中, 取健康人的尿液进行离心处理后, 稀释10倍。 在石英比色皿中加入3 mL的pH=7.0的碳点溶液(2.0 μ g· mL-1), 在激发波长为360 nm时, 测得碳点溶液的荧光强度为F0, 用微量注射器加入50 μ L的尿样, 再分别加入30, 80和140 μ L的ADM标准液, 在激发波长为360 nm时, 分别测得混合溶液的荧光强度, 由荧光强度的猝灭值, 利用工作曲线计算回收率, 结果列于表1。 由表1可知, 回收率值范围为83.0%~89.2%, 5次测定的相对标准偏差(RSD)为1.9%~2.3%, 表明本方法可有效地用于人体尿液中ADM的含量测定。
| 表1 人体尿液中ADM的回收实验结果(n=5) Table 1 Recovery results of ADM in urine samples (n=5) |
实验中分别测定了ADM、 碳点、 ADM和碳点混合溶液的Zeta电位。 每个样品测定3次, 计算求得碳点、 ADM以及二者混合溶液的平均电位值分别为-24.6, +25.5和-0.90 mV。 由此可推知, 带负电荷的碳点与带正电荷的阿霉素混合后, 二者通过静电作用, 形成了新的复合物, 使二者距离拉近。 此外, 图12中曲线a和b分别是碳点的荧光发
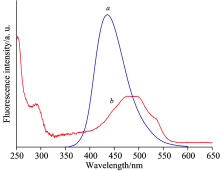 | 图12 碳点的荧光发射光谱(a)和ADM的紫外吸收光谱(b)Fig.12 Overlap of fluorescence emission spectrum of CDs (a) and absorption spectrum of ADM (b) |
射光谱和ADM的紫外吸收光谱, 二者之间有很好的光谱重叠。 再者, 由图7所示, 随着ADM的浓度增加, 碳点的荧光逐渐被猝灭, 同时ADM的荧光逐渐增加。 因此, 可以推断二者之间发生了共振能量转移而猝灭了碳点的荧光。
以柠檬酸和尿素为碳源, 采用固态法一步合成表面带有负电荷的蓝色荧光碳点。 以所制备的碳点为荧光探针, 基于碳点和ADM之间的共振能量转移而猝灭碳点的荧光, 建立了测定ADM的新方法。 在最佳实验条件下, 该方法对 ADM 的检测范围为0.67~16.67 μ g· mL-1, 相关系数(R2)为0.995, 检出限达0.22 μ g· mL-1。 将方法应用于人体尿液中ADM含量的测定, 回收率为83.0%~89.2%, RSD小于2.5%。 该方法灵敏度高、 选择性好、 操作简单, 同时具有较高的准确度和精密度。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|