作者简介: 汤小玉, 1989年生, 北京工业大学生命科学与生物工程学院环境与病毒肿瘤学北京市重点实验室博士研究生 e-mail: 892127710@qq.com
日落黄是一种具有潜在危害性的人工合成色素。 选用人血清蛋白为研究对象, 利用荧光光谱法分析了日落黄对人血清蛋白荧光的猝灭作用, 确定了荧光猝灭反应的猝灭常数Ksv, 结果表明日落黄对人血清蛋白的荧光猝灭作用类型为静态猝灭。 运用同步荧光光谱法分析日落黄与人血清蛋白结合表明: 日落黄与人血清蛋白的结合靠近色氨酸附近, 引发色氨酸残基趋向伸展状态, 人血清蛋白的结构发生改变。 此外, 在模拟人体生理条件下选用10种不同的金属离子加入到日落黄和人血清蛋白的反应体系中, 运用三维荧光法检测金属离子对体系的影响, 结果表明Cu2+, Pb2+, Ni2+和Mn2+对猝灭过程有着促进作用, 其中Ni2+的影响最大, 增幅达 22.6 %; 而Fe2+和Zn2+对猝灭过程有着抑制作用, 抑制率达14.12%和14.2%。 本研究的实验方法适用于研究食品添加剂的毒性, 有助于保护食品安全, 维护人体健康。
Sunset Yellow (SY) is a potentially harmful artificial synthetic pigment. This paper, taking human serum albumin (HSA) as the research object, analyzes the quenching effect of SY on HSA and determines the quenching constant Ksv of the quenching reaction with the fluorescence spectroscopy method. The results show that the quenching effect of SY on HSA is static quenching. In addition, based on the analysis of the binding of SY and HSA with the synchronous fluorescence spectroscopy method, it is found that the binding of SY and HSA is near tryptophan, whose residue is caused to be in a stretching state and the structure of HSA has changed. Furthermore, this paper selects ten types of metal ion, adds them into the reaction system of SY and HSA under the simulated human physiological conditions, and detects the impacts of the metal ions on the system with the three-dimensional fluorescent spectrometry method, which demonstrating that Cu2+, Pb2+, Ni2+ and Mn2+exert facilitation effects on the quenching process, and Ni2+shows the largest impacts, with an increase of 22.6%, while Fe2+ and Zn2+have inhibition effects on the quenching process, with an inhibition ratio of 14.12% and 14.2%, respectively. Therefore, the experimental method is applicable to the study on the toxicity of food additives and conducive to ensureing food safety as well as maintaining human health.
日落黄是一种常用的人工合成偶氮类食用色素, 广泛应用于食品和药物的着色[1], 但过量使用可能会诱发癌症、 小儿多动症等疾病[2, 3]。 人血清蛋白(human serum albumin, HSA)在人体内起着重要的贮存和运输作用, 可以与许多化合物结合[4, 5]。 因此若HSA与有毒害作用的小分子结合而发生变性, 则很可能影响人体正常生理代谢循环的运转; 人体内含有多种金属离子, 金属离子对小分子与HSA的猝灭作用有影响[6], 因此有必要探究金属离子对小分子与HSA相互作用的影响。
近几年关于小分子与血清白蛋白之间相互作用的研究较为广泛, 目前在这方面的研究主要集中在药物以及一些有机小分子污染物与血清白蛋白的相互作用[7, 8]。 日落黄与血清白蛋白之间的相互作用已有一定的研究, 李金凰等[9]利用微分脉冲伏安法研究了日落黄与牛血清蛋白的相互作用, 证明了日落黄与牛血清蛋白之间主要依靠静电作用力形成近似1:1的复合物, 从而导致日落黄的峰电流的降低。 张方圆等[10]通过荧光光谱法分析了日落黄与β -胡萝卜素对对牛血清蛋白(bovine serum albumin, BSA)的猝灭机理, 证明了日落黄和β -胡萝卜素对BSA的猝灭属于静态猝灭。 有研究证明金属离子对小分子与血清白蛋白的猝灭作用有一定的影响。 Manjushree等[11]通过同步荧光光谱法研究金属离子对BSA与药物依来曲普坦结合的影响。 邓少东等[12]运用荧光光谱法, 同步荧光光谱法分析了野漆树苷与人血清蛋白的结合作用。 郭明等[13]采用荧光光谱技术研究重金属离子与HSA间的结合作用机制, 证明了金属离子Pb2+, Cr6+, Cu2+与HSA之间的相互作用是自发的。
目前, 已有研究证明金属离子在人体内与HSA的作用会影响HSA的固有结构[14], 而关于金属离子对食品添加剂与HSA之间的协同或抑制作用的相关研究甚少, 该领域的研究方法及相关理论研究需要进一步完善。
本文运用同步荧光光谱方法对日落黄与人血清蛋白的相互作用进行研究, 检测了其相互作用的猝灭机制, 结合反应机理以及蛋白的构象变化, 同时运用三维荧光光谱法探究不同金属离子对猝灭作用的影响, 为进一步了解日落黄在人体中的影响提供了实验和理论依据, 在增强食品安全方面有着重要意义。
HSA(美国Sigma公司, 纯度98%)用超纯水配置成1× 10-5 mol· L-1的储备液, 日落黄(上海安普实验科技股份有限公司, 纯度98%)用超纯水配置成1× 10-2 mol· L-1储备液, HCl(北京化工厂, GR优级纯)三羟甲基氨基甲烷、 氯化锂、 氯化镁、 氯化钙、 氯化铅、 四水合氯化亚铁、 六水合氯化镍、 氯化锌、 氯化锰、 氯化铁、 二水合氯化铜天津福晨化学试剂厂, AR分析纯)所有金属盐用超纯水配置成1× 10-2 mol· L-1储备液。 缓冲液为Tris-HCl溶液(pH 7.4): 准确称取3.078 g 三羟基甲基氨基甲烷, 溶于超纯水后, 再移入250 mL的容量瓶中并定容, 取2.5 mL HCl定容至250 mL, 分别移取150 mL的Tris溶液与126 mL的HCl溶液调pH至7.4。
F-4500荧光分光光度计(Hitachi日立), HH-2恒温水浴锅(邦西仪器科技有限公司), BS-210电子分析天平(北京赛多利斯天平有限公司), SX610pH 计(上海三信仪表厂)。
1.2.1 试剂准备
超纯水稀释日落黄储备液的浓度由高到低分别为: 1× 10-3, 9× 10-4, 7× 10-4, 5× 10-4, 3× 10-4, 1× 10-4和1× 10-5 mol· L-1。 用超纯水将各金属盐分别稀释至1× 10-4 mol· L-1, 将此金属盐水溶液放置在离心管中备用。 (最终体系为 3 mL, 日落黄浓度由低至高分别为: 6.67× 10-7, 6.67× 10-6, 2.00× 10-5, 3.33× 10-5, 4.67× 10-5, 6.00× 10-5和6.67× 10-5 mol· L-1 。 )
1.2.2 荧光光谱分析法
取一定浓度的日落黄溶液0.2 mL于5 mL的离心管中, 加入0.8 mL浓度为 1× 10-6 mol· L-1 的HSA溶液, 混匀后加入2 mL预热至37 ℃的pH为7.4的Tris-HCl缓冲溶液, 混匀后于37 ℃水浴保温30 min。 移入1 cm的荧光比色皿中, 使用荧光光谱仪检测EX=280 nm, EM为300~500 nm的发射光谱, 调波长差为Δ λ =15 nm和Δ λ =60 nm进行同步荧光光谱检测。
该实验分别在25, 30和37 ℃进行试验, 各温度下分别实验三次结果取平均值。
1.2.4 不同金属离子对体系的影响
取5 mL离心管加入0.8 mL浓度1× 10-6 mol· L-1的HSA溶液, 分别加入0.05 mL不同金属离子溶液, 充分混匀后加入0.2 mL不同浓度日落黄溶液, 再加入1.95 mL的 pH为7.4的Tris-HCl缓冲液。 37 ℃水浴保温30 min后, 将离心管从水浴锅中取出, 将各样品分别移入1 cm的石英比色皿中, 扫描其三维荧光光谱, 实验三次结果取平均值。
荧光光谱主要参数: 扫描模式: 3-D Scan, 数据模式: Fluorescence, 激发波长: 280 nm, 发射波长范围: 300~500 nm, 激发狭缝: 5.0 nm, 发射狭缝: 5.0 nm, 光电倍增管电压: 950 V, 扫描速度: 1 200 nm· min-1。
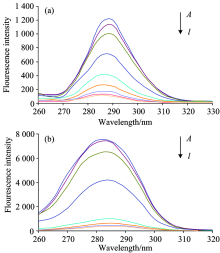
实验中, EX=280, EM的最大值为343 nm做同步荧光扫描, 当波长差Δ λ =15 nm, 峰值出现在288 nm 处; 当波长差Δ λ =60nm, 峰值出现在282 nm处。
不同温度下人血清蛋白与不同浓度日落黄作用的荧光光谱如图1。 不同温度下所得的荧光谱图各个峰值数据见表1。 表1显示随着日落黄浓度的增大峰值明显降低, 说明日落黄对人血清蛋白具有荧光猝灭作用。
| 表1 不同温度下的荧光谱图峰值数据 Table 1 Peak of fluorogram at different temperatures |
根据Stern-Volmer方程进行分析
式(1)中, F0和F分别是蛋白质未加入猝灭剂与加入猝灭剂条件下的荧光强度, Kq是蛋白质的猝灭速率常数; KSV是Stern-Volmer猝灭常数, 可以通过Stern-Volmer方程线性回归确定。 τ 0表示蛋白质在无猝灭剂条件下的平均荧光寿命(通常为10-8 s); Q是指猝灭剂浓度。
在猝灭剂浓度一定的条件下, 以Q为x轴, F0/F为y轴作曲线(Stern.-Volmer.曲线), 如果猝灭类型是单一的静态猝灭或者动态猝灭, 则该曲线是应呈线性。 如果猝灭类型是混合猝灭(静态与动态同时参与), 则Stern-Volmer曲线应该是一个弯曲的非线性曲线。 不同温度下日落黄的Stern-Volmer曲线见图2。
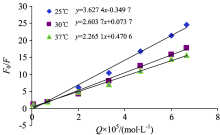 | 图2 不同温度下(F0/F)与日落黄(S.Y) 浓度Q之间的线性回归Fig.2 Linear regression between F0/F and Sunset Yellow concentration Q at different temperature |
由图2可知线性相关系数r均大于 0.99, 说明日落黄浓度与人血清蛋白之间作用的猝灭率具有很强的线性相关关系, 说明当日落黄与人血清蛋白发生作用为单一类型的猝灭; 由表2可知KSV随着温度的升高而减小, 且Kq均大于2× 1010 L· (mol· s)-1(蛋白质的动态猝灭速率常数的最大值), 表明日落黄和人血清蛋白反应形成了稳定复合物而导致的静态猝灭。
| 表2 不同温度下F0/F-[Q]曲线的KSV及Kq值 Table 2 The KSV and Kq values of F0/F-[Q] curves at different temperatures |
通过Lineweaver-Burk方程计算结合常数KA。 对Lineweaver-Burk方程变形可得到方程式(2), 将lg[(F0-F)/F]对lg[Q]作图, 所得直线斜率即为结合位点数n。
式(2)中: KA为结合常数, F0为未加入猝灭剂的荧光强度, F为加入猝灭剂时的荧光强度, Q为猝灭剂浓度。 以lg[(F0-F)/F]对lg[Q]作曲线, 见图3(a)— (c)。
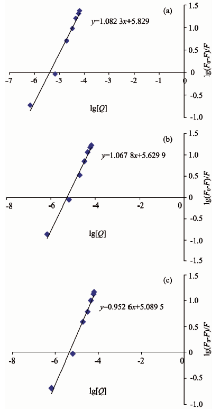 | 图3 不同温度下lg[(F0-F)/F]对lg[Q]的线性关系 (a): 25 ℃; (b): 30 ℃; (c): 37 ℃Fig.3 Linear relation between lg[(F0-F)/F] to lg[Q] at different temperatures (a): 25 ℃; (b): 30 ℃; (c): 37 ℃ |
由表3可知不同温度下的结合常数KA分别为6.745× 105, 4.265× 105, 1.230× 105; n分别为1.083, 1.068和0.953, n约等于1, 说明落日黄和人血清蛋白有一个结合位点, 结合常数随温度的升高而降低, 该结论与2.2得出的结果相符合。
| 表3 不同温度下lg[(F0-F)/F]对lg[Q]的回归方程及相关数据 Table 3 lg[(F0-F)/F] regression equation of lg[Q] and relevant data at different temperatures |
由Van’ t Hoff方程, 将2.3中的KA带入式(3)和式(4)可以求出蛋白质猝灭反应过程的焓变Δ Hθ 、 熵变Δ Sθ 和标准吉布斯自由能变, 结果见表4。
其中
| 表4 日落黄与HSA的相关热力学数值 Table 4 Thermodynamic values of the role of Sunset Yellow and HSA |
根据2.3中所得KA值计算出Δ Hθ =-105.01 kJ· mol-1, Δ Sθ =-240.76 J· K-1。 根据Masaki Otagiri总结的蛋白质反应的热力学规律, 若Δ Hθ < 0及Δ Sθ < 0时, 主要作用力为范德瓦尔斯力或氢键; 若Δ Hθ < 0及Δ Sθ > 0时, 主要作用力为静电作用; 根据结论Δ Hθ =-105.01 kJ· mol-1, Δ Sθ =-240.76 J· K-1, 焓变Δ Hθ < 0 , 熵变Δ Sθ < 0, 该反应过程中的主要作用力为范德瓦尔斯力或氢键。 根据反应的吉布斯自由能Δ Gθ 在25~37 ℃之间均小于零可知, 日落黄与人血清蛋白的结合在该温度范围内为自发反应。
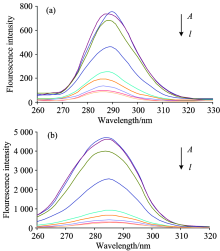
当Δ λ 的值分别为60和15 nm, 同步荧光分别给出的色氨酸和酪氨酸残基的特征信息。 不同温度下的同步荧光光谱图见图4(a, b)、 图5(a, b)、 图6(a, b)。
由图4— 图6可知三个温度下, 当Δ λ =15 nm时, 人血清蛋白的最大吸收峰的位置随日落黄浓度的升高基本保持不变; 当Δ λ =60 nm时, 人血清蛋白的最大吸收峰随日落黄浓度的升高逐渐发生红移且降低趋势较Δ λ =15 nm更加明显。 表明HSA中色氨酸残基的周围微环境在反应前后发生了变化。 由2.3的结论结合位点n=1可知日落黄与HSA的结合靠近色氨酸附近, 引发色氨酸残基趋向伸展状态, HSA的结构发生改变从而导致损伤。
三维荧光光谱图见图7(a— d)。 将三维荧光强度代入式(1), 计算加入金属离子后的结合常数KSV, 结果见表5。
未加入金属离子时, 37 ℃下日落黄与HSA的KSV为2.217× 105 L· mol-1, 由表5可知37 ℃加入Fe3+, Ca2+, Mg2+和Li+猝灭常数KSV的值分别为较之KSV(37℃), 相差在10%以内, 可以认为Fe3+, Ca2+, Mg2+和Li+对日落黄和人血清蛋白之间的荧光猝灭作用无明显影响; 加入Cu2+, Pb2+, Ni2+和Mn2+后猝灭常数KSV较之KSV(37 ℃)分别增加了19.8%, 12.8%, 22.6%和15.0%, 表明Cu2+, Pb2+, Ni2+和Mn2+促进了日落黄对人血清蛋白的荧光猝灭作用; 可能与重金属离子对HSA的结构造成损伤相关; 当加入Fe2+和Zn2+时猝灭荧光常数KSV较之KSV(37 ℃)分别减少了14.12%和14.2%, 表明Fe2+和Zn2+对日落黄和HSA之间的荧光猝灭过程有抑制作用, 可能是因为Fe2+和Zn2+在模拟生理条件下能够与HSA形成稳定复合物[11], 因而抑制HSA与日落黄之间的猝灭过程。
| 表5 不同金属离子存在下日落黄与HSA的猝灭常数KSV Table 5 Sunset Yellow and HSA quenching constantat different metal ion |
日落黄与HSA的结合是由范德瓦尔斯力或氢键引起的, 为静态猝灭, 结合位点数为1, 且接近色氨酸附近, 导致色氨酸残基伸展, 微环境的极性增强, 引发了HSA构象的改变, 说明日落黄对HSA具有损伤作用。 人体内的金属离子Cu2+, Pb2+, Ni2+和Mn2+对荧光猝灭过程有着促进作用可以加剧日落黄对人血清蛋白的损伤, 其中Ni2+的影响最大, 增幅达22.6%; 而Fe2+和Zn2+则有着抑制作用, 意味着它们可能可以保护人血清蛋白, 抑制日落黄对其荧光的猝灭作用。 本研究对于进一步研究日落黄在人体内的代谢、 运输及潜在毒性具有一定指导意义, 本实验方法适用于研究食品添加剂的毒性, 有助于保护食品安全, 维护人体健康。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|