作者简介: 陈 淼, 1983年生, 中国工程物理研究院核物理与化学研究所助理研究员 e-mail: chenmiao@caep.cn
红外光谱和拉曼光谱是分析金属氢化物结构的强有力工具, 通过红外、 拉曼光谱分析并结合理论计算, 可以获得二元(MgH2, CaH2, AlH3)和三元(Mg2FeH6)金属氢化物中金属原子与氢原子局域成键环境信息, 从而鉴别金属氢化物不同的相结构, 还可以获得三元金属氢化物 M2RuH6( M=Ca, Sr, Eu)中由于金属原子的不同而导致的结构差异, 以及三元金属氢化物与其氘化物的结构差异。 利用原位拉曼光谱分析技术分析高压或高温下金属氢化物的形成与分解反应过程, 可以获得金属氢化物在高压加载及卸压过程中的结构变化, 更好的理解金属氢化物的衍射数据。 PAIR(photoacoustic infrared spectroscopy)光谱技术增强了红外活性和拉曼活性组合谱带的强度, 从而避免了空气及潮湿环境对傅里叶红外变换光谱实验结果的影响。 红外光谱和拉曼光谱用于金属氚化物的结构分析, 获得金属氢化物中金属原子与氢同位素原子局域成键环境的差异, 更好的研究氢同位素效应。 而且, 拉曼光谱已被成功用于分析氢同位素混合气体的组成。 因此, 将金属氢化物结构的红外和拉曼光谱分析与氢同位素气体组分的拉曼光谱分析相结合, 可用于研究金属与氢同位素气体反应的动力学过程及同位素效应。
Infrared and Raman spectroscopy are powerful technologies in metal hydrides structure analysis. If theoretical calculation is combined with Infrared and Raman analysis technology, they can provide information on the local bonding environment between metal atoms and hydrogen atoms of binary (MgH2, CaH2, AlH3) and ternary (Mg2FeH6) metal hydrides. Thereby, different phase structures of metal hydrides can be identified, they can also provide structure difference information in ternary metal hydride M2RuH6 ( M=Ca, Sr, Eu) due to the different metal atom composition, and the structure differences between ternary metal hydride and deuteride also can be obtained. Moreover, the structure change of metal hydride can be monitored during compression and decompression by in situ Raman spectroscopy analysis, which helps us interpret diffraction data deeply. In order to avoid the disadvantageous effect of air and moisture on FTIR experiment results, PAIR spectrum was developed to increase the intensities of Infrared and Raman combination bands. Infrared and Raman spectroscopy even can be applied on metal tritides structure analysis, and it can provide the information on the local bonding differences between metal atoms and hydrogen isotopic atoms which helped us research the hydrogen isotopic effect better. Raman spectroscopy has also been used to in situ monitoring of the formation and decomposition of metal hydride under high pressure or high temperature, and has also been successfully applied in hydrogen isotope mixture gases analysis, such as tritium analysis and management in ITER project. If structure analysis is combined with hydrogen isotope mixture gas analysis by Infrared and Raman, the reaction kinetics and isotopic effect between metal and hydrogen isotope gases reaction can be researched.
氢是化学元素周期表中最简单的元素, 具有三种同位素, 其中, 氕(1H)是现下研究最热的清洁能源, 而氘(2H或D, 又称重氢)和氚(3H或T, 又称超重氢)不仅是聚变核武器的重要原料, 也是ITER(国际热核聚变实验反应堆)能源计划中的重要原料。
氢可以和几乎所有的金属元素都发生反应生成金属氢化物, 这就使得氢及其同位素以固态形式被大量贮存, 单位体积金属氢化物的贮氢量大, 贮氢密度高, 同时, 金属氢化物可以在一定条件下可逆地吸放氢及其同位素, 还体现出氢同位素效应, 这使得金属贮氢材料在氢贮存领域被广泛研究和应用, 还成功应用在氢同位素的贮存[1, 2, 3]、 纯化、 分离、 回收以及聚变核技术等方面, 使得氚工艺技术获得长足发展[4, 5, 6]。
金属氢化物在应用过程中, 其性能与结构密切相关, 因此, 在金属氢化物研究中, 准确的确定其晶体结构及相结构十分重要。 利用传统的结构分析方法(如XRD)可获得金属氢化物的晶体结构, 相结构及晶格参数。 而中子衍射分析技术在分析轻元素, 尤其是氢同位素分析中有着不可替代的优势, 因此, 近年来中子衍射技术在金属氢化物的结构分析中也被广泛应用, 通过中子衍射分析不仅可以获得金属氢化物的精细晶体结构和晶格参数, 同时, 还可以分析获得氢同位素原子在晶格中的空间占位。
在金属氢化物的结构分析中, 除了XRD和中子衍射分析, 振动光谱分析技术(如红外和拉曼光谱)能够提供金属氢化物的局域成键信息, 可以帮助更好的理解衍射数据, 还可以分析晶体、 无定形及非晶体材料, 因此, 利用红外和拉曼光谱可以对金属氢化物、 氘化物甚至氚化物的结构差异进行研究, 同时, 还可以在线原位研究金属与氢同位素气体的可逆反应, 尤其是与氚的反应。
Parker[7]和Reed[8]总结了近年来红外和拉曼光谱技术在碱金属、 碱土金属、 过渡金属等的硼氢化物和铝氢化物贮氢材料结构分析、 氢原子化学键成键信息变化研究中的相关进展, 表明红外和拉曼光谱技术也是分析贮氢材料结构和氢原子成键环境变化的强有力工具。 本文综述了红外和拉曼光谱在金属氢化物结构分析中的应用, 尤其重点关注了二者在金属氢化物及其氘化物结构差异分析中的应用。
在金属氢化物中, 随着氢含量的增加, 其晶体结构及相结构会发生变化, 氢原子的局域成键情况也将改变, 可以利用红外和拉曼光谱分析其变化情况。
金属Mg因贮氢密度高(7.6 Wt%)被视为一种潜在的贮氢材料, 其氢化物MgH2为四方的α 相(空间群P42/mnm), 具有金红石结构。 Santisteban等[9]在77 K低温下利用488 nm的Ar+激光器获得了MgH2的拉曼光谱数据, 谱图中出现了B1g, Eg和A1g三个拉曼活性的振动模, Lasave等[10]利用LAPW(linear augmented plane-wave)方法和壳模型(Shell-model)计算了MgH2的声子态密度以及红外和拉曼活性振动模, 其结果如表1所示, 计算结果中出现了B2g振动模, 但Santisteban的实验观测中B2g的振动模非常弱, 在拉曼光谱谱图中基本观测不到。
| 表1 计算和实验获得的MgH2的振动频率及相应的振动模 Table 1 Vibrational frequencies and assignments of the vibrations of MgH2 using theoretical calculate and experiment |
高压会导致α -MgH2转变为不同的结构: 正交的γ 相(空间群Pbcn), 立方的β 相(空间群Pa-3), 正交的HP1相(空间群Pbc21)和正交的HP2相(空间群Pnma), 其中, γ 相MgH2的密度较α 相的高1.6%, 其他相结构MgH2的密度则更高, 且在10 GPa高压下才能合成。 Kuzovnikov等[11]在5.6 GPa, 470 ℃下保温1.5 h, 将α -MgH2转变为γ -MgH2, 使用488 nm的Ar+激光器(~10 mW)获得了其室温下的拉曼光谱数据(如图1所示), 同时, 利用从头算方法获得了其声子模式。 虽然α -MgH2和γ -MgH2中Mg原子和H原子具有相似的近邻原子构成, 但因其晶体的对称性不同而造成其拉曼谱图的巨大差异。
 | 图1 α -MgH2(a)和γ -MgH2(b)的拉曼光谱 蓝色为实验曲线; 红色为计算曲线Fig.1 Raman spectra of α -MgH2 (a) and γ -MgH2 (b) blue: experimental spectra; red: calculated spectra |
利用原位的拉曼散射分析技术, Li等[12]发现了室温下CaH2的高压新相。 原位加载高压时, 随着压力的增加[如图2(a)], 在15.6 GPa时CaH2发生相转变产生新相, 但当压力高于21.3 GPa时, 新相消失, 同时该相转变过程是可逆的, 当减压时[如图2(b)], CaH2也会发生相转变产生新相, 但与加压时的相转变过程不同, 减压时的相转变过程有明显的滞后现象, 当压力接近12 GPa时, 新相才消失。
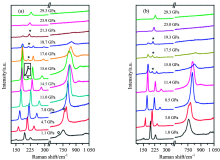 | 图2 室温下CaH2的拉曼光谱谱图 (a): 加压; (b): 卸压Fig.2 Raman spectra of CaH2 as a function of pressure at room temperature (a): Compression; (b): Decompression |
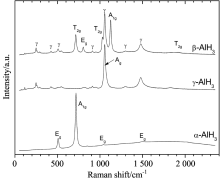
AlH3的贮氢密度为10.1 Wt%, 体积密度高达0.148 gH2· cm-3, 是液氢的两倍。 AlH3存在α , α ', β , δ , ε , γ 和ζ 相, 但多数结构都是理论预测得到的, 其中, 只有α , β 和γ 相是相对稳定的。 Tkacz等[13]首次获得了常压至16.9~32.7 GPa范围内α -AlH3的拉曼光谱谱图, 在200~2 000 cm-1波数范围内, 出现512, 723, 849, 1 043和1 501 cm-1五个振动峰, 但随着压力的增加, 其拉曼峰峰位均向高波数偏移, 且逐渐宽化, 但整个过程中未出现新的拉曼峰, 表明压力加载虽导致α -AlH3晶格发生畸变, 但却未出现相转变。 为避免高功率激光照射导致的样品分解, 实验过程使用18 mW的低激光功率, 但还是会导致部分样品分解, 尤其γ -AlH3对激光辐照更为敏感, 因此, 实验过程严格控制数据的采集时间, 这也导致了拉曼信号强度的衰减, 随着压力的增加, 可以观察到γ -AlH3转变为α -AlH3。 鉴于γ -AlH3的不稳定, Wang等[14]利用密度泛函理论计算了其晶格结构、 电子和声子振动特性, 并与α -AlH3进行了对比, 其声子振动特性如表2所示。 在γ -AlH3中, 由于特定Al原子和H原子间存在独特的双桥键合而形成六元环结构, 使得H原子的s轨道与Al原子高能量的p和d轨道结合, 导致整个体系具有更高的电子能量, 因而展现出独特的振动特性。
| 表2 α -AlH3和γ -AlH3的光学支声子振动特性 Table 2 Phonon frequencies for optical normal modes of α -AlH3 and γ -AlH3 |
Manciu等[15]利用AlCl3和LiAlH4反应制备了α -和γ -AlH3, 并利用红外和拉曼光谱分析了其结构, 结果如表3所示, 从表中数据可以看出, 与Wang等[14]理论预测的结构数据一致。 同时, Vadym Drozd等[16]利用锂铝氢化物和氯化铝在溶液中的置换反应合成了α -, β -和γ -AlH3, 并利用拉曼光谱研究了其在高压下的结构特性, 其谱图如图3所示, 光谱数据显示在6 GPa范围内, β -AlH3是稳定的, 随着压力的增高, 会转变为α 相, 而在高压下, β 相和γ 相AlH3均会转变为α 相, 同时产生高浓度的结构缺陷, 而高压下立方结构的β -AlH3晶体结构不稳定是由于高压导致了[AlH6]多面体结构的扭曲畸变。
| 表3 α -AlH3和γ -AlH3的红外和拉曼振动特性 Table 3 IR and Raman vibrations of α - and γ -AlH3 |
在Mg基3d过渡金属氢化物中, Mg2FeH6具有很高的贮氢密度(5.47 Wt%, 150 kg· m-3), 被视为一种潜在的贮氢材料, 但该材料的合成比较困难。 Zhou[17]等利用第一性原理方法, 计算获得了Mg2FeH6的晶格结构并与实验结果进行了对比, 验证了计算模型和方法的正确性, 同时根据计算得到的声子振动频率获得了其红外和拉曼活性的振动模式, 分别为T1u(transverse optical/longitudinal optical): 205/231, 854/858和1 794/1 833 cm-1, T2g: 231 cm-1, T2g: 973 cm-1, Eg: 1 859 cm-1, A1g: 1 899 cm-1。
Wang和Lester Andrews[18, 19, 20, 21]利用激光将Pt, Mg, Mn, Re和Mo熔化蒸发为原子, 并与分子氢发生共凝反应, 形成系列金属氢化物分子, 同时利用同位素交换法, 部分或完全替代其中的氢原子, 合成氘化物分子, 并在低温下获得了其红外光谱, 结合密度泛函理论(density functional theoretical, DFT)计算得到的分子振动频率, 获得了氢化物分子的空间结构及对称性, 同时, 探讨了金属与氢反应的机理。
此外, Roger Domè nech-Ferrer等[22]开发了一种利用拉曼光谱进行反应过程研究的原位反应池, 其氢气压力可达到200 bar, 温度可达400 ℃。 使用该反应池, 可利用拉曼光谱原位研究高压或高温下金属氢化物的合成及分解反应过程。
红外和拉曼光谱是进行金属氢化物结构特性分析的强有力工具, 但金属氢化物与其氘化物的结构有明显差异, 如锆氢化物的晶格常数较其氘化物的大, 主要原因是氢原子和氘原子在晶格中的振动频率不同而引起Zr— H和Zr— D键长差异[23], 而如前文所述, 红外和拉曼光谱在分析氢原子在金属氢化物中的局域成键环境及其振动频率方面已有很多应用, 若将其应用于金属氢/氘化物的结构差异分析, 可以更好的帮助理解金属氢/氘化物结构的同位素效应。
Zhou[17]等利用理论计算获得了Mg2FeH6的红外和拉曼振动峰, Parker等[24]则利用红外和拉曼分析对比了Mg2FeH6和Mg2FeD6的结构差异, 将振动的各峰位与其对应的波数, 以及相应的振动模列于表4中。 Mg2FeH6和Mg2FeD6晶体属于立方空间群, 每个单胞含4个分子, Mg2+处于单胞的四面体Td位, Fe
| 表4 Mg2FeH6和Mg2FeD6的红外、 拉曼光谱峰对应波数及相应的振动模 Table 4 Observed bands (cm-1) and assignments for Mg2FeH6 and Mg2FeD6 in Oh symmetry |
虽然红外与拉曼光谱技术是材料结构分析的强有力工具, 但由于拉曼分析时激光的辐照效应会导致金属氢化物的分解, 因此利用拉曼光谱分析方法来获得金属氢化物和氘化物的结构特性的相关数据还相对较少。 Hans Hagemann等[25]利用2~10 mW的488 nm激光光源获得了室温下M2RuH6(M=Ca, Sr, Eu)的拉曼光谱谱图, 各振动模式对应的峰位列于表5。 晶格结构及Ru— H和Ru— D键长的不同导致了振动频率之间的差异, 氢化物的晶格常数较氘化物的大, 因此, 其红外和拉曼谱峰对应的波数也相对较大, 但限于实验设备, 某些样品的拉曼谱图并未被检测到。
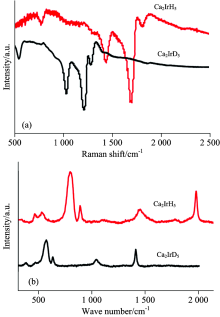
Mirela M Barsan等[26]利用傅里叶变换红外光谱及拉曼光谱分析了三元合金氢化物Ca2IrH5和氘化物Ca2IrD5的结构, 其谱图如图4, 光谱中各振动峰对应的波数及相应的振动模式列于表6中。 由图4中可以看出, Ca2IrH5和Ca2IrD5的红外及拉曼谱图中各峰位呈现明显的不同, 这主要是由于晶体中化学键在不同对称形式下的伸缩或弯曲振动模式之间的差异, 以及转动的不同造成的, 这也说明Ca2IrH5和Ca2IrD5在结构上存在同位素效应。
| 表5 三元金属氢化物的振动数据 Table 5 Vibrational data-ternary metal hydrides |
| 表6 Ca2IrH5和Ca2IrD5的振动峰对应波数及相应的振动模 Table 6 Vibrational wavenumbers and assignments of Ca2IrH5 and Ca2IrD5 |
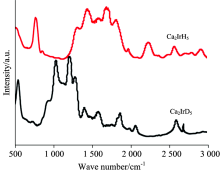
但是, 傅里叶红外变换光谱易受空气及潮湿环境的影响, 使得一些较弱的振动峰不能被检测, 而忽略了一些结构上的重要信息, 因此研究者开发了一种PAIR光谱技术(photoacoustic infrared spectroscopy)来弥补这一缺憾。 Barsan等[26]利用PAIR技术分析了三元合金氢化物Ca2IrH5和氘化物Ca2IrD5, 其谱图如图5。 可以看出, 得到的PAIR谱图相比于红外谱图更加复杂, 原因是PAIR技术中增强了红外活性和拉曼活性组合谱带的强度。 谱图中各峰对应的波数及相应振动模列于表6中。
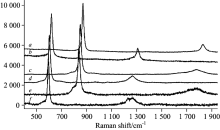
Barsan等[27]还对比了几种三元金属氢/氘化物M2RuH6(D6) (M=Ca, Sr, Eu)在常压下的拉曼谱图(图6)。 针对其八面体对称结构, [RuH6]4-基团有以下振动模式: A1g(R)+Eg(R)+2T1u(IR)+T2g(R)+T2u(Inactive), 其中T1u为红外活性的振动模式, 而T2u基本没有拉曼活性, 从图中可以看出, 氢化物和氘化物的拉曼谱图主要出现三个峰, 分别针对A1g, Eg和T2g振动模式, 但氢化物和氘化物的谱图峰位有很大差别, 将各振动峰对应的拉曼位移列于表7中, 发现即使氢化物和氘化物具有相同的晶格参数, 但在拉曼振动的位移上具有很大的差别, 氢化物和氘化物结构上存在显著的同位素效应。 同时, 考察了压力对氢/氘化物结构的影响, 发现至5 GPa均未发生明显的相转变, 但随着压力的增加, 各峰位对应的波数亦呈线性增加趋势。
| 表7 M2RuH6(D6)常压下的拉曼位移和晶格常数 Table 7 Raman wavenumbers and unit cell length for M2RuH6(D6) at ambient pressure |
红外和拉曼光谱是分析金属氢化物结构的强有力工具, 其光谱数据能够提供金属氢化物中金属原子与氢原子的局域成键信息, 帮助更好的理解衍射数据, 同时, 其也可以用于分析金属氢化物与其氘化物的结构差异, 甚至可将其应用于金属氚化物的结构分析, 提供金属原子与不同氢同位素原子局域成键环境的差异。
同时, 利用拉曼光谱可以在高压或高温下原位分析金属氢化物和氘化物的形成及分解过程, 拉曼光谱还可分析氢同位素混合气体, 测定氢、 氘、 氚、 衰变氦-3, 甚至HD、 DT和HT在混合气中的组成比例, 其已成功应用于德国、 法国和中国的氚实验室中, 也成功应用于ITER计划中氚的分析与管理[28, 29, 30, 31, 32, 33, 34]。 将金属氢/氘/氚化物形成及分解的原位拉曼分析与氢同位素混合气体组成的拉曼分析相结合, 可以研究金属与氢同位素气体反应的动力学过程, 同时, 还可研究金属与氢同位素反应过程的同位素效应, 帮助更好理解金属与氢同位素反应的过程。
而将利用中子衍射获得的金属氢/氘/氚化物中氢同位素原子空间占位的差异与利用红外和拉曼光谱获得的金属原子与氢同位素原子局域成键环境差异相结合, 则能更好的理解金属氢化物结构产生同位素效应的微观机制, 有助于开发不同氢同位素效应大小的贮氢材料。
致谢: 感谢沈春雷、 温成伟及蔡吴鹏在论文准备过程中提供的帮助。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|