作者简介: 李翠玲, 女, 1985年生, 北京农业智能装备技术研究中心博士后 e-mail: licl@nercita.org.cn
甜瓜的品种多样, 富含多种营养成分, 甜瓜种子品种不纯将对甜瓜生产造成一定危害, 研究采用种子的叶绿素荧光光谱结合反射光谱的分析方法鉴别甜瓜种子品种, 以甜瓜品种“一特白”、 “一特金”、 “京蜜7号”、 “京蜜11号”、 “伊丽莎白”为研究对象。 构建了甜瓜种子品种鉴别光谱系统, 包括激发光源单元、 光谱数据采集单元和数据处理单元, 使用该系统获取不同品种甜瓜种子的光谱数据。 对光谱数据分别进行一阶导数(first derivative, FD), Savitzky-Golay(SG) 平滑, FD结合SG平滑预处理。 采用主成分分析(principal component analysis, PCA)方法降低光谱数据的维数, 提取主成分。 使用两种不同分组方法将样品按照3:1的比例分为训练集和验证集, 并分别采用Fisher判别和Bayes判别分析方法建立甜瓜种子品种的判别模型。 本文比较了仅使用叶绿素荧光光谱与使用叶绿素荧光光谱结合反射光谱建立判别模型的判别结果, 结果显示, 使用叶绿素荧光光谱结合反射光谱建模的判别结果优于仅使用叶绿素荧光光谱建模的判别结果, Fisher判别分析和Bayes判别分析的验证集样品品种的判别正确率均达到98.0%。 研究结果表明, 采用叶绿素荧光光谱结合反射光谱鉴别甜瓜种子品种具有可行性。
Melon is popular with us for its high nutritional value, and there are many varieties of melons. Impurity of melon seed variety will cause harm to melon production. This research adopted chlorophyll fluorescence spectrum combined with reflectance spectrum to identify melon seeds variety. Seeds whose varieties were “Yi Te Bai”, “Yi Te Jin”, “Jing Mi No.7”, “Jing Mi No.11”, “Yi Li Sha Bai” were used as research samples. A melon seeds variety identification system based on spectrum technology was developed, and it included an excitation light source unit, a spectral data acquisition unit and a data processing unit. This system was used to obtain fluorescence spectrums and reflectance spectrums of different varieties of melon seeds. First derivative (FD), Savitzky-Golay (SG), and FD associated with SG were utilized to preprocess spectral data respectively. Principal component analysis (PCA) method was adopted to reduce the dimensions of spectral data and extract principal components. This study adopted two different grouping methods to divided samples into training set and validation set according to the proportion of 3:1, and Fisher discriminant analysis and Bayes discriminant analysis methods were used to establish discriminant models of melon seeds variety respectively. This study compared the discriminant effect of the model developed only using chlorophyll fluorescence spectral information with the discriminant effect of model developed based on chlorophyll fluorescence spectral information combined with reflectance spectral information. Results showed that discriminant model developed using chlorophyll fluorescence spectral information combined with reflectance spectral information generated better determination results than only using chlorophyll fluorescence spectral information, and the discriminant accuracies of validation set reached 98% in both Fisher discrimination analysis and Bayes discriminant analysis. Research results showed that chlorophyll fluorescence spectrum combined with reflectance spectrum technique was feasible for melon seeds variety identification.
甜瓜含有蛋白质、 胡萝卜素、 维生素B1、 维生素B2等丰富的营养物质, 在全国各地广泛栽培, 甜瓜种子的品种真实性是甜瓜种子检验的重要内容, 它不仅是甜瓜种子质量的重要评价指标, 也直接关系到甜瓜果实的质量和产量[1]。 因此研究甜瓜种子品种鉴别方法具有重要意义。 种子品种鉴定的传统方法主要有形态鉴定法, 生理生化法和分子标记法[1]。 形态学鉴定要求检验员要有丰富的经验, 易受主观因素的影响, 时间长、 难度大、 费用高。 生理生化鉴定方法很多, 但是大多需要对种子进行处理, 破坏了种子原有的特性, 费时、 耗力。 分子标记法分析速度慢、 成本高、 样品易遭破坏[2], 只适合用在基础研究中, 很难在种子生产、 销售部门得到广泛应用。 种子品种鉴定的传统方法已无法满足当前种业市场快速发展的需求, 种子品种鉴定方法逐渐向着快速、 无损、 高效的方向发展[3]。
光谱检测技术具有检测速度快、 效率高、 无污染、 非破坏的特点, 日益受到国内外研究学者、 食品企业、 种植户和养殖户的关注, 该技术也被越来越多的用于种子品种鉴定、 种子纯净度鉴定、 种子水分含量和生活力测定, 种子活力和虫害检验等方面[4, 5]。 通过对水稻[6]、 大豆[7]及玉米[8]等品种鉴别的光谱分析表明, 光谱检测技术可以保证较高的种子品种识别率, 能够实现种子品种的快速、 无损鉴别。
叶绿素存在于绿色植物和多数植物种子中, 具有荧光效应, 在激发光的照射下产生红色荧光。 1990年, Taylor首次利用Sinapine的叶绿素荧光来区分有生命的种子和死种子。 荷兰Fytagoras公司推出了基于叶绿素荧光技术的种子成熟度分析仪SA-10。 通过测量种子种皮内的叶绿素发出的荧光强度, 判断种子的叶绿素含量的高低, 进而判断种子的成熟度和种子的质量[9]。 本文的研究目标是探索采用种子叶绿素荧光光谱结合反射光谱的分析方法鉴别甜瓜种子品种的可行性, 研究一种瓜果类种子品种的快速、 高效、 无损鉴别方法。
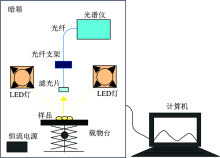
光谱系统由激发光源单元、 光谱数据采集单元和数据处理单元组成, 其结构原理简图如图1所示。 激发光源单元由2个大功率LED灯、 2个散热器和2个恒流电源组成, 大功率LED可以激发甜瓜种子的荧光, 激发光的中心波长为660 nm、 带宽为40 nm, 总功率为200 W; 光谱数据采集单元主要包括光谱仪(QE65Pro, 美国)、 光纤、 光纤支架和窄带滤光片, 用于采集甜瓜种子的反射光谱和荧光光谱, 其中, 光谱仪的敏感波长范围为200~1 100 nm, 光谱分辨率为0.14~7.70 nm; 窄带滤光片的中心波长为740 nm, 带宽为22 nm。 数据处理单元主要为计算机, 用于处理种子的反射光谱和荧光光谱数据, 并建立相关的数学模型。 此外, 该系统还包括暗箱和载物台, 暗箱用于隔离外界光线和噪声的干扰, 激发光源单元和光谱数据采集单元安装固定在暗箱内部。 载物台具有调节高度功能, 用于放置种子样品。
在激发光源单元, 大功率LED发出光的发散角为120° , 为了提高LED的发光效率和增强光强度, 使用一个聚光透镜, 使LED发出的光汇聚为发散角为60° 的光束。
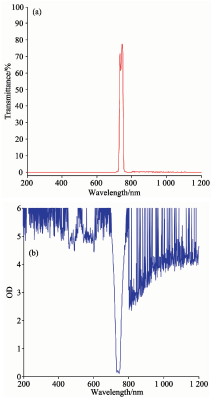
在光谱数据采集单元, 调节光纤支架, 使光纤探头与水平面的夹角为45° 。 窄带滤光片安装固定在光纤探头上, 光纤的另一端与光谱仪相连, 甜瓜种子的叶绿素荧光和反射光通过窄带滤光片, 沿着光纤到达光谱仪。 安装窄带滤光片的作用是尽可能阻止甜瓜种子的强反射光到达光谱仪, 使较强的反射光谱和较弱的荧光光谱处于相同的数量级别, 否则, 种子的荧光信号将被强反射光掩盖, 无法获得种子的荧光信号。 窄带滤光片的透过率光谱曲线和截止深度光谱曲如图2所示, 图2(a)为窄带滤光片在200~1 200 nm的透过率光谱曲线, 图2(b)为窄带滤光片在200~1 200 nm的截止深度光谱曲线。 从图2可见, 窄带滤光片的中心波长为740 nm, 带宽为22 nm, 截止深度为OD4。
本研究的种子样品为从种子店购买的甜瓜种子, 品种分别为 “ 一特白” 、 “ 一特金” 、 “ 京蜜7号” 、 “ 京蜜11号” 、 “ 伊丽莎白” , 产自中国新疆, 均为杂交种, 种子纯度均大于95.0%, 种子净度均大于99.0%, 种子水分含量均不高于8.0%。 本研究分别从每一种甜瓜种子中随机选取36份种子作为试验样品, 每一个样品的重量约为10 g, 共计180个种子样品, 种子样品放在干燥容器中, 常温下保存, 待测。
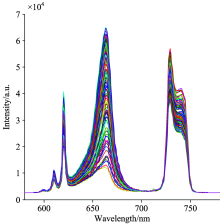
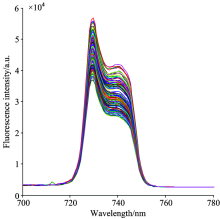
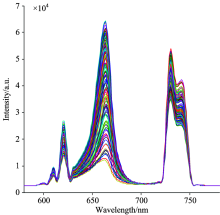
首先使光谱系统预热15 min, 使光源和光谱仪处于稳定的工作状态, 设定光谱仪的光谱采集积分时间为8 s, 平均次数为1次, 平滑度为‘ 0’ , 然后, 依次采集品种为“ 一特白” 、 “ 一特金” 、 “ 京蜜7号” 、 “ 京蜜11号” 、 “ 伊丽莎白” 的甜瓜种子样品的光谱信息。 180份不同品种的甜瓜种子样品的光谱曲线如图3所示, 有效波长范围为580~780 nm, 包括种子样品的反射光谱区580~700 nm和荧光光谱区700~780 nm。 甜瓜种子样品的荧光光谱曲线如图4所示, 从图3和图4可以看出, 甜瓜种子的反射光谱和荧光光谱的峰值强度不同。
光谱仪所采集的光谱数据除了包含样品自身的信息外, 还包含一些其他的无关信息, 如电噪音、 杂散光和样品背景等。 因此, 在用化学计量学方法建立模型时, 能够消除光谱数据中的无关信息的预处理方法起到关键作用。
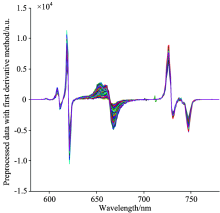
光谱数据的一阶导数处理可有效消除基线漂移和背景的干扰, 提高分辨率和灵敏度, 但同时也会降低信噪比。 SG卷积平滑法是目前应用较广泛的消噪方法, 可以有效消除光谱数据中的细小白噪声, 本研究采用FD、 SG平滑、 FD结合SG平滑预处理方法对原始光谱数据进行处理。 在本研究中, SG平滑的导数阶数为‘ 0’ , 多项式次数为‘ 5’ , 平滑点数为‘ 25’ 。 原始光谱数据分别经过SG平滑和FD预处理后的光谱曲线如图5和图6所示。 从图中可以看出, SG平滑的效果是消除细小白噪声; FD主要消除基线漂移和背景的干扰。
本研究采用两种不同的分组方法, 将样品分为训练集和验证集, 即Kennard-Stone分组方法和“ 等间隔” 分组方法, 旨在研究不同分组方法对判别模型的判别效果的影响。
2.1.1 Kennard-Stone分组
Kennard-Stone算法的优点是能够确保训练集中的样品按照空间距离均匀分布。 在本研究中, 实验样品由Kennard-Stone算法分成训练集和验证集两组, 训练集与验证集的样品数比例为3:1, 训练集包含135个样品, 验证集包含45个样品。
2.1.2 “ 等间隔” 分组
为每一类样品中的每一个样品按顺序编号, 编号时随机选择每一类中的样品, 将编号为‘ 4’ 以及‘ 4’ 的倍数的样品选出作为验证集样品, 共计45个样品, 剩下的135个样品作为训练集样品。
甜瓜种子的原始光谱经过FD、 SG平滑、 FD结合SG平滑预处理后, 虽然消除了光谱噪声、 基线漂移、 杂散光等的影响, 但是在580~780 nm波长范围内包含的267个变量中, 在700~780 nm波长范围内包含的108个变量中, 变量与变量之间依然存在一定的相关性, 如果直接用于建模, 不仅计算的数据量大, 速度慢, 而且模型的稳定性和精度都会降低[10]。 PCA将原来具有一定相关性的众多变量, 重组为一组新的相互独立的综合变量, 即主成分, 在损失较少信息的前提下把众多变量转化为几个综合变量(主成分), 每个主成分均是原来变量的线性组合, 并且各个主成分相互独立, 这就使得主成分比原来变量有某些优越的性能。 因此, 本研究采用PCA方法降低数据维数, 提取主成分, 消除变量之间的关联性, 提高建模的效率和模型的稳定性。 在本研究中, 所有主成分按照其贡献率的大小从大到小排序, 累计贡献率达到85%, 并且主成分数最小的一组主成分作为最终入选主成分, 确定入选的主成分的个数和主成分的得分, 以实现降低数据维数和消除变量之间的关联性, 提取的主成分个数如表1、 表2、 表3和表4所示。
| 表1 基于荧光光谱和Kennard-Stone 分组的甜瓜种子品种判别结果 Table 1 Discriminant results of melon seed variety based on fluorescence spectra using Kennard-Stone grouping method |
| 表2 基于荧光光谱和“ 等间隔” 分组的 甜瓜种子品种判别结果 Table 2 Discriminant results of melon seed variety based on fluorescence spectra using “ equal interval” grouping method |
| 表3 基于荧光光谱结合反射光谱和Kennard-Stone分组的甜瓜种子品种判别结果 Table 3 Discriminant results of melon seed variety based on fluorescence spectra combined with reflectance spectra using Kennard-Stone grouping method |
| 表4 基于荧光光谱结合反射光谱和“ 等间隔” 分组的甜瓜种子品种判别结果 Table 4 Discriminant results of melon seed variety based on fluorescence spectra combined with reflectance spectra using “ equal interval” grouping method |
判别分析是一种重要的统计分析方法, 本研究分别采用Fisher判别分析[11]和Bayes判别分析[12]建立甜瓜种子品种判别模型。
2.3.1 Fisher判别分析
Fisher判别分析是将高维模式样本投影到最佳的鉴别矢量空间, 以实现提取分类信息和降低特征空间维数的效果, 投影后保证模式样本在新的矢量空间有最小的类内距离和最大的类间距离。 在本研究中, 某个甜瓜种子样品的光谱数据向量为x=(x1, x2, …, xN)T, 其投影如式(1)
式(1)中, f(x)是投影函数, i=1, 2, 3, …, N, N表光谱数据向量的维数, xi是一维变量, ci是变量xi的投影系数。
2.3.2 Bayes判别分析
Bayes判别分析是一种基于Bayes统计思想的多元统计分析法。 在本研究中, 某个甜瓜种子样品用x表示, 贝叶斯判别法计算样品x属于每个类别的条件概率, 比较这些条件概率的大小, 将样品x判定为出现条件概率最大的类别。
2.3.3 判别结果
在判别分析中, 首先将甜瓜种子按照品种“ 一特白” 、 “ 一特金” 、 “ 京蜜7号” 、 “ 京蜜11号” 、 “ 伊丽莎白” 分为‘ 1’ , ‘ 2’ , ‘ 3’ , ‘ 4’ 和‘ 5’ 类, 根据Fisher判别准则和Bayes判别准则, 基于PCA提取的主成分, 建立判别函数, 将验证集样品的主成分代入判别函数, 经过计算输出验证集样品的类别信息。 甜瓜种子验证集样品品种通过Fisher判别分析和Bayes判别分析后, 判别结果如表1、 表2、 表3和表4所示。 nP表示主成分数; RCA1表示基于Fisher判别分析的训练集样品品种的判别正确率; RVA1表示基于Fisher判别分析的验证集样品品种的判别正确率; RCA2表示基于Bayes判别分析的训练集样品品种的判别正确率; RVA2表示基于Bayes判别分析的验证集样品品种的判别正确率。
通过表1、 表2、 表3和表4可以得出结论, 当仅使用叶绿素荧光光谱建立甜瓜种子的品种判别模型时, 光谱数据预处理方法没有改善模型的判别结果。 当使用荧光光谱结合反射光谱建立甜瓜种子的品种判别模型时, 光谱数据预处理方法FD与SG平滑在一定程度上改善了模型的判别结果。 使用荧光光谱结合反射光谱建模的判别结果优于仅使用叶绿素荧光光谱建模的判别结果, Fisher判别和Bayes判别分析的验证集样品品种的判别正确率均达到98.0%。 使用KS分组方法的判别结果略优于使用“ 等间隔” 分组方法的判别结果。 使用Fisher判别分析建模与使用Bayes判别分析建模的判别结果差别不大。
采用种子荧光光谱结合反射光谱的分析方法鉴别甜瓜种子品种, 构建了甜瓜种子品种鉴别光谱系统。
(1)该光谱系统包括激发光源单元、 光谱数据采集单元和数据处理单元。 激发光源单元采用大功率LED激发种子的叶绿素荧光, 激发光的中心波长为660 nm。 窄带滤光片的中心波长为740 nm, 带宽为22 nm, 其作用是尽可能阻止甜瓜种子的强反射光到达光谱仪, 使较强的反射光谱和较弱的荧光光谱处于相同的数量级别。
(2)使用KS分组方法的判别结果略优于使用“ 等间隔” 分组方法的判别结果。
(3)使用荧光光谱结合反射光谱建模的判别结果优于仅使用叶绿素荧光光谱建模的判别结果, Fisher判别和Bayes判别分析的验证集样品品种的判别正确率都达到98.0%。
(4)研究结果显示, 采用叶绿素荧光光谱结合反射光谱鉴别甜瓜种子品种具有可行性, 本研究构建的基于光谱技术的甜瓜种子品种鉴别系统具有较高的鉴别正确率。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|