作者简介: 刘燕德, 女, 1967年生, 华东交通大学机电与车辆工程学院教授 e-mail: jxliuyd@163.com
针对水果生产中的农药残留问题, 利用表面增强拉曼光谱技术(SERS), 把害虫防治使用较多的有机磷农药亚胺硫磷与毒死蜱作为研究对象, 探索性研究了将金胶用作增强基底检测以脐橙为载体的混合农药残留快速检测。 采集混合农药样品的SERS光谱, 通过对比农药的特征峰可以对混合农药进行定性分析。 同时利用化学计量学方法, 建立混合农药的定量数学模型, 并通过对比不同的预处理方法和建模波段对混合农药样品拉曼光谱的处理结果, 选择出最优预处理方法与算法的组合。 在拉曼光谱范围200~2 300 cm-1内, 利用PLS算法处理经一阶微分预处理后的光谱数据, 建立的脐橙表皮混合农药残留回归模型效果较好, 预测相关系数( Rp)为0.912, 预测均方根误差(RMSEP)为3.601 mg·L-1。 经过波段筛选后并对光谱处理结果对比, 发现光谱在200~620, 830~1 040及1 250~2 300 cm-1范围内, 利用PLS算法处理经一阶微分预处理后的光谱数据, 建立的回归模型效果较好, Rp为0.909, RMSEP为3.338 mg·L-1。 研究表明使用SERS技术, 可以对脐橙表皮上残留的混合农药进行定性与定量的分析。
Pesticide residue in agricultural and sideline products has become a social problem. In order to solve the problem of pesticide residue in fruit production, the rapid detection of mixing pesticide residues with navel orange as carrier was explored by surface enhanced Raman spectroscopy (SERS). The organophosphorus pesticides phosmet and chlorpyrifos were the objects of study because they were used more in the field of pest control, and gold colloid was prepared to get the SERS of the organophosphorus pesticides. The SERS spectra of the mixing pesticide samples were collected, and the characteristic peaks of the pesticides could be used for qualitative analysis of the mixing pesticide. At the same time, the stoichiometric method could be used to establish the quantitative mathematical model of the mixing pesticide, and the combination of the optimal pretreatment method and the wavenumber could be selected by comparing the modeling results of the Raman spectra. In the Raman spectrum range of 200~2 300 cm-1, the partial least square (PLS) was used to build the model of the spectral data after the first derivatives data preprocessing. The results of the combined regression model were better, and it showed that the correlation coefficient ( Rp) was 0.912, Root mean square error (RMSEP) was 3.601 mg·L-1. After spectral screening and comparison of the spectral results, it was found that the best model of the spectra was established by the PLS in the range of 200~620, 830~1 040 and 1 250~2 300 cm-1. The regression model had better effect, in which Rp was 0.909 and RMSEP was 3.338 mg·L-1. It had shown that the SERS technology could be used to qualitatively and quantitatively analyze the mixing pesticide residues on navel orange.
随着科学技术的进步以及农业自动化的快速发展, 农产品的生产效率不断提高。 提高农作物产量的同时, 农药滥用的问题也随之出现。 滥用农药会导致消费者购买的农产品中的农药残留超标, 危及消费者的食品安全, 严重威胁了居民身体健康[1, 2, 3]。 近年来, 爆发的若干次食品安全事故已经引起了广大群众的关注。 同时, 农残超标问题也会影响我国农产品的出口。 世界各国对进出口食品的安全问题均高度重视, 制定了越来越严格的农药残留限制标准, 对我国农副产品的出口提出了新的要求。 对于质检部门、 消费者及生产厂家, 如何准确并快速的检测农药残留变得十分重要。 革新农药残留检测的方法, 提高检测效率与精度也十分重要[4]。 我国现在也在大力发展农药检测技术, 对保障本国国民的食品安全有十分重大的意义[5]。
表面增强拉曼散射(SERS)相比于普通的拉曼光谱技术, 可以增强普通拉曼信号, 获得的信号甚至是普通拉曼信号的106倍, 其中可以容易得到被测的结构等丰富信息[6], 提高拉曼光谱的检测效率。
现在最权威的有机磷农药检测的方法是GC[7, 8]和HPLC[9, 10], 传感器法[11], 酶法[12]等方法使用得也很广泛。 这些方法的优点是技术成熟, 检测灵敏度和准确性好, 但是缺点是检测耗时长, 过程繁琐, 成本高等, 与当前生产生活中快速、 准确、 低成本的检测需求相悖。 而SERS技术具有检测快捷方便、 灵敏度高和无损探测等特点, 具有极高的研究价值。 Pan等[13]利用SERS技术, 检测有机磷杀虫剂, 发现杀螟松的检测限是34 nmol· L-1, 有机氧磷的检测限为96 nmol· L-1。 Fateixa等[14]以银胶为增强基底, 检测二乙基二硫代氨基甲酸钠, 检测限为10-5mol· L-1。
本研究光谱采集使用的是共焦显微拉曼光谱仪, 研究对象为有机磷农药亚胺硫磷(C11H12NO4PS2)和毒死蜱(C9H11Cl13NO3PS)所组合成的混合农药, 其中两种农药的质量比为1:1。 SERS基底为金胶, 采集脐橙表皮残留混合农药样品的SERS光谱。 使用偏最小二乘(PLS)和主成分回归(PCR)这两种建模算法, 多种不同的光谱预处理方法, 建立定量数学模型, 对混合农药进行定性与定量分析, 为混合农药的检测提供一种新的思路。
使用SENTERRA共聚焦显微拉曼光谱仪, 积分时间设置为10 s, 激光波长为785 nm, 激光功率选择10 mW。
实验所用的亚胺硫磷粉末的纯度为99.7%, 毒死蜱粉末的纯度为99.5%; 实验用到的试剂有氯酸金(HAuCl4· 4H2O)、 乙腈、 柠檬酸三钠、 甲醇及氯化钠, 均为分析纯; 实验用水为超纯水; 水果样品为赣南脐橙。
将亚胺硫磷和毒死蜱农药标准样品粉末分别溶于甲醇, 分别得到浓度为5 000 mg· L-1的标准农药样品溶液。
取脐橙的表皮仔细清洗干净, 称取4 g放入烧杯, 分别加入1 mL的亚胺硫磷和毒死蜱的标准溶液。 向其中加入50 mL乙腈, 充分搅拌后过滤, 加入7 g NaCl后, 倒入100 mL具塞量筒中, 定容后静置。 溶液出现分层现象后, 取上层乙腈相, 加热蒸发其中的乙腈, 加入甲醇溶液, 制备出亚胺硫磷与毒死蜱混合滤液。
用滤液配制样品共31个, 浓度范围为2~22 mg· L-1, 其中在12~22 mg· L-1的梯度为1 mg· L-1, 2~12 mg· L-1的梯度为0.5 mg· L-1。
制备金胶使用柠檬酸钠还原法[15]。 将2 mL的1%的柠檬酸钠溶液迅速加入100 mL已经沸腾的质量分数为0.01%的HAuCl4溶液中, 加热并搅拌至溶液呈红色。
以3:10:3的比例混合金胶、 农药样品和氯化钠溶液, 充分混合后采集拉曼光谱。 每个浓度的样品采集5条有效的拉曼光谱。
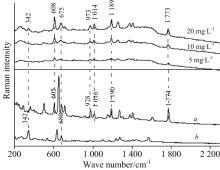
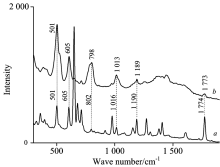
以金胶为SERS基底, 分别采集各个样品的SERS光谱, 并分别与两种农药标准粉末的拉曼光谱进行对比, 如图1所示。 为了确定增强效果的有效性, 图2为毒死蜱粉末拉曼光谱与毒死蜱溶液的SERS光谱的对比。 图3为亚胺硫磷粉末拉曼光谱与亚胺硫磷溶液的SERS光谱的对比。 由图中信息可得出, 两种农药都分别有特征峰得到增强, 均能在图中找出且增强效果良好, 即使在浓度为5 mg· L-1是依然能检测出。 两种农药的特征峰归属见表1。
| 表1 混合农药的拉曼谱带归属 Table 1 Band assignments of major peak in Raman spectra acquired from mixture of pesticides |
结合图2与图3可以发现, 样品的SERS光谱中被增强的混合农药特征峰有342, 608, 675, 973, 1 014, 1 189和1 773 cm-1, 其中属于毒死蜱的特征峰有342, 675和1 014 cm-1, 亚胺硫磷的特征峰有608, 973, 1 014, 1 189和1 773 cm-1。 1 014 cm-1处为两种农药共同的特征峰。 对比农药的拉曼谱峰归属, 608 cm-1处为原位置为605 cm-1的环变形峰, 675 cm-1处为原位置为680 cm-1的环呼吸振动峰, 973 cm-1处为原位置为978 cm-1的C— C— O伸缩峰, 1 014 cm-1处为原位置为1 016 cm-1的骨架伸缩峰位, 1 189 cm-1处为原位置为1 190 cm-1的环呼吸峰, 1 773 cm-1处为原位置为1 774 cm-1的反对称C=O伸缩峰。
 | 图2 毒死蜱粉末拉曼光谱(a)与毒死蜱溶液的SERS光谱(b)Fig.2 Raman spectra of chlorpyrifos powder (a) and SERS spectra of chlorpyrifos solutions (b) |
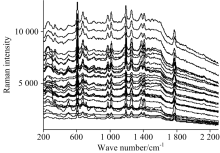
分别采集31个样品浓度范围为2~22 mg· L-1的混合农药残留溶液的SERS光谱, 200~2 300 cm-1为选择的光谱范围, 平均光谱为5条光谱取平均, 如图4所示。 在图中可以看出, 在该浓度范围内光谱中谱峰的峰强随着农药含量的改变而改变。 由此可得出金胶对脐橙表皮中萃取出的亚胺硫磷和毒死蜱都分别有明显的增强效果, 且呈梯度变化, 可以对其进行建模计算。
分别选取五种光谱预处理方法, 分别为卷积平滑(Savitzky-golay smoothing), 多元散射校正(MSC)、 基线较正(Baseline)、 一阶导数(First derivative), 二阶导数(Second derivative)。 校正集为选取的24个样品, 预测集为剩余的7个样品, 通过PLS算法构建混合农药的定量分析模型。 对比不同的预处理方法的建模结果, 比较校正集和预测集的相关系数及均方根误差, 结果如表2所示。 同时兼顾模型的预测准确性与稳定性, 可得经一阶导数处理后建立的模型最好, Rp=0.912, RMSEP=3.601 mg· L-1。
| 表2 不同预处理光谱预处理结果PLS建模结果 Table 2 Comparison results developed by PLS with different preprocessing methods |
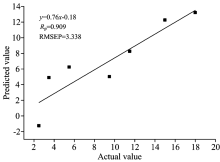
由于建立模型采用的SERS光谱范围为200~2 300 cm-1, 其中包含了4 201个波数点, 其中包含了许多无用信息, 所以构建模型时, 会花费更多的时间。 为了节约时间的同时改善模型的预测效果, 提高建模的效率, 可以选择特定的波数范围进行建模, 与未进行波段筛选的建模结果进行对比, 进一步研究波数范围的选择是否会对建模效果的产生影响。 把混合农药SERS光谱预处理后, 将光谱数据筛选出若干波段, 并对波段进行自由组合, 使用PLS算法对不同波段组合的重组光谱进行建模, 得到不同波段的建模结果后进行对比, 如表3。 经对比可以得到, 波段筛选后建立的模型中, 效果均有所提高。 在200~410和620~2 300 cm-1组成的波段范围, 校正集模型稳定性较好, 其中Rc=0.977, RMSEC=1.226 mg· L-1; 在200~620, 830~1 040和1 250~2 300 cm-1组成的区间内, 建立模型的预测效果最好, 其中Rc=0.975, RMSEC=1.282 mg· L-1, RP=0.909, RMSEP=3.338 mg· L-1。 综上, 样品SERS光谱在200~620, 830~1 040和1 250~2 300 cm-1组成的范围内, 使用一阶导数预处理后基于PLS算法建立的模型效果较好。
| 表3 不同光谱范围的PLS模型结果 Table 3 Comparison results developed by PLS with different spectral ranges |
根据预处理方法的选择和波段范围的选择, 选择一阶导数预处理方法, 选择光谱波数范围200~620, 830~1 040和1 250~2 300 cm-1。 为了比较不同算法对建模效果的影响, 使用目前常用的PLS和PCR算法, 分别建立混合农药的定量分析模型, 两种算法都选择同样的校正集与预测集, 其中校正集为已经选取的24个样品, 预测集为剩余的7个样品, 对比这两种算法的预测结果, 结果如表4所示。
| 表4 建模性能的比较 Table 4 Modeling comparison results |
由表4可知, 被波段筛选后的拉曼光谱数据经PLS算法运算后, 建立模型的预测效果比PCR算法得到的结果较好, 其中, Rp=0.909, RMSEP=3.338 mg· L-1。 用得到的模型来预测事先选择的预测集样品, 将得到的预测值与实际值进行对比, 如图5。 由图可知, SERS技术和金胶的结合可以用于果皮表面的混合农药的定性与定量分析, 辅以光谱数据的波段筛选、 多种预处理方法以及化学计量学算法, 建立混合农药的分析模型, 预测模型能取得很好的效果。
探究了SERS技术在水果表皮混合农药检测方面运用的可行性。 首先制备了金胶作为农药的增强基底, 检测了从脐橙表皮萃取出的混合农药残留溶液, 找到分别属于亚胺硫磷和毒死蜱的特征峰, 排除干扰后可以分辨出两种农药的存在, 证明了SERS技术是可以用于混合农药定性分析的。 然后, 使用不同的预处理方法, 并与偏最小二乘(PLS)和主成分回归(PCR)算法这两种算法相结合, 还进行了光谱数据的波段筛选, 最后建立了脐橙表皮上的混合农药残留的定量分析模型。 对比结果后发现, 采用一阶导数预处理、 PLS算法计算得到的定量模型预测精度最佳。 本文对水果混合农药残留检测这种复杂的检测做了一定的探索, 证明了SERS技术可实现对农药残留的快速检测, 在方便实际生产生活中的农残检测方面具有一定的优势。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|