作者简介: 张彩红, 女, 1990年生, 西南大学化学化工学院硕士研究生 e-mail: 1554943642@qq.com
以L-半胱氨酸(L-Cys)组装银纳米棒的SERS传感器检测汞离子。 讨论了能捕获汞离子的标记分子的种类, 选择L-Cys为标记分子, L-Cys通过S—Ag键链接在银纳米棒表面。 紫外-可见吸收光谱对银纳米棒及组装上L-Cys和Hg2+分别进行表征, 通过10种金属离子验证了该分子探针的对汞离子的特异性吸附, 构建了“Ag-L-Cys-Hg”层状结构。 标记分子-金属纳米粒子偶联物的稳定性由配体分子、 温度、 pH值等决定, 讨论了L-Cys标记分子的浓度、 pH值、 温度的最佳条件, 对一系列汞离子浓度进行测定, 线性范围在0.01~1 μmol·L-1之间, 相关系数为0.990, 检出限为1 nmol·L-1。 对实际水样进行了测定, 加标回收率在85%~103%之间。 建立了一种高效、 快捷、 灵敏度高、 稳定性好痕量测定Hg2+的方法。
In this paper, a detection of trace Hg(Ⅱ) was based on silver nanorods by surface-enhanced Raman spectroscopy (SERS)activity. It was discussed the probe types, which explored that the L-cysteine with a high selectivity and sensitivity for Hg(Ⅱ). The UV/Vis spectra was used to characterize the silver nanorods and its modified the L-Cys. Based on L-cysteine of SERS was high sensitivity and selectivity for Hg(Ⅱ) on condition that the ten kinds of metal ions carried on, but only when the single-peak at 1 040 cm-1 structure appeared after adding the Hg(Ⅱ). SERS sensor with L-cysteine assembled silver nanorods firmly captured the Hg(Ⅱ) through the S-Hg bond. It was valuable to get the molecular probe of the concentration, pH and temperature, in which the result showed the optimization when the density of L-cysteine was 1×10-3 mol·L-1 and pH was 7. It did not have a great effect on temperatures, but was down trend over 55 ℃. In order to protect the structure of L-Cysteine and form complexes rapidly, it was selected temperature about 45 ℃. Under the optimized conditions, a series of the concentration of mercury ions were measured, in which the result showed that the density of mercury ions between 0.01 and 5 μmol·L-1 can be analyzed because of a strong peak at 1 040 cm-1 with good linear relationships (correlation=0.990) with the detection limit of 1 nmol·L-1. Which had very excellent sensitivity and stability. When Hg2+ was tested in real water samples, the recovery was from 85%~103%. It establishes a good way to determine the trace Hg(Ⅱ).
汞离子已成为污染环境最关注的一种重金属离子[1, 2], 特别是在食物链上的生物累积, 最终伤害人类的中枢神经、 肝及其他器官, 损害人体健康[3, 4, 5]。 测定汞的含量已成为人们关注的问题, 现在已有多种检测汞含量的方法, 如比色法[6]、 共振瑞利散射[7]、 原子荧光谱法[8]等, 由于Hg2+在溶液中难富集分离, 传统测定Hg2+的方法灵敏度低, 前处理过程复杂。 常规拉曼散射十分微弱, 限制了在定量方面的应用, 但是随着纳米材料技术的发展, 使表面增强拉曼光谱(SERS)快速发展[9, 10, 11, 12]。 拉曼光谱虽然不能直接检测重金属离子, 但是很多科研团队将重金属离子链接在标记分子, 检测出拉曼信号[13, 14, 15], Tapas Senapati等[16]用色氨酸为标记分子与Hg(Ⅱ )形成复合物, 测定其增强拉曼信号; Ren等[17]以结晶紫为分子探针, 银胶为增强基底, 测定不同状态的汞含量; Wang等[18]以核酸适配体固载汞离子, 用SERS检测。 Xu[19]用DNA修饰金纳米以“ T-Hg-T” 结构形成链状。 在以色氨酸[16]、 结晶紫[17]、 DNA[19]、 罗丹明6G[20]、 维多利亚蓝B[21]等为标记分子时, 检测Hg2+浓度时, 都会出现了明显的背景峰且杂峰数量多, 不便于数据处理。 选择一种特异强、 灵敏度高的标记分子具有很大的挑战。 本文选择以L-半胱氨酸(L-Cys)为标记分子, 结构简单的L-Cys与Hg2+形成“ Ag-L-Cys-Hg” 夹层结构, 组装的SERS传感器信号简单, 只在1 040 cm-1处显示出唯一明显的特征峰, 且前处理简单, 不受其他干扰离子影响。
本文讨论了汞与肌肽、 维生素H、 牛血清白蛋白(BSA)与L-Cys组装银纳米棒的SERS传感器, 由于L-Cys在1 040 cm-1处有显著的特征峰, 最后选取L-Cys为标记分子, 半胱氨酸里含有巯基(— SH), 易与纳米银键合。 用紫外-可见光谱表征说明了其良好的分散性, 选取10种金属离子进行干扰实验, 结果显示只有Hg2+的溶液在1 040 cm-1的特征峰明显增强, 说明L-Cys组装的银纳米棒对Hg2+有良好的选择性。 由于标记分子的浓度、 温度和pH值会影响传感器的稳定性, 所以探讨了L-Cys与汞结合的最优条件, 并对实际水样中的汞含量测定并进行加标回收, 建立了一种简单、 快捷、 高效用拉曼光谱检测汞离子的方法。
FS-100型傅里叶变换拉曼光谱仪(德国Bruker公司), Nd:YAG激光光源(1 064 nm), 液氮冷却Ge检测器, 分辨率4 cm-1; DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司); 80-1台式低速离心机(金坛科技仪器有限公司); 牛血清白蛋白(BSA, BR, > 99.0%, 如吉生物科技), 肌肽(阿拉丁), 维生素H(成都科龙化工试剂厂), 硝酸汞(AR, 99.5%)、 乙二醇(AR, 99.5%)、 硝酸银(AR, ≥ 99.8%)、 氯化钠(AR, ≥ 99.5%)、 六水三氯化铁(AR, ≥ 99.0%)、 乙醇(AR, 95.0%)均购于重庆川东化工(集团)有限公司; 聚乙烯吡咯烷酮(PVP, AR, 95.0%)购于国药集团化学试剂有限公司。 硫酸铜、 硫酸镉、 硫酸钠、 硫酸钾、 硫酸锰、 硫酸锌、 硫酸镍、 硫酸镁、 硫酸铝均为分析纯, 购于重庆北碚化学试剂厂。
依据Ma[22]的方法制备银纳米棒。 配制浓度为1.0× 10-3 mol· L-1的肌肽、 维生素H、 BSA和L-Cys溶液, 选择L-Cys为标记分子, 配制一系列(1× 10-1→ 1× 10-8 mol· L-1)的L-Cys溶液, 银纳米棒与L-Cys溶液按照1:2比例混合, 然后取200 μ L滴在干燥的1 cm× 1 cm玻璃片上, 室温下晾干。 配制浓度为1.0× 10-4 mol· L-1的金属离子溶液, 用0.1 mol· L-1 HCl和NaOH调节pH值, 配制不同浓度的汞离子溶液, 用SERS进行检测。
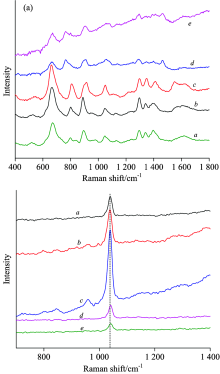
本实验探讨了不同标记分子对汞离子的表面增强拉曼效应, 如图1所示, 分别是维生素H、 肌肽、 BSA及L-Cys的SERS以及这些标记分子对汞离子的SERS响应。
维生素H的结构中含有C=O, N— H, — S— 和— COOH等基团, 而环上的N, S和O原子的未共用电子对参与环状共轭, 使得环上的电子云密度增大, 而原子的电子云密度降低, 减弱了对银纳米的静电作用。 加入汞离子后, 如图1b所示只出现了1 040 cm-1处的特征峰, 峰强度较小。 肌肽是由L-组氨酸和β -丙氨酸组成的二肽[23]。 肌肽含有— COOH, — N=, N— H, C=O基团, SERS信号由于电势碳化干扰严重[24], 加入汞离子后, 如图1d所示出现的拉曼峰不明显。 BSA中含有氨基酸残基、 二硫键、 肽链等, 有大量的立体空间构型, 与纳米银形成自组装探针时, 复杂基团之间形成竞争, 使增强效果受到抑制, 加入汞离子时, 如图1f所示, 也由于其复杂的分子结构, 拉曼信号很弱。 L-Cys的SERS出现明显的特征峰图1g所示, 691 cm-1归属于C— S键的伸缩振动, 913 cm-1归属于C— C— N的伸缩振动及1 350 cm-1附近的C— N振动。 在加入Hg2+后图1h所示, 在1 040 cm-1附近出现了一个强烈的特征峰, 而其他特征峰相对比较低。
如图2所示, 是L-Cys修饰银纳米棒的SERS传感器原理图, 含巯基的基团与纳米棒相互作用, 构成稳固的Ag— S键, 形成以L-Cys修饰功能化的银纳米粒子, 向外伸展的游离的羧基(— COO— )在静电作用下吸附溶液中的Hg2+。 构建“ Ag-L-Cys-Hg2+” 三层结构。
综上所述, 在用L-Cys为标记分子的SERS在1 040 cm-1处有明显的特征峰, 而其他的特征峰不明显且特征峰出现的数量少, 抗干扰能力好。 为了能准确测定汞离子含量, 选择了L-Cys为标记分子。
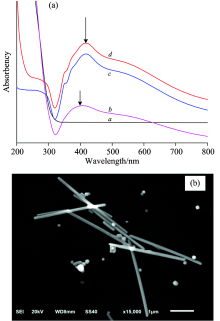
图3是L-Cys, L-Cys组装银纳米棒的紫外-可见吸收光谱图(a)及银纳米棒的SEM图(b), 银纳米棒的平均粒径为200 nm。 如图3(a)的a所示, L-Cys没有紫外吸收峰, 银纳米的最强吸收峰如图3(a)的d所示出现在417 nm处, 该强吸收峰属于银的等离子体共振吸收; 如图3(a)的c所示银纳米棒被L-Cys修饰后, 吸收峰的峰位不变, 说明L-Cys并不影响银纳米的吸收峰; 而与汞离子组装后吸收峰[如图3(a)的b所示]明显蓝移到了399 nm处, 吸收峰强度减弱, Hg2+能使纳米银特征峰蓝移, 归因于关联的Hg2+和银纳米棒有表面等离子共振作用, 电磁效应降低, 但没有发生猝灭, 说明并没有产生银汞合金[25]。 同时也验证L-Cys组装的银纳米棒有良好的分散性。
特异性是传感器的一个重要指标, 为了探究L-Cys组装的银纳米棒的SERS传感器对Hg2+的选择性, 对K+, Al3+, Mg2+, Na+, Mn2+, Ni2+, Cu2+, Zn2+和Cd2+进行了对比检测实验如图4所示, 分别配制1× 10-3 mol· L-1的离子盐溶液加入在样品中, 在1 040 cm-1处特征峰的强度除了Hg2+增强外, 其他均明显减弱, 且Hg2+的加入只出现了1 040 cm-1处的一个特征峰, 没有其他特征峰的干扰, 图5是各种离子及其混合物的SERS, 由图看出, 在混合溶液中, 其他干扰离子的存在对Hg2+的检测几乎没有影响, 说明了该基于L-Cys组装的SERS传感器对Hg2+有优良的特异性。
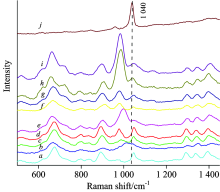 | 图4 基于L-半胱氨酸的SERS传感器 对各种金属离子的测定Fig.4 Determination of various metal ions based on L- cysteine SERS sensor a: K+; b: Al3+; c: Mg2+; d: Na+; e: Mn2+; f: Ni2+; g: Cu2+; h: Zn2+; i: Cd2+; j: Hg2+ |
标记分子L-Cys修饰银纳米的SERS传感器的稳定性取决于标记分子的浓度、 温度和pH值等。
L-Cys的浓度会影响吸附在银纳米表面的吸附状态, 配制一系列的不同浓度的L-Cys溶液, 在中性条件下测定其SERS如图6所示, 在浓度为1× 10-1 mol· L-1时, 没有出现明显的拉曼特征峰, 是由于分子探针在浓度较高时, 出现了聚集, L-Cys不能均匀的分散。 在浓度为1× 10-2和1× 10-3 mol· L-1显示出稳定的特征峰, 在1× 10-2 mol· L-1时, 拉曼峰在1 200~1 800 cm-1出现了不稳定。 在浓度小于1× 10-3 mol· L-1时, 由于探针分子数量太少, 与银纳米棒组装杂乱, 无规则吸附, 出现的特征峰极弱。 综上所述, 最佳的分子探针浓度为1× 10-3 mol· L-1, 在该浓度下, L-Cys上的巯基通过静电作用链接在银纳米棒, 银纳米棒表面被L-Cys规则的修饰, 另一端裸露羧基。
用0.1 mol· L-1 NaOH和0.1 mol· L-1 HCl调节pH值, 测定L-Cys[如图7(a)]及L-Cys组装银纳米棒对汞离子响应[如图7(b)]在不同pH值下的SERS。 L-Cys在不同的pH下, 分子的电离状态不同。
 | 图7 不同pH值L-Cys的SERS(a)和L-Cys组装银纳米棒对汞离子响应的SERS(b)Fig.7 SERS of L-Cys with digferent pH (a) and values on the mercury ion response (b) pH: a: 1; b: 3; c: 6; d: 7; e: 9 |
在酸性条件下, L-Cys的SERS特征峰比较明显, L-Cys以— N
在pH值接近中性时, 效果最佳, L-Cys修饰的纳米银棒一端裸露出羧基, Hg2+与羧基形成稳定的化学键, 构成空间的网状的立体构型, Hg2+嵌入其立体网状中。
在不同的温度下测定L-Cys及L-Cys组装银纳米棒对汞离子响应(如图8)的SERS, 由图看出温度对SERS的影响不大。 L-Cys的SERS在7和15 ℃时, 在1 040 cm-1处的特征峰强度较弱, 加入Hg2+后, 特征峰仍然较弱, 在温度较低的情况下, L-Cys与银结合的较慢, 造成大多数分子并没有结合在基底上。 在45和55 ℃时, 加入汞离子的特征峰最好, 结合时间快, 加入汞离子后[如图8(b)]的1 040 cm-1处的特征峰也很明显。 在65 ℃时, L-Cys和加入Hg2+后, 特征峰有减弱的趋势, 温度升高时, 分子剧烈运动, 在部分分子的撞击下使另一部分分子与基底的链接断裂。 为了防止高温破坏探针分子结构, 保持标记分子的生物活性, 所以选择45 ℃条件下测定L-Cys的SERS, 在此温度下结合时间快, 出现的特征峰强度最好。
在pH值为中性和温度在45 ℃的条件下, L-Cys上的巯基吸附在银纳米表面, 另一端的羧基与汞离子形成COO— Hg键, 构建“ Ag-L-Cys-Hg2+” 的夹层结构, 拉曼光谱也发生变化。 加入Hg2+后, 1 040 cm-1处的特征峰拉曼峰都有增强, 当浓度在在0.01~1 μ mol· L-1之间时, 强度依次增强呈线性关系, 检测限是1 nmol· L-1, 在大于5 μ mol· L-1后, 峰的强度变化不大。 图9是不同浓度Hg2+的与SERS相对应的曲线图及浓度在0.01~1 μ mol· L-1之间拟合出线性方程, 相关系数为0.990, 便能计算出溶液中Hg2+的含量。
国家标准(GB/T5009.17— 2003)饮用水含游离汞离子不能超过0.01 ng· mL-1, 用本实验方案对实际水样进行测定, 水样取至重庆嘉陵江水, 实际水样经简单处理配制含汞浓度(0, 1× 10-7和5× 10-7 mol· L-1)一系列的样品, 进行加标回收实验, 每个样品平行测定3次, 如图10(a和b)所示, 加入实际水样和没有加入实际水样, 在1 040 cm-1处均没有出现特征峰。 在已建立的标准曲线上计算出实际水样Hg2+浓度和加标回收率, 回收率在85%~103%之间(表1所示)。
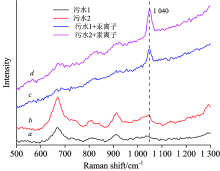 | 图10 实际水样的SERS传感器检测Fig.10 SERS spectra for the determination of real water samples a: Actual sample; b: Blank; c: cHg2+=1× 10-7; d: |
| 表1 江水的回收率实验 Table 1 Water recovery rate experiment |
构建以L-Cys组装银纳米棒的SERS传感器定量测定Hg2+的高灵敏度方法。 探究了标记分子的种类, 实验结果显示以L-Cys为标记分子在1 040 cm-1处的特征峰最好, 峰型稳定且单一, 所以选择以L-Cys为标记分子, 探讨了探针分子与汞离子组装的复合物的紫外-可见吸收光谱, L-Cys不影响纳米银的紫外吸收峰, 而加入Hg2+后, 吸收峰蓝移, 降低了电磁效应。 通过其他干扰离子的SERS响应, 验证了标记分子对Hg2+的优良的选择性, 讨论了标记分子的浓度、 pH值和温度的条件, 最后选择在浓度为1× 10-3 mol· L-1, pH值为中性和温度为45 ℃的条件下, 测定一系列Hg2+的浓度, 浓度在0.01~1 μ mol· L-1之间具有良好的线性, 检测限是1 nmol· L-1。 在实际湖水和江水中进行测定, 加标回收率在85%~103%之间。 提供了一种高效、 简捷测定汞离子的检测方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|